2. 武汉大学基础医学院生物化学与分子生物学系 湖北 武汉 430071
2. Dept. of Biochemistry and Molecular Biology, Wuhan University School of Basic Medical Sciences, Wuhan 430071, China
氧化、炎症、血脂紊乱状态下细胞对脂质的多进少出,导致胞内脂质代谢失衡而积聚大量脂滴,已公认为是动脉粥样硬化、非酒精性脂肪肝等代谢性疾病的中心环节。溶酶体酸脂酶(lysosomal acid lipase,LAL)是溶酶体内特有的水解脂质的关键酶,可以将转运至溶酶体内的胆固醇酯(cholesterol esters,CE)和甘油三酯(triglyceride,TG)水解产生游离胆固醇(free cholesterol,FC)和脂肪酸而促进脂质水解利用和外排,对于胞内处理呈递脂质发挥重要作用[1]。研究表明,LAL和机体脂质代谢相关的一些重要疾病诸如冠状动脉疾病、脂肪肝、肝纤维化、癌症等都有密切联系[2, 3],基因变异引起的LAL功能降低会导致肝内酯化的胆固醇和TG积聚,引发胆固醇酯沉积病(cholesterol ester storage disease,CESD)和早期动脉粥样硬化,婴幼儿LAL功能严重缺乏者甚至会形成Wolman病[4]。实验研究发现,LAL基因敲除小鼠模型表现为多器官炎症因子水平升高和肝脏中性脂质累积加剧[5];人们逐渐在治疗脂质代谢失衡的相关疾病中关注到细胞中LAL的作用。采用特异表达或补给的方法增加LAL可明显降低细胞泡沫化,抑制小鼠As斑块[6];外源给予重组人源LAL蛋白可以改善CESD疾病状态,降低循环中胆固醇和TG水平,减轻肝脏损伤[7]。这些研究都提示,LAL的功能体现是维持机体细胞脂质代谢平衡的重要靶点,保护机体各器官组织处于正常平衡状态。
尽管溶酶体LAL可能是细胞脂质水解的重要调节者,但是其具体的细胞调节功能及作用机制尚未完全明了。因此本研究拟构建含小鼠源性LAL基因的慢病毒表达载体,旨在建立真核细胞LAL高表达模型,为进一步探究LAL在细胞脂质代谢中的作用与机制,以及在相关代谢性疾病中的诊疗价值奠定基础。
1 材料与方法 1.1 主要材料和试剂小鼠肝癌细胞Hepa 1-6细胞购自武汉普诺赛生命科技有限公司;pWPI-GFP慢病毒载体受赠于美国South Carolina大学医学院樊大平博士;C57BL/6J小鼠购自湖北省疾病预防控制中心;PCR试剂、逆转录试剂盒购自Toyobo公司;质粒提取试剂盒和DNA凝胶回收试剂盒均购自Axygen公司;DNA Marker购自天根生化科技有限公司;大肠杆菌E.coli DH5α为本实验室所保存;LB培养基购自OXOID公司;限制性内切酶PacⅠ、T4 DNA连接酶购自Thermo Fisher Scientific公司;Lipofectamine 2000购自Invitrogen公司;DMEM高糖培养基、Opti-MEM培养基、胎牛血清、胰酶购自Gibco公司;其他试剂均为国产分析纯或是进口分装。
1.2 方法 1.2.1 pWPI-LAL重组载体的构建采取C57BL/6J小鼠肝脏组织加入TRIzol试剂匀浆裂解,氯仿分层,吸取上清,异丙醇沉淀水相RNA,乙醇清洗后DEPC水溶解并检测RNA浓度,用逆转录试剂盒逆转录RNA为cDNA。根据C57BL/6J小鼠肝脏cDNA文库和pWPI-GFP表达载体图谱设计PCR的特异寡核苷酸引物,于目的基因编码片段5′端加入PacⅠ酶切位点和保护碱基,上游引物5′-GGTTAATTAATCTGGAGGCTGAGGTTGGAG G-3′,下游引物5′-GCCGTTTAATTAAGTATTCAAGTCCAGGCATTCAC-3′,引物经由上海桑尼生物科技有限公司合成,扩增片段全长1 242 bp。PCR反应条件(95 ℃变性,56 ℃退火,72 ℃延伸),产物经1%琼脂糖凝胶电泳后利用凝胶成像仪观察目的DNA条带位置。
PCR扩增产物和pWPI-GFP载体分别经限制性内切酶PacⅠ酶切(37 ℃水浴3 h),将酶切产物经1%琼脂糖凝胶电泳分离鉴定,并通过凝胶回收试剂盒纯化回收目的片段,然后经由T4 DNA连接酶16 ℃连接8 h,连接产物转化入大肠杆菌感受态细胞DH5α,于含氨苄青霉素(ampicillin,Amp)的LB固体培养基培养12-16 h,次日挑取单克隆菌落于3 ml含有Amp的LB液体培养基内振摇过夜,收集菌液提取质粒,PCR扩增LAL基因片段,经1%琼脂糖凝胶电泳后凝胶成像系统内观察DNA条带。阳性克隆送上海桑尼生物科技有限公司测序,检测插入序列是否完全正确。
1.2.2 pWPI-LAL表达载体转染Hepa 1-6细胞及氧化条件建立将状态良好处于对数生长期的小鼠肝癌细胞Hepa 1-6按照1×106个/孔接种于6孔培养板,给予含有10%胎牛血清的DMEM高糖培养基,于37 ℃ 5% CO2细胞培养箱内培养,待细胞融合度到达70%-90%并且细胞状态上佳时,即可转染。转染前2 h更换培养基为Opti-MEM培养基,转染时先在Ep管内将7.5 μl Lipofectamine 2000试剂加入250 μl Opti-MEM培养基内,轻轻混匀,室温静置5 min,在另一Ep管内将2.5 μg pWPI-LAL重组质粒加入250 μl Opti-MEM培养基内,混匀,将DNA悬液和Lipofectamine 2000悬液混合,轻轻摇匀,室温静置20 min,将DNA和Lipofectamine 2000混合液缓慢均匀加入6孔板孔内,置于培养箱中培养4-6 h后将培养基换成10%胎牛血清的DMEM高糖培养基,48 h后荧光显微镜观察绿色荧光蛋白(GFP)表达情况以检测重组载体的转染效率。氧化组即以30 μg/ml氧化型LDL(oxidative LDL,ox-LDL)[取LDL 1 mg/ml与10 μmol/L Cu2+于37 ℃共孵育24 h,并采用0.2 mmol/L ETDA(pH 7.4) 终止反应,PBS透析过夜,0.45 μm过滤后获得]处理转染成功细胞,细胞置于37 ℃、5% CO2温箱内孵育,8 h后收集细胞。
1.2.3 实时定量PCR检测目的基因表达水平收集处理的转染细胞用TRIzol试剂提取总RNA并逆转录成cDNA。采用qPCR检测细胞目的基因的表达水平,PCR引物如下: LAL上游引物5′-GACCACTCCCGATGCAACTC -3′,下游引物5′-GACCGAGTGTTCCTCACCAG-3′;TNF-α上游引物5′-CGTCAGCCGATTTGCTATCT -3′,下游引物5′-CGGACTCCGCAAAGTCTAAG -3′;IL-6上游引物5′-AGTTGCCTTCTTGGGACTGA-3′,下游引物5′-TCCACGATTTCCCAGAGAAC-3′。相对定量采用比较Ct值的方法:以18s rRNA为内参,ΔCt=CtpWPI-LAL-Ct18s,ΔΔCt=ΔCt实验组-ΔCt对照组,最终计算出目的基因表达倍数为(Fold)=2-ΔΔCt。
1.2.4 统计学分析实验数据以显示,采用SPSS 17.0软件进行统计学分析,两组均数比较采用t检验,P<0.05认为差异具有统计学意义。
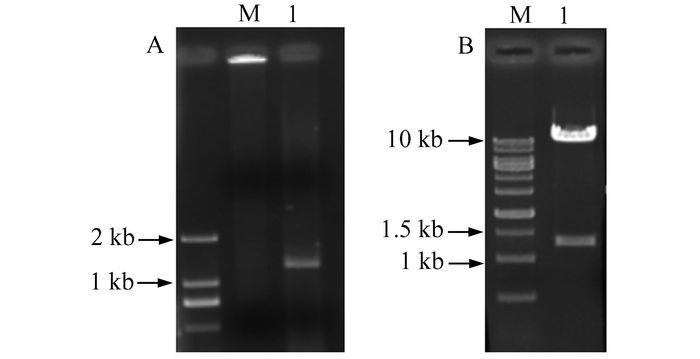
2 结果 2.1 pWPI-LAL重组慢病毒载体构建与鉴定以小鼠肝脏cDNA为模板,利用所设计的引物,PCR方法扩增出两端含有PacⅠ酶切位点的LAL cDNA,经琼脂糖凝胶电泳和凝胶成像仪显示可见,在大于1 kb处有一明亮条带,基本符合所预期的LAL基因条带位置(图 1A)。
|
图 1 pWPI-LAL重组慢病毒载体的构建和鉴定 A:琼脂糖凝胶电泳检测LAL目的基因PCR扩增产物;M:DNA marker;1:目的基因扩增片段;B:重组质粒PacⅠ酶切鉴定;M:DNA marker;1:重组质粒PacⅠ酶切产物 |
将纯化回收的LAL基因PCR扩增产物与pWPI空载体经酶切、连接、转化、平板筛选单菌落、液体培养后提取质粒DNA,经PacⅠ酶切反应验证目的DNA片段,并送检测序,酶切电泳结果(图 1B)和测序结果均证实成功构建pWPI-LAL重组载体。
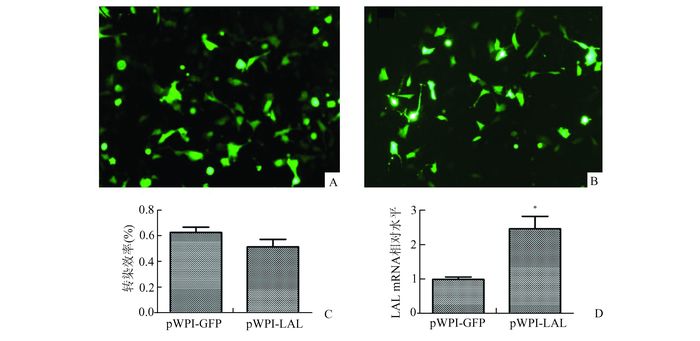
2.2 pWPI-LAL表达载体瞬时转染Hepa 1-6细胞采用Lipofectamine 2000试剂将pWPI-GFP空载体和pWPI-LAL重组载体分别转染Hepa 1-6细胞,换液后48 h于荧光显微镜下观察细胞GFP表达状态,并以荧光细胞数占白光下总细胞数的百分比,计算转染效率,可见pWPI-GFP空载体和pWPI-LAL重组载体的转染效率较稳定,细胞GFP荧光阳性率可达52%-63%(图 2C),并以QPCR检测两种转染细胞LAL的mRNA表达水平,pWPI-LAL转染组较空载体组LAL的mRNA水平高2-3倍(图 2D)。
|
图 2 慢病毒载体瞬时转染Hepa 1-6细胞 A:pWPI-GFP转染组;B:pWPI-LAL转染组;C:分组细胞转染效率比较;D:转染细胞中LAL的mRNA表达水平n=3,*P<0.05,与pWPI-GFP转染组比较 |
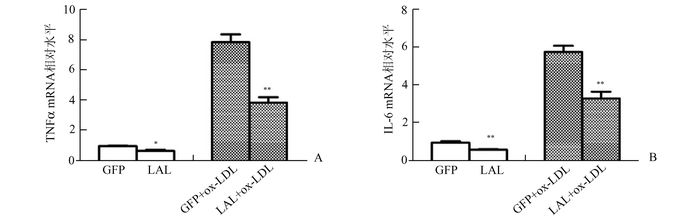
将转染后的Hepa l-6细胞收集提取总RNA,逆转录后进行炎症相关因子的qPCR检测,如图 3A和3B结果显示,ox-LDL孵育可显著上调细胞的炎症因子TNFα和IL-6的mRNA水平(P<0.01);而转染细胞无论在基础培养还是氧化刺激下,与对照GFP组相比,LAL高表达均可明显降低TNFα和IL-6的mRNA表达水平(P<0.05或P<0.01)。
|
图 3 转染慢病毒载体对Hepa 1-6细胞炎症因子mRNA水平的影响 n=3, *P<0.05,**P<0.01,与pWPI-GFP转染组比较 |
溶酶体是细胞降解回收大分子物质如蛋白质、脂质、失去功能的细胞器等的重要场所,并可协助杀灭清除外源物质,对于维持胞内物质平衡代谢稳定发挥重要作用[8]。近年研究者开始重视并提出,溶酶体在细胞摄取利用脂质和脂滴降解过程中有双效调节性。溶酶体功能依赖其内酸性环境,研究表明,细胞过量摄取氧化修饰脂质会引起溶酶体内环境改变,pH值升高,其内各种酶功能活性降低,溶酶体功能降低甚至丧失,胞内脂质压力以及炎症压力增加[9, 10]。我们前期工作发现:apoE基因敲除小鼠的脂蛋白残粒(富含VLDL、LDL)孵育巨噬细胞,可导致胞内脂质蓄积,其重要原因在于抑制了溶酶体LAL,选择性减低脂质降解[11],LAL是溶酶体内唯一的降解脂质的酶,与溶酶体清除脂质,维持溶酶体功能有密切联系,但其具体的细胞调节功能及作用机制目前并不清楚。
肝脏是机体糖、脂、氨基酸等重要物质代谢的中心器官,肝细胞功能失调也是代谢性疾病的重要体现。作为代谢活跃、溶酶体含量较丰富的肝细胞,如何执行脂质代谢平衡的调节机制尚不十分明了,使得关注肝细胞脂质转运、贮存及降解的有效作用节点显得尤为重要。因此,为明确溶酶体LAL对肝细胞脂质平衡及功能影响的地位,本研究选用慢病毒载体系统构建表达小鼠源性LAL,此慢病毒载体可携带目的基因重组到细胞基因组中而稳定表达外源目的蛋白,将有利于进一步在体研究LAL对代谢性疾病作用的长效动物实验。本实验中将构建的pWPI-LAL重组载体瞬时转染到小鼠Hepa l-6肝细胞,并成功检测到细胞高表达LAL,并能影响基础培养状态或ox-LDL刺激下的炎症水平。已有大量研究证实,ox-LDL作为公认的动脉粥样硬化危险因子,可引起胞内氧化压力增加、炎症反应和脂质失衡[12, 13]。本研究通过ox-LDL孵育肝细胞证实氧化应激下胞内炎症因子TNFα和IL-6水平明显升高,而无论基础或氧化应激下,LAL高表达均显著降低肝细胞炎症因子TNFα和IL-6的表达水平,尽管尚未有报道LAL分子本身具有抗氧化和抑炎效应,但基础代谢及氧化脂质荷载下溶酶体LAL介导其内CE和TG水解为FC和FFA以供细胞利用及外运,从而提高溶酶体处理脂质平衡的能力,避免脂质积聚引发的细胞炎症,进而降低代谢失衡的压力,保护肝脏。因此溶酶体LAL可能作为细胞内在可塑性脂质降解途径的关键靶点,提示我们后续需要进一步研究其具体调节机制。
本研究利用慢病毒载体系统构建小鼠源性LAL在细胞高表达方式,为今后深入研究溶酶体LAL介导的细胞脂质平衡调控机制及在体动物实验提供了重要手段,也为临床诊疗相关代谢性疾病提供一个可能方向。
| [1] | Dubland JA, Francis GA. Lysosomal acid lipase: at the crossroads of normal and atherogenic cholesterol metabolism[J]. Front Cell Dev Biol, 2015, 3: 3-14. |
| [2] | Vargas-Alarcon G, Posadas-Romero C, Villarreal-Molina T, et al. Single nucleotide polymorphisms within LIPA (Lysosomal Acid Lipase A) gene are associated with susceptibility to premature coronary artery disease. a replication in the genetic of atherosclerotic disease (GEA) Mexican study[J]. PLoS One, 2013, 8(9): e74703. DOI: 10.1371/journal.pone.0074703. |
| [3] | Yan C, Zhao T, Du H. Lysosomal acid lipase in cancer[J]. Oncoscience, 2015, 2(9): 727-728. |
| [4] | Reiner Z, Guardamagna O, Nair D, et al. Lysosomal acid lipase deficiency--an under-recognized cause of dyslipidaemia and liver dysfunction[J]. Atherosclerosis, 2014, 235(1): 21-30. DOI: 10.1016/j.atherosclerosis.2014.04.003. |
| [5] | Radovic B, Vujic N, Leopold C, et al. Lysosomal acid lipase regulates VLDL synthesis and insulin sensitivity in mice[J]. Diabetologia, 2016, 59(8): 1743-1752. DOI: 10.1007/s00125-016-3968-6. |
| [6] | Du H, Schiavi S, Wan N, et al. Reduction of atherosclerotic plaques by lysosomal acid lipase supplementation[J]. Arterioscler Thromb Vasc Biol, 2004, 24(1): 147-154. DOI: 10.1161/01.ATV.0000107030.22053.1e. |
| [7] | Balwani M, Breen C, Enns GM, et al. Clinical effect and safety profile of recombinant human lysosomal acid lipase in patients with cholesteryl ester storage disease[J]. Hepatology, 2013, 58(3): 950-957. DOI: 10.1002/hep.v58.3. |
| [8] | Xu H, Ren D. Lysosomal physiology[J]. Annu Rev Physiol, 2015, 77: 57-80. DOI: 10.1146/annurev-physiol-021014-071649. |
| [9] | Jerome WG, Cox BE, Griffin EE, et al. Lysosomal cholesterol accumulation inhibits subsequent hydrolysis of lipoprotein cholesteryl ester[J]. Microsc Microanal, 2008, 14(2): 138-149. DOI: 10.1017/S1431927608080069. |
| [10] | Satchell L, Leake DS. Oxidation of low-density lipoprotein by iron at lysosomal pH: implications for atherosclerosis[J]. Biochemistry, 2012, 51(18): 3767-3775. DOI: 10.1021/bi2017975. |
| [11] | Wu D, Sharan C, Yang H, et al. Apolipoprotein E-deficient lipoproteins induce foam cell formation by downregulation of lysosomal hydrolases in macrophages[J]. J Lipid Res, 2007, 48(12): 2571-2578. DOI: 10.1194/jlr.M700217-JLR200. |
| [12] | Trpkovic A, Resanovic I, Stanimirovic J, et al. Oxidized low-density lipoprotein as a biomarker of cardiovascular diseases[J]. Crit Rev Clin Lab Sci, 2015, 52(2): 70-85. DOI: 10.3109/10408363.2014.992063. |
| [13] | Tietge UJ. Hyperlipidemia and cardiovascular disease: inflammation, dyslipidemia, and atherosclerosis[J]. Curr Opin Lipidol, 2014, 25: 94-95. DOI: 10.1097/MOL.0000000000000051. |
 2017, Vol. 38
2017, Vol. 38

