富含半胱氨酸分泌蛋白-1(cysteine-rich secretory protein-1, CRISP 1)是一种由附睾头部上皮细胞合成分泌的雄激素依赖型糖蛋白[1]。前期的实验中我们成功地构建了重组小鼠CRISP 1(r-mCRISP 1)蛋白疫苗和pcDNA3.1-mCRISP 1 DNA疫苗[2, 3],动物实验结果已经证实表达mCRISP 1的重组蛋白疫苗和DNA疫苗接种于BALB/c雌、雄性小鼠后,均可诱导一定的抗生育反应[4.5]。这种抗生育效果在很大程度上归因于特异性CRISP 1抗体的产生,并且该抗体随着时间延长在被接种小鼠的血清中的浓度不断增加。研究还显示rmCRISP 1疫苗和pcDNA3.1-mCRISP 1 DNA疫苗免疫后所产生的抗体均能与精子天然CRISP 1蛋白相结合,具有高度的特异性[4],但是,mCRISP 1抗体的产生与小鼠不育症之间是否具有直接的因果关系以及mCRISP 1特异性抗体究竟通过哪一环节、何种机制影响小鼠生育功能尚不清楚。本课题在前期研究的基础上,通过体外试验进一步阐明mCRISP 1避孕疫苗的抗生育作用机制,为开发出经济、安全、有效的男性避孕疫苗奠定基础。
1 材料与方法 1.1 材料 1.1.1 质粒重组质粒pcDNA3.1-mCRISP 1和重组蛋白(r-mCRISP 1)由本实验室前期构建[2, 3]。pcDNA3.1质粒购自Novagen公司。
1.1.2 主要试剂戊巴比妥钠、弗氏佐剂和Ca2+诱导剂A23187购自美国Sigma公司, 透明质酸钠、HEPES、体外受精相关试剂(受精液、卵裂液)购自美国SAGE IVF有限公司,胰酶购自杭州四季青生物科技有限公司。
1.1.3 实验动物BALB/c小鼠,6-8周龄,SPF级,购自湖北省疾病预防控制中心。
1.2 方法 1.2.1 动物免疫方案及抗血清制备用戊巴比妥钠将实验小鼠全身麻醉后,暴露股四头肌,用注射器混合法将弗氏佐剂和重组mCRISP 1蛋白混匀至乳状,将鉴定合格后的重组mCRISP 1蛋白-弗氏佐剂乳化剂在小鼠股四头肌上行多点注射免疫。初次免疫及加强免疫共3次(0周、2周和4周),每次接种DNA量为50 μg,初次免疫时采用完全弗氏佐剂,加强免疫时使用不完全弗氏佐剂。根据前期研究结果[4],取初次免疫后8周免疫血清进行后续实验,使用前进行梯度稀释(1:10,1:50,1:100,1:200),对照组使用未经免疫的BALB/c小鼠血清。
1.2.2 小鼠精液采集将生育功能正常的健康雄性BALB/c小鼠颈椎脱臼法处死,取一侧0.5 ml附睾尾至预先预热的3%BSA-HEPES中,剪碎,在37 ℃,5%CO2培养箱中孵育10 min,使精子上游,挑去附睾组织。1 500 r/min离心10 min,3%BSA-HEPES重悬沉淀,1 500 r/min离心5 min,洗涤2次。调节精子密度至4×106个/ml,备用。
1.2.3 mCRISP 1抗体对精子存活率及活力的影响将抗血清或未免疫血清与等量精液混合,37 ℃,5%CO2培养箱中孵育1.5 h; 取5 μl精子混悬液滴入Mackler板中,计算机辅助的精子分析系统(CASA)计数精子的活动力,取10 μl精子混悬液涂片镜检,观察精子的凝集情况; 伊红染色检测精子的存活率。每个试验重复3次。
1.2.4 mCRISP 1抗体对精子顶体反应的影响上游法收集精子,于37 ℃,5%CO2培养箱中孵育1.5 h获能。将获能后的精子以4×106个/ml的密度与抗血清或未免疫血清等量混合共培养30 min,加入5 μmol/L Ca2+诱导剂A23187继续孵育1 h诱导精子的顶体反应。FITC-PSA (豌豆凝集素)检测精子的顶体反应发生情况。若精子顶体可见到明亮的发光,认为发生了顶体反应,若在精子赤道部发光或未见到任何发光则认为未发生顶体反应。
1.2.5 mCRISP 1抗体对精卵黏附和精卵融合的影响 1.2.5.1 精子准备上游法收集精子,37 ℃,5%CO2培养箱中孵育1.5 h获能,加入Ca2+诱导剂A23187诱导顶体反应。调整精子密度,以4×106个/ml的密度与抗血清或未免疫血清等量混合共培养30 min。
1.2.5.2 卵子准备取6-8周龄雌性BALB/c小鼠,经腹腔注射10 IU PMSG,48 h后再腹腔注射10 IU HCG,16-18 h后颈椎脱臼处死,从输卵管壶腹部收集卵丘,用含0.1%透明质酸钠去除颗粒细胞,3%BSA-HEPES清洗5次,再用0.1%的胰酶去除卵母细胞透明带,HEPES清洗5次。分组备用。
1.2.5.3 体外受精将处理过的精子加入含有去透明带卵子的液滴中,用液体石蜡油覆盖,37 ℃,5%CO2孵育。
1.2.5.4 精卵黏附试验37 ℃,5%CO2孵育30 min后,析出卵细胞,HEPES清洗3次去除松散地附着于卵细胞的精子,移至载玻片上,压片,相差显微镜下观察。记录每个卵子周围附着的精子数。每个试验重复3次。
1.2.5.5 精卵融合试验37 ℃,5%CO2孵育3 h后,析出卵细胞,HEPES清洗3次后,移至载玻片上,压片,相差显微镜下观察。以卵细胞胞质内可见膨大的精子头部和尾存在或雌性原核形成作为体外受精成功的指标。每个试验重复3次。
1.2.6 统计学分析采用SPSS 13.0统计学软件对结果进行统计分析。检测结果用均数±标准差(x±s)表示,计量资料用one-way-ANOVA进行组间差异性比较,计数资料采用χ2检验。P<0.05为差异有统计学意义。
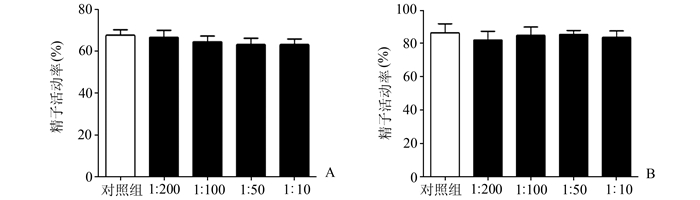
2 结果 2.1 mCRISP 1抗体对精子活力及存活率的影响我们将不同浓度的mCRISP 1抗体与正常精子悬液共同孵育后检测精子活动力和存活率的变化,结果显示各组间精子活动力和存活率均无显著差异(P>0.05),提示mCRISP 1抗体并不会对精子的活动力和存活率产生影响。见图 1。
|
图 1 mCRISP 1抗体对精子活力及存活率的影响 A:mCRISP 1抗体对小鼠附睾精子活力的影响; B:mCRISP 1抗体清对小鼠附睾精子存活率的影响各组间小鼠精活动率和存活率均无显著差异(P>0.05) |
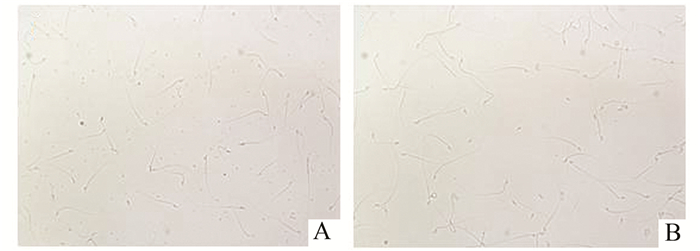
与未免疫血清相似,mCRISP 1抗血清(1:10稀释)与正常雄性小鼠精子共孵育后,精子并未发生凝集现象。见图 2。
|
图 2 小鼠精子凝集实验 A:未免疫血清与小鼠精子反应; B:mCRISP 1抗血清(1:10稀释)与小鼠精子反应。两组精子均未见明显凝集现象(×200) |
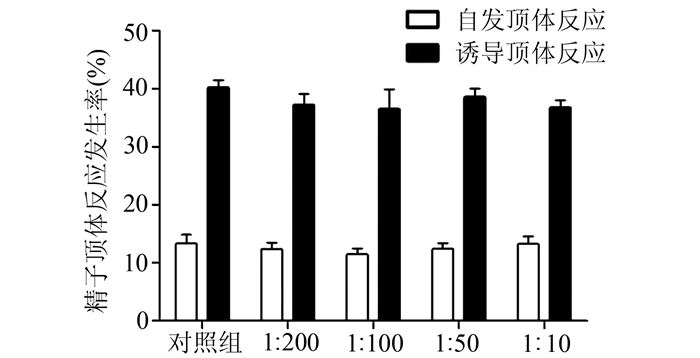
将获能的精子与不同浓度mCRISP 1抗血清共同孵育后,观察精子自发顶体反应及Ca2+ A23187诱导的顶体反应发生率。结果显示,各组间不管是自发还是诱发顶体反应发生率均无显著差异(P>0.05)。见图 3。
|
图 3 mCRISP 1抗体对精子自发和诱发顶体反应的影响 各组间自发或诱发顶体反应发生率均无显著差异(P>0.05) |
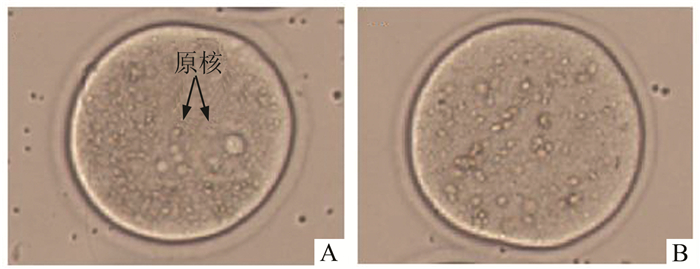
我们采用精卵穿透试验检测了mCRISP 1抗体对精卵黏附作用和精卵融合的影响,图 4分别显示精卵融合试验中受精卵(图 4A)与未受精卵(图 4B),受精的卵细胞胞质内可见原核形成。如表 1所示,各组间每卵黏附精子数无显著差异(P>0.05),但是当抗血清浓度≥1:100时,受精率显著下降(P<0.05),且呈抗体浓度依赖性。
|
图 4 精卵融合试验 A:受精卵; B:未受精卵→所示为原核(×400) |
| 表 1 mCRISP 1抗体对精卵黏附和精卵融合的影响 |
CRISP 1为CRISP家族成员之一,于1976年首次由Cameo和Blaquier在大鼠精子上发现[1],是依赖雄激素刺激而产生的一种分泌性糖蛋白,由附睾头部的上皮合成分泌,最初结合于精子的顶体区,伴随顶体反应之后迁移到精子头部赤道板部位[6]。有研究显示:CRISP 1通过与卵子表面的互补位点相作用,参与精卵融合的一系列过程,其结合卵母细胞的活性区域主要位于CRISP家族12个氨基酸区域相对应的进化保守序列--蛋白N末端的45个氨基酸(114-158)残基内[7, 8]。此外,CRISP 1蛋白还能抑制精子蛋白酪氨酸磷酸酶的活性,使精子无法接受孕酮诱导的顶体反应,而外源性的环磷酸腺苷(cAMP)可以弥补CRISP 1的抑制作用,提示CRISP 1还可能通过控制精子质膜表面的某些离子通道影响精子获能[9]。最近,Maldera等研究进一步发现,人类附睾CRISP 1主要是通过与透明带3(ZP3)的相互作用介导精子-透明带结合,参与受精过程[10]。通过基因重组技术获得的重组CRISP 1蛋白和从精子中获取的纯化的天然CRISP 1蛋白在多个动物模型中均可以引起特异性免疫应答反应,进而影响生育功能[4, 11, 12],然而较为有趣的是有学者研究发现通过基因敲除技术敲除小鼠CRISP 1基因后,尽管体外受精实验显示CRISP 1(-/-)小鼠精子穿透完整透明带(ZP)或去透明带卵子的能力及与卵子的融合能力显著降低,但其生育功能并不受影响[13]。
在前期关于CRISP 1免疫避孕疫苗的研究成果中,CRISP 1抗体反应与生育抑制之间的关系已被证实,并且由免疫避孕抗原诱导的抗体反应强度与避孕效果呈相关性。然而,由于这些疫苗的抗生育作用通常都是不完全并且暂时的,抗体反应的具体作用机制尚不明确。本研究在前期研究成果的基础上,探讨mCRISP 1特异性抗体可能的抗生育作用机制。研究结果显示将获能的精子与mCRISP 1抗体共同孵育后,当mCRISP 1抗血清浓度抗血清浓度≥1:100时,可显著降低精子与卵子受精的能力,且呈现显著的剂量依赖性。哺乳动物的受精过程由精子成熟、获能、精卵结合与融合等一系列事件组成,是个复杂而又有序的事件,本研究发现mCRISP 1抗体特异性作用于精卵融合阶段,而对正常小鼠附睾精子的活动率,存活率及自发或诱发顶体反应率及精子黏附卵子的能力均无影响,也不会引起精子的凝集反应。综上所述,本研究结果提示以mCRISP 1为基础的避孕疫苗所产生的mCRISP 1抗体主要通过抑制精卵融合过程发挥抗生育作用,然而,哺乳动物精卵融合的分子机制是个极为复杂且重要的生命科学基础问题,mCRISP 1抗体在精卵融合过程中的具体作用机制还有待进一步研究。
| [1] | Cameo MS, Blaquier JA. Androgen-controlled specific proteins in rat epididymis[J]. J Endocrinol, 1976, 69(1): 47-55. DOI: 10.1677/joe.0.0690047. |
| [2] | 罗金, 杨菁, 徐望明, 等. 小鼠富含半胱氨酸分泌蛋白-1真核表达载体的构建及其在COS-7细胞中的表达[J]. 生殖与避孕, 2010, 30(8): 509-513. |
| [3] | 罗金, 杨菁, 徐望明, 等. 小鼠富含半胱氨酸分泌蛋白-1原核表达载体的构建与表达[J]. 中华实验外科杂志, 2011, 7(28): 1169-1171. |
| [4] | Luo J, Yang J, Cheng Y, et al. Immunogenicity study of plasmid DNA encoding mouse cysteine-rich secretory protein-1 (mCRISP 1) as a contraceptive vaccine[J]. Am J Reprod Immunol, 2012, 68(1): 47-55. DOI: 10.1111/aji.2012.68.issue-1. |
| [5] | 罗金, 杨菁, 程琰, 等. 小鼠富含半胱氨酸分泌蛋白-1DNA疫苗免疫避孕效果的评价[J]. 生殖与避孕, 2013, 3(33): 145-148. |
| [6] | Da Ros VG, Munuce MJ, Cohen DJ, et al. Bicarbonate is required for migration of sperm epididymal protein DE (CRISP 1) to the equatorial segment and expression of rat sperm fusion ability[J]. Biol Reprod, 2004, 70(5): 1325-1332. DOI: 10.1095/biolreprod.103.022822. |
| [7] | Ellerman DA, Cohen DJ, Da Ros VG, et al. Sperm p rotein "DE" mediates gamete fusion through an evolutionarily conserved site of the CR ISP family[J]. Dev Biol, 2006, 297(1): 228-237. DOI: 10.1016/j.ydbio.2006.05.013. |
| [8] | Cohen DJ, Busso D, Da Ros V, et al. Participation of cysteine-rich secretory proteins (CRISP) in mammalian sperm-egg interaction[J]. Int J Dev Biol, 2008, 52(5-6): 737-742. DOI: 10.1387/ijdb.072538dc. |
| [9] | Roberts KP, Wamstad JA, Ensrud KM, et al. Inhibition of capacitation-associated tyrosine phosphorylation signaling in rat sperm by epididymal protein CRISP 1[J]. Biol Reprod, 2003, 69(2): 572-581. DOI: 10.1095/biolreprod.102.013771. |
| [10] | Maldera JA, Weigel Muñoz M, et al. Human fertilization: epididymal hCRISP 1 mediates sperm-zona pellucid binding through its interaction with ZP3[J]. Mol Mol Hum Reprod, 2014, 20(4): 341-349. DOI: 10.1093/molehr/gat092. |
| [11] | Cohen DJ, Ellerman DA, Cuasnicú PS. Mammalian sperm-egg fusion: Evidence that epididy al protein DE plays a role in mouse gamete Fusion[J]. Biol Reprod, 2000, 63(2): 462-468. DOI: 10.1095/biolreprod63.2.462. |
| [12] | Ellerman DA, Busso D, Maldera JA, et al. Immunocontraceptive properties of recombinant sperm protein DE: implications for the development of novel contraceptives[J]. Fertil Steril, 2008, 89(1): 199-205. DOI: 10.1016/j.fertnstert.2007.02.025. |
| [13] | Da Ros VG, Maldera JA, Willis WD, et al. Impaired sperm fertilizing ability in mice lacking Cysteine-Rich Secretory Protein 1 (CRISP 1)[J]. Dev Biol, 2008, 320(1): 12-18. DOI: 10.1016/j.ydbio.2008.03.015. |
 2016, Vol. 37
2016, Vol. 37

 ,
,