目前主动脉疾病腔内修复技术的应用越来越广泛,但主动脉弓却因其解剖特殊性一直是腔内技术的盲点。传统深低温停循环手术治疗弓部疾病时间长创伤大。复合手术通过外科手术重建弓部分支血管,再联合腔内技术治疗主动脉疾病,创伤小恢复快[1]。2010年1月至2015年1月,我科对96例累及弓部的主动脉疾病同期实施了分站式复合手术,疗效满意,报道如下。
1 资料与方法 1.1 一般资料96例中男72例,女24例。年龄34-68岁,平均(53.0±5.1) 岁。术前均行主动脉CT血管成像(CTA)、心脏、颈部血管彩超及经颅多普勒。其中确诊Stanford B型复杂型主动脉夹层71例,弓部动脉瘤10例,穿透性溃疡15例。合并升主动脉扩张20例,高血压73例,慢性阻塞性肺病12例,冠心病9例,糖尿病15例,陈旧性脑梗5例,左侧大量胸腔积液8例。
1.2 手术方法入院后予以镇痛镇静、控制血压心率等处理并积极完善术前准备,尽早手术治疗。所有患者均在全麻下行同期分站式复合手术,即先在常规手术室完成主动脉弓分支旁路术,随后转运至介入手术室经股动脉行主动脉腔内修复术。
按照Ishimaru[2]提出的锚定区分区方法,自右向左分为Z0区(支架锚定区覆盖头臂干),Z1区(支架锚定区覆盖左颈总动脉),Z2区(支架锚定区覆盖左锁骨下动脉),Z3区(支架锚定区在左锁骨下动脉远端),不同锚定区弓部分支重建方法不同。Z0区:采用胸部正中切口,游离显露主动脉弓及三大分支并分别套带,Y形人工血管先与升主动脉端侧吻合,在头臂干及左颈总动脉远端分别插灌注针头后相互连通,在分别离断头臂干及左颈总动脉近端后通过此连通可保证头臂干及左颈总动脉远端血供不中断,人工血管分叉分别与其端端吻合;再通过8 mm带环聚四氟乙烯人工血管行左颈总动脉-左锁骨下动脉血管旁路架桥术,最后结扎三大分支根部并prolene线加固缝合残端,在头臂干开口近端做钛夹标记。Z1区:若头臂干较细小,则按Z0区方法正中进胸重建左颈总、左锁骨下动脉;若头臂干粗大,则采取颈部横切口,经胸骨上窝沿皮纹作弧形切口,向两侧牵开胸锁乳突肌,离断部分颈浅肌群,显露头臂干远心段、右颈总、左颈总、左锁骨下动脉并套带。通过8 mm血管行右颈总动脉-左颈总动脉-左锁骨下动脉血管旁路架桥术,架桥阻断颈部动脉血管后剪取约3 cm长无菌Foley氏导尿管做成自制颈动脉分流栓塞入颈动脉腔内,首尾两端丝线打结扎紧。左颈总左锁骨下动脉根部处理同上,钛夹标识于左颈总动脉开口近端。Z2区:经颈部横切口,游离吻合方法同上,显露左颈总、左锁骨下动脉,通过8 mm血管行左颈总动脉-左锁骨下动脉血管旁路架桥术,保证左椎动脉血运,左锁骨下动脉根部处理同上,钛夹标识于左锁骨下动脉开口近端。
腔内隔绝术在介入手术室完成,经左或右侧股动脉及右侧桡动脉建立两条动脉通道,行多体位造影确定夹层破口位置,测量锚定区近心端直径,选择相应直径超过锚定区10%-15%的胸主动脉覆膜支架,控制性降压后缓慢释放,造影确定真腔膨胀,假腔闭合良好,支架无移位及内瘘,必要时可行脑血管造影了解脑部血流。
术后服用拜阿司匹林(100 mg/d)3个月至半年,3、6、9个月以及每年随访,主动脉CTA扫描范围自主动脉弓上分支至股动脉,观察支架形态、有无内漏、假腔血栓机化情况和血管移植物通畅性,同时了解有无脑部和上肢缺血等并发症。
2 结果围手术期死亡1例,为反复呛咳误吸导致窒息死亡,考虑和喉返神经损伤有关。开胸重建主动脉弓分支手术时间平均3 h,颈部切口手术时间平均2 h,血管腔内修复时间平均1 h。Z0区分支重建18例,Z1区34例,Z2区44例(见图 1、2)。所有支架均成功释放且定位准确,术后即时造影示夹层近端破口封闭良好,重建血管移植物通畅率100%,近端Ⅰ型内漏3例。一过性脑功能紊乱6例,无脑血管事件、截瘫及严重上肢运动感觉功能障碍。术后呼吸机辅助(6.1±2.3) h,ICU滞留(1.4±0.6) d。
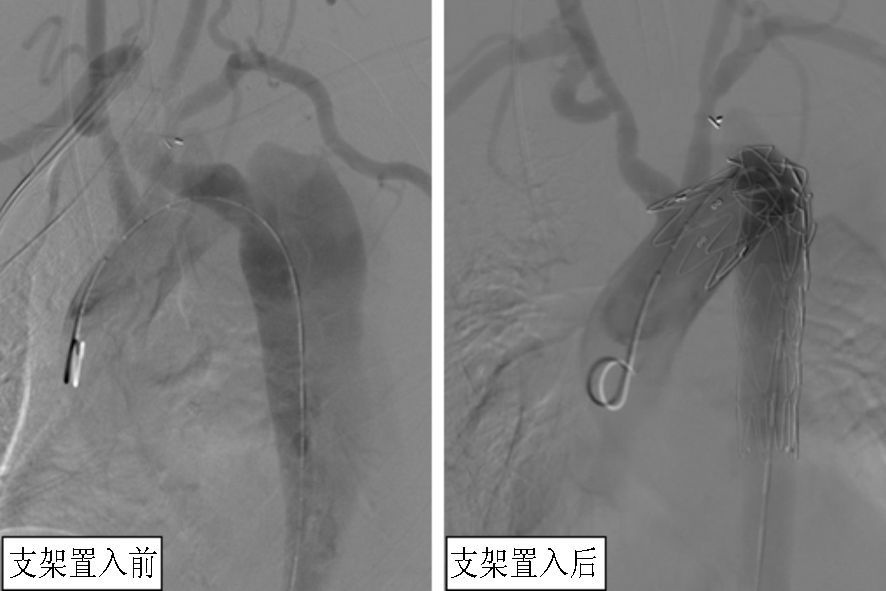
|
图 1 左颈总-左锁骨下动脉架桥手术造影图 |
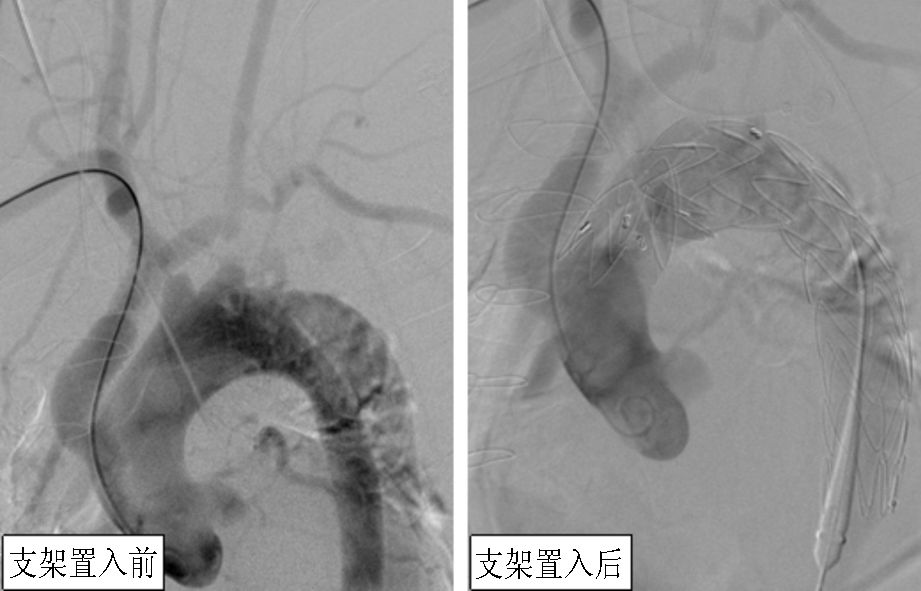
|
图 2 升主动脉-三大分支架桥手术造影图 |
90例获随访6-48个月。2例Z1区患者术后复查主动脉CTA时发现升主动脉夹层,术前有升主动脉扩张,予以开胸行Wheat手术后治愈。复查主动脉CTA示人工血管均通畅,无内漏及支架移位,3例支架近端Ⅰ型内漏患者随访6、9个月后内漏消失,85例降主动脉假腔完全消失或血栓机化。随访病例死亡1例,原因不详,无脑梗塞、头晕及左上肢乏力等表现。
3 讨论对于累及主动脉弓部的主动脉疾病传统手术需要在深低温停循环下进行,手术创伤大,死亡和并发症发生率高,特别是一些高龄患者常合并心肺肝肾等重要脏器疾病,难以耐受深低温停循环的打击[3]。而复合手术是将传统外科手术和现代腔内修复技术结合起来的新技术[4],腔内修复的关键是支架近端要有足够的锚定区,以防止发生内漏和支架移位,通过部分或完全重建弓部分支血管来创造延长近端锚定区,大大增加了腔内修复技术治疗主动脉疾病的范围。此方法不需要经过体外循环,手术时间短创伤小,对心肺肝肾等脏器影响较小。因为我院目前没有配备一站式复合手术间,对于累及弓部的A型夹层暂时无法行复合手术,但在有条件的医院已经将复合手术应用于A型夹层。
目前关于B型主动脉夹层的手术时机问题仍无明确定论。一般观点认为夹层急性期全身炎症反应严重,血管壁广泛渗出水肿,此时行腔内修复术覆膜支架容易损伤脆弱的主动脉, 诱发新夹层甚至导致主动脉破例,且B型夹层在严格控制血压心率后破裂率明显下降,故而一般推荐2周之后待炎症反应高峰消退后再行腔内修复术。但最近研究表明,急性期植入支架可以提高假腔完全血栓化的概率和重塑理想的主动脉形态。Akin等[5]研究亦表明急性期植入覆膜支架的患者无事件生存率较高。因而,国外研究均倾向于在夹层急性期行腔内修复手术。本组患者手术时机多在发病1周内,术后死亡与并发症发生率低,效果满意。
鉴于头臂干及左颈总动脉对于脑部血供的不可替代性,对于支架锚定区需覆盖头臂干及左颈总动脉的Z0区或Z1区患者必须要通过旁路手术来重建其血运。而因基底动脉环(Wills环)、颈部及肩胛区存在丰富的侧支循环,左锁骨下动脉是否需要重建一直存在着广泛的争议。早期腔内修复手术时并未推荐左锁骨下动脉重建。近年来随着此类手术的大量开展,逐渐发现直接封闭左锁骨下动脉易导致脑卒中等并发症,而重建左锁骨下动脉能降低脑血管意外及后循环缺血的发生率[6, 7]。经过术前颈部动脉彩超、经颅多普勒及术中脑血管造影可以充分评估,一般在双侧颈动脉正常、椎动脉呈均势型或右优势型及Willis环完整的情况下直接封闭左锁骨下动脉是安全的。而对于右椎动脉或双侧颈总动脉任一血管存在发育不良狭窄等严重血流动力学障碍或是左椎动脉直接起源于主动脉弓时要积极重建左锁骨下动脉。
复合手术中主动脉弓分支重建的入路有正中开胸和颈部横切口两种,血管重建方式有升主动脉-颈部血管架桥、颈部血管之间架桥等多种方式。我们体会对左颈总动脉粗大而头臂干、右颈总动脉相对细小的患者选择正中开胸入路,尽管比颈部切口创伤大,但使左颈总动脉血运直接起源于升主动脉能提供更丰富的血流,减少脑部并发症[8]。弓部分支血管阻断后的热缺血是出现脑部并发症的重要原因,在手术中通过灌注针管连通头臂干及左颈总动脉,保证阻断吻合时这两个血管通过连通针管一直有血流灌注,避免了热缺血;同时使用自制分流栓也减少了缺血时间,本组手术中无严重脑部并发症。在血管重建时尽量使用人工血管行旁路架桥手术,尽量避免自体血管之间的吻合,尤其被夹层累及的动脉血管不适合进行移植,因为夹层血管水肿脆弱,又经过牵拉后吻合口张力大,一旦出现吻合口瘘易导致大出血死亡。
腔内修复治疗时最理想的血管锚定区应在20 mm以上,至少大于15 mm,锚定的主动脉应没有成角和粥样硬化斑块,内径大致正常。本组2例Z1区经颈部切口行复合手术患者术后复查CTA时发现A型夹层,此两例患者术前有升主动脉扩张,开胸行Wheat术时发现新发破口位于裸支架头端,考虑为裸支架头刺破血管内膜导致新发夹层。对于复合手术患者的支架一般选择大于锚定区主动脉内径的5%-10%,而不需传统的10%-20%,因为复合手术后支架近端有足够的锚定区且主动脉弓及降部的弯度可以提供充分接触面和摩擦力来固定支架,不易导致支架移位和内漏。对于直筒型支架而言,远端内径与降主动脉内径相差太大,易导致新发夹层或假性动脉瘤,此类患者需在远端提前植入限制性覆膜支架或裸支架,而锥形支架一般不需如此处理。
总之,应用复合手术来治疗累及主动脉弓的主动脉疾病是安全有效微创的,死亡率及并发症发生率低。根据患者弓部病变情况及血管条件选择合理的复合方式是成功的关键。
| [1] | Jakob H, Tsagakis K. DeBakey type I dissection: when hybrid stent-grafting is indicated[J]. J Cardiovasc Surg, 2010, 51(5): 633-640. |
| [2] | Ishimaru S. Endografting of the aortic arch[J]. J Endovasc Ther, 2004, 11(Suppl II): 62-71. |
| [3] | Golledge J, Eagle KA. Acute aortic dissection[J]. Lancet, 2008, 372(9632): 55-66. DOI: 10.1016/S0140-6736(08)60994-0. |
| [4] |
胡盛寿. 正值"复合"(Hybrid) 技术的时代[J].
中华心血管病杂志, 2008, 36(1): 1-2.
Hu SS. Times for Hybrid technology[J]. Chin J Cardiol, 2008, 36(1): 1-2. |
| [5] | Akin I, Kische S, Ince H, et al. Indication timing and results of endovascular treatment of type B dissection[J]. Eur J Vasc Endovasc Surg, 2009, 37(3): 289-296. DOI: 10.1016/j.ejvs.2008.12.004. |
| [6] | Antoniou GA, EI Sakka K, Hamady M, et al. Hybrid treatment of complex aortic arch disease with supra-aortic debranching and endovascular stent graft repair[J]. Eur J Vasc Endovasc Surg, 2010, 39(6): 683-690. DOI: 10.1016/j.ejvs.2010.02.002. |
| [7] | Holt PJ, Johnson C, Hinchliffe RJ, et al. Outcomes of the endovascular management of aortic arch aneurysm: implications for management of the left subclavian artery[J]. J Vasc Surg, 2010, 51(6): 1329-1339. DOI: 10.1016/j.jvs.2009.10.131. |
| [8] |
任伟, 王志维, 夏军, 等. 累及弓部主动脉疾病的分站式杂交手术治疗[J].
中华外科杂志, 2014, 52(1): 72-73.
Ren W, Wang ZW, Xia J, et al. Sub-station hybrid surgery treat aortic disease involving the arch[J]. Chin J Surg, 2014, 52(1): 72-73. |
 2017, Vol. 38
2017, Vol. 38

 ,
,