宫颈癌是妇科最为常见的恶性肿瘤之一,严重威胁着广大女性的生命健康[1]。目前针对宫颈癌治疗的主要手段包括手术及放化疗等,然而这些治疗手段对于提高患者的生存率以及改善患者预后的作用十分有限。因此,通过对宫颈癌的发病机制的探索并因此寻找有效的治疗靶点已经成为了宫颈癌研究的热点。
甲状旁腺激素样激素(parathyroid hormone-like hormone, PTHLH)是从高钙血症相关的恶性肿瘤组织中分离出来的一种蛋白质分子。据报道,PTHLH主要高表达于乳腺癌、支气管癌、卵巢癌和肾细胞癌[2]。虽然PTHLH在其它肿瘤中有所报道,但目前仍然缺乏PTHLH对宫颈上皮细胞生物行为学影响的研究。因此,本研究拟通过比较PTHLH在宫颈癌组织与正常宫颈组织中的表达,以及分析其对宫颈癌细胞生物行为学特性的影响,为PTHLH作为宫颈癌治疗的生物靶标提供理论依据。
1 材料与方法 1.1 实验材料宫颈癌细胞株HeLa购买于中国典型培养物保藏中心(湖北,武汉),DEME培养液、胰酶以及胎牛血清均购买于美国密苏里州的Gibco公司。Trizol以及实时定量PCR试剂盒购买于辽宁大连宝生物工程有限公司。CCK-8增殖检测试剂盒购买于江苏海门碧云天有限公司。上海吉玛制药有限公司合成PTHLH siRNA和阴性对照siRNA干扰序列。PTHLH抗体(ab224503)、FITC偶联的抗兔荧光染料标记的二抗(ab6717)购买于上海Abcam贸易有限公司。iView DAB染色试剂盒则购买于美国加利福利亚州的Ventana Medical Systems公司。
1.2 HE染色与免疫组化将宫颈组织依次在多聚甲醛中进行固定,在不同浓度的乙醇中进行脱水,然后包埋在石蜡中,最后切成厚度为5 μm的薄片。在经过对薄片的脱蜡和再水化后,直接用苏木精和伊红对薄片进行染色。再将石蜡包埋的宫颈癌组织制作成为5 μm薄片后,再在100 ℃条件下在柠檬酸盐缓冲液(pH 6.0)中放置5 min以除去石蜡和修复抗原后,将切片与兔来源的抗PTHLH抗体(1:100)在4 ℃孵育并过夜。使用iView DAB染色试剂盒,在自动载玻片染色仪(Ventana Medical Systems,Tucson,AZ,USA)中进行检测,并将切片用苏木精进行复染色。HE染色和免疫组织化学染色的玻片均放置使用Nikon Eclipse Ci(Nikon,Japan)在200倍镜下拍摄图像。
1.3 细胞培养、转染及分组HeLa细胞接种于含有10%胎牛血清的DEME培养液中,将细胞以1×106个/孔的密度接种于6孔培养板,当细胞生长至90%融合度左右时,使用Lipofectamine 3000将PTHLH siRNA和阴性对照siRNA(见表 1)在终浓度为10 nm的条件下转染至HeLa细胞(具体操作严格按照厂家说明书进行)。转染之后的细胞分为2组:阴性对照组和PTHLH siRNA组。
| 表 1 PTHLH siRNAs和阴性对照siRNAs |
已转染后的HeLa细胞(PTHLH-siRNA组和阴性对照组)以1×104个/孔的密度接种在96孔板中,分为0、12、24、48、72 h组。3 d后,将10 μl CCK-8溶液分别加入96孔板中,37 ℃孵育2 h。在450 nm条件下使用微板读数器(Bio Rad,Martinez,CA,USA)测量吸光度。以空白对照组调零,实验重复3次。以时间为横轴,吸光度值为纵轴绘制细胞生长曲线。
1.5 Transwell试验在8 μm孔的transwell插入物(Millipore,Bedford,MA,USA)中进行Transwell细胞侵袭及转移测定。将transwell的上腔预先用稀释的基质胶(BD Biosciences,Sparks,MD)包被。然后将已经转染的HeLa细胞(PTHLH-siRNA组和阴性对照组)以1×105个/孔的密度分别接种在无血清培养基的6孔板上室中,并将含有10%血清的培养基作为化学引诱物加入到下腔室中。而没有使用基质胶包被的transwell插入物则用于体外细胞迁移能力的测定。培养24 h后,用4%多聚甲醛固定移植到下表面的细胞并使用结晶紫染色。用Nikon Eclipse Ci(Nikon,Japan)在200倍镜下拍摄图像,每孔6个随机场计数细胞数。
1.6 RNA分离和RT-qPCR使用Trizol试剂从HeLa细胞中分离总RNA,使用SYBR-Green法(Takara,大连,中国),通过RT-qPCR测量细胞中PTHLH的表达水平,并用GAPDH标准化。引物如下:PTHLH前引物:5′-ACATTCCTCCGCTCGGTTTT-3',后引物:5′-ACGGGGTGGTTCTTTGTGTT-3′; GAPDH前引物:5′-GCTCAGACACCATGGGGAAG-3′,后引物:5′-AGCATCGCCCCACTTGATTT-3′。PCR循环条件如下:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸15 s,进行40个循环,基因的退火条件60 ℃,30 s。结果采用2-ΔΔCt进行分析。
1.7 免疫荧光测定将已转染的HeLa细胞(PTHLH-siRNA组和阴性对照组)以1×104个/孔的密度接种在35 mm培养皿中的盖玻片上,然后用4%多聚甲醛固定细胞。之后与兔抗-PTHLH抗体(1:100)4 ℃孵育过夜,然后与FITC偶联的抗兔荧光染料标记的二抗(1:500)在37 ℃下共孵育1 h。进一步滴加DAPI避光孵育5 min,对标本进行染核。PBS缓冲液冲洗后,用抗荧光淬灭剂的封片液封片,在荧光显微镜下观察采集图像。用Nikon Eclipse Ci(Nikon,Japan)在200倍镜下拍摄图像。
1.8 数据分析统计学处理SPSS 22.0软件进行数据统计与分析,计量资料用x±s表示,各组样本均数比较采用student’s t检验或单因素方差分析。P < 0.05被认为差异有统计学意义。
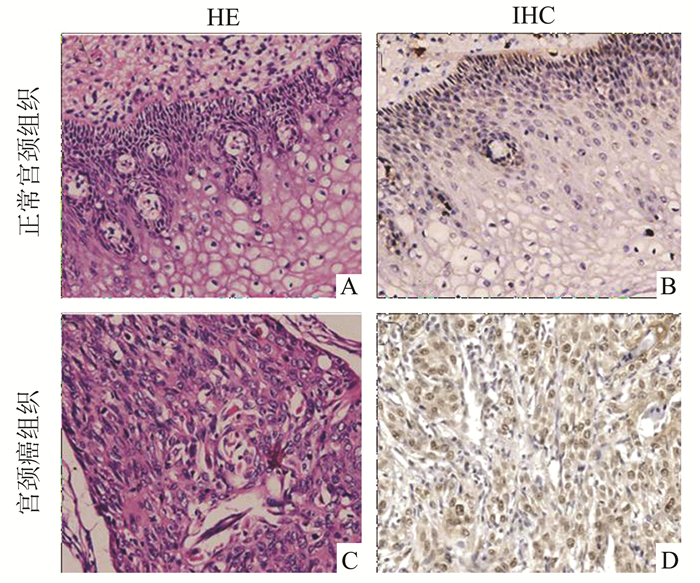
2 结果 2.1 正常宫颈与宫颈癌组织的HE染色及PTHLH免疫组织化学HE染色显示正常宫颈组织结构清晰,鳞状上皮与柱状上皮分层明显,上皮内可见腺体;而宫颈癌组织结构紊乱,未见鳞状上皮及柱状上皮,显示异型性细胞显著,核分裂象增多,未见腺体(图 1A, 1C)。正常宫颈组织与宫颈癌组织的PTHLH免疫组织化学结果显示,正常宫颈组织中仅见PTHLH蛋白的少量表达,而宫颈癌组织中可见PTHLH蛋白在癌细胞中的大量分布(图 1B, 1D)。
|
图 1 正常宫颈组织与宫颈癌组织的HE染色及PTHLH的IHC染色(×200) A:正常宫颈组织的HE染色;B:宫颈癌组织的HE染色;C:正常宫颈组织PTHLH的IHC;D:宫颈癌组织PTHLH的IHC |
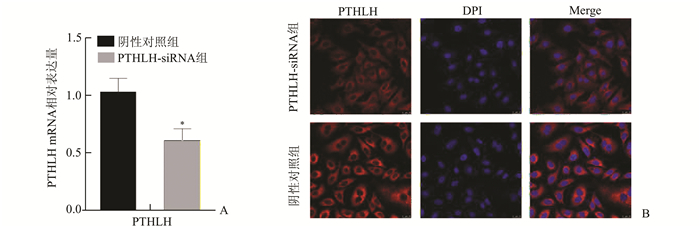
通过Lipofectamine 3000将PTHLH的siRNA干扰序列及阴性对照的siRNA序列分别转染至HeLa细胞中,然后运用RT-qPCR分别检测两组细胞中PTHLH的mRNA表达水平,并运用免疫荧光技术检测两组细胞中的PTHLH蛋白的定位及表达情况。结果显示,PTHLH的mRNA表达水平在PTHLH-siRNA组相较于阴性对照组显著降低(P<0.05;图 2A);荧光染色后PTHLH的蛋白表达于HeLa细胞的胞质内,且其表达在PTHLH-siRNA组相较于阴性对照组显著降低(P<0.05;图 2B)。
|
图 2 siRNAs干扰后HeLa细胞中PTHLH的mRNA及免疫荧光染色下蛋白表达 A:转染siRNAs后HeLa细胞中PTHLH的mRNA表达,与阴性对照组相比,*P<0.05;B:转染siRNAs后HeLa细胞中PTHLH的蛋白表达定位及水平(×200) |
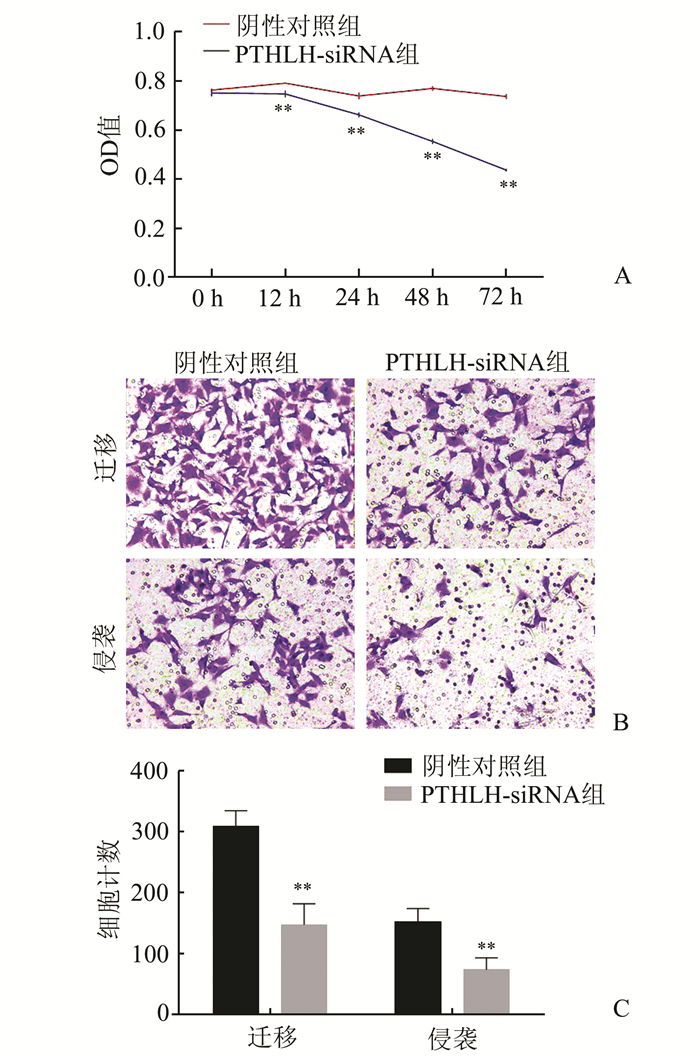
将PTHLH siRNA的干扰序列及阴性对照siRNA序列分别转染至HeLa细胞中后,运用CCK-8法检测PTHLH对HeLa细胞增殖的影响,运用transwell分析法检测PTHLH对HeLa细胞迁移与侵袭的影响。结果显示,随着培养时间的增加,PTHLH-siRNA组HeLa细胞的增殖相较于阴性对照组显著减慢(P<0.05;图 3A);PTHLH-siRNA组HeLa细胞在transwell小室中迁移以及侵袭的细胞数量相较于阴性对照组明显减少(P<0.05;图 3B)。
|
图 3 PTHLH对HeLa细胞增殖、迁移与侵袭的影响 A:转染siRNAs后两组HeLa细胞增殖情况曲线图;B、C:转染siRNAs后两组HeLa细胞迁移与侵袭情况比较;与阴性对照组相比,**P<0.01 |
通过对临床上宫颈癌患者的相关临床特征进行分析发现,25%左右的早期宫颈癌患者,其宫旁组织的浸润率高达35%[3],同时,根治性手术患者术后盆腔后腹膜和直肠的转移率则大于15%[4, 5]。目前,虽然针对宫颈癌术后进行的联合放、化疗已得到越来越广泛的应用,但它们针对术后复发以及转移的控制效果却并不理想。本研究通过检测PTHLH在宫颈癌组织中的高表达及其对宫颈癌细胞的促增殖、迁移及侵袭研究发现,PTHLH在宫颈癌发生发展及转移中起着重要的作用。
正常情况下PTHLH在血液中的表达非常低,几乎不可能检测到,但本研究中宫颈癌组织呈现高表达。越来越多的研究表明上皮细胞-间质细胞转换(epithelial-mesenchymal transitions,EMT)在调控正常人体组织和肿瘤组织的细胞可塑性方面也起着关键作用。EMT可影响分化上皮细胞的特性,降低细胞间的黏附性、细胞极性,增加细胞的运动能力等等,从而获得间质细胞的特征,如细胞迁移能力、侵袭能力等。本研究发现,利用siRNA沉默PTHLH基因后,相较于对照组,低表达或者不表达PTHLH基因的HeLa细胞的迁移和侵袭能力均明显降低,说明PTHLH是影响宫颈癌细胞株侵袭和转移能力的关键基因。有研究发现,PTHLH信号传导对于乳腺间质细胞转化至关重要,其中乳腺间质的分化可以反过来维持乳腺上皮的形成。这一过程由PTHLH通过Wnt和BMP信号通路所介导[6]。PTHLH能够诱导ERK的磷酸化和细胞周期蛋白D1的表达,从而促进了细胞的增殖[7]。这与本研究中PTHLH对于HeLa细胞的促增殖作用结果一致。
一般而言,穿膜细胞数每下降50个,宫颈癌细胞侵袭和局部浸润即可明显改善[8]。本研究中PTHLH-siRNA组穿膜细胞数量相较于对照组下降大于100个,说明通过特异性地沉默PTHLH基因可以促进对于宫颈癌细胞侵袭和局部浸润的改善。综上,沉默PTHLH基因后宫颈癌细胞株HeLa的生物学特性明显改变,具体表现为HeLa细胞的增殖、侵袭和迁移能力受到明显抑制。
| [1] |
李雪, 孔为民, 韩超, 等. 首都医科大学附属北京妇产医院1992至2011年间宫颈癌发病趋势分析[J].
中华妇幼临床医学杂志, 2013, 9(3): 310-314.
Li X, Kong WM, Han C, et al. Change trends of incident rate in cervical cancer of Beijing obstetrics and gynecology hospital, capital medical university from 1992 to 2011[J]. Chinese Journal of Obstetrics & Gynecology and Pediatrics, 2013, 9(3): 310-314. |
| [2] | Chang WM, Lin YF, Su CY, et al. Parathyroid hormone-like hormone is a poor prognosis marker of head and neck cancer and promotes cell growth via RUNX2 regulation[J]. Scientific Reports, 2017, 7: 41131. DOI: 10.1038/srep41131. |
| [3] |
朱丽红, 高燕, 朱瑾. 子宫颈癌细胞中HOXA10、NF-κB对MMP-9基因的调控作用[J].
中华妇产科杂志, 2015, 50(2): 144-145.
Zhu LH, Gao Y, Zhu J. Regulation of HOXA10、NF-Κb to MMP-9 in cervical cancer cells[J]. Chinese Journal Obstetrics and Gynecology, 2015, 50(2): 144-145. |
| [4] |
刘洪丽. TMPyP_4光动力疗法联合核仁素沉默对人宫颈癌SiHa细胞杀伤作用的研究[D]. 济南: 山东大学, 2014.
Liu HL. Study of killing effect of TMPyP4-PDT combined with nucleolin silence on human cervical cancer SiHa cells in vitro[D]. Jinan: Shandong University, 2014. |
| [5] |
江艳. MALAT1对宫颈癌细胞生物学表型的影响[D]. 长沙: 中南大学, 2014.
Jiang Y. The effect of MALAT1 in cervical cancer cell biology phenotype[D]. Changsha: Zhongnan University, 2014. |
| [6] | Hiremath M, Wysolmerski J. Parathyroid hormone-related protein specifies the mammary mesenchyme and regulates embryonic mammary development[J]. Journal of Mammary Gland Biology & Neoplasia, 2013, 18(2): 171-177. |
| [7] | Yang W, Wang J, Moore DC, et al. Ptpn11 deletion in a novel progenitor causes metachondromatosis by inducing hedgehog signalling[J]. Nature, 2013, 499(7 459): 491. |
| [8] | Zhang YH, Wang J, Li M, et al. Matrix metallopeptidase 14 plays an important role in regulating tumorigenic gene expression and invasion ability of Hela cells[J]. Int J Gynecol Cancer, 2016, 26(3): 600-606. |
 2018, Vol. 39
2018, Vol. 39

