肝细胞癌(hepatocellular carcinoma, HCC)是目前常见的癌症之一,其死亡率在全球范围内占癌症相关死亡人数的第3位[1, 2]。尽管引起肝细胞癌的原因有多种,但据El-Serag[1]报告, 全球约50%的肝细胞癌患者与乙肝病毒(hepatitis B virus, HBV)感染有关, HBV感染已成为亚洲大部分地区及非洲撒哈拉地区肝细胞癌发生的主要危险因素。中国是乙肝大国,据统计我国95%的肝细胞癌患者具有HBV感染背景[3]。虽然肝细胞癌的确诊因影像学及病理学检查得到了大大的提高, 但对于发展中国家来说其成本仍然较高。因此,甲胎蛋白(alpha fetoprotein,AFP)仍作为最重要的肿瘤标志物广泛应用于肝细胞癌的筛查、诊断和预后评估中。然而,AFP对肝细胞癌的诊断结果并不令人满意,其敏感性仅为39%-65%,特异度为76%-93%[4],且有15%-30%的晚期肝细胞癌患者甚至不出现AFP水平的升高[5],AFP在慢性肝炎、肝硬化等肝脏疾病中也表现出不同程度的升高。因此,寻找新的有效、可靠的标志物用于肝细胞癌的早期诊断成为了临床迫切所需。
近年来,大量研究证实了microRNA (miRNA或miR)在多种疾病中存在异常表达,尤其是癌症,其可能作为癌基因或抑癌基因参与肿瘤的发生发展。虽然同一miRNA, 例如miR-21在多种癌症疾病中均存在差异表达使其特异性存在争议,但miRNA作为新的潜在肿瘤诊断标志物仍引起了国内外研究者的广泛关注,尤其是循环miRNA,以其检测的无创性及在血浆/清中的稳定不易降解性[6]成为了科研工作者的研究焦点。目前,多种miRNA被报道在HCC中存在异常表达,这些研究为寻找新的HCC肿瘤标志物提供了线索。随着研究的深入,HBV参与调节miRNA表达的方式也得到了揭示[7]。进而,研究者提出了新的观点:一些循环miRNA的表达水平反映了慢性HBV肝损伤,而非特异性针对乙肝肝细胞癌(HBV-HCC)[8, 9]。本研究旨在通过实时荧光定量PCR的方法,检测血浆miR-205在HBV相关肝脏疾病中的表达差异,以探讨其在HBV-HCC与健康人群、慢性乙型肝炎(chronic hepatitis B, CHB)、乙肝肝硬化(HBV-related liver cirrhosis, HBV-LC)患者鉴别诊断中的潜在价值。
1 资料与方法 1.1 样本资料242例血浆样本全部来自武汉大学中南医院,收集于2014年7月至2015年4月。其中包括健康人群56例,CHB患者63例,HBV-LC患者59例,HBV-HCC患者64例。HBV相关肝脏疾病患者均为HBsAg或HBV-DNA阳性, 且排除由丙肝病毒(HCV)、酒精、自身免疫、代谢因素等引起的肝脏疾病。所有肝细胞癌患者均经病理证实,且血浆样本收集于患者接受手术切除或介入治疗前。健康人群样本为各检测指标均在正常参考范围内且体格及影像学检查等均无异常的健康体检者。本研究经武汉大学中南医院医学伦理委员会批准(2013059,2013.3)。样本基本信息见表 1。其中,主要检测指标包括:谷氨酸氨基转移酶(ALT),天冬氨酸氨基转移酶(AST),总胆红素(T-bil),白蛋白(Alb),甲胎蛋白(AFP)。
| 表 1 健康人群及HBV相关肝脏疾病患者临床参数 |
1 ml含EDTA外周血经两次离心(2 000 g, 5 min;15 000 g, 10 min。均在4 ℃进行)以彻底去除细胞及细胞碎片。使用MiRcute miRNA提取试剂盒(天根,北京)提取上述上清血浆中的miRNA,具体提取步骤根据试剂盒说明进行。
1.3 miRNA cDNA的合成血浆miR-205的逆转录采用茎环法特异性逆转录, 逆转录试剂盒采用Thermo Scientific RevertAid Fist Strand cDNA合成试剂盒(Thermo Scientific Inc., Waltham, MA, USA)。引物购自Invitrogen (上海)。逆转录体系为10 μl,包括总miRNA:2 μl,特异性逆转录引物(见表 2):1 μl,ddH2O:3 μl于65 ℃孵育5 min后向上述混合物中加入2 μl反转录缓冲液,0.5 μl反转录酶,0.5 μl RNase抑制剂,1 μl dNTP,按42 ℃ 60 min,70 ℃ 5 min的反应条件进行逆转录扩增。合成后的cDNA于-80 ℃保存。
| 表 2 miR-205及U6特异性逆转录引物序列 |
应用Bio-Rad iTaq Universal SYBR Green Supermix试剂盒及Bio-Rad CFX96实时定量PCR仪(Bio-Rad, California, USA),以U6为内参基因,采用实时荧光定量PCR (Quantitive real-time PCR, qRT-PCR)法检测miR-205在各组血浆样本中的表达水平。20 μl反应体系包括:10 μ SYBR Green supermix,2 μ cDNA,0.8 μ 10 mmol/L上游引物,0.8 μ 10 mmol/L下游引物(表 3),6.4 μ ddH2O。反应条件: 95 ℃ 30 s, 95 ℃ 5 s, 57 ℃ 30 s, 72 ℃ 30 s,40个循环。所有反应均含2个复孔,且Ct值大于37被视为不可靠结果,从统计分析中排除。采用2-ΔCt的方法进行结果分析。ΔCt=目的基因Ct-内参基因Ct。
| 表 3 miR-205及U6的qRT-PCR上下游引物序列 |
采用SPSS 21.0对样本资料信息及血浆miR-205在各组中的表达差异进行统计分析。其中定量资料符合正态分布者采用单因素方差分析(Oneway ANOVA)的统计学方法,不符合正态分布者则采用秩和检验(Mann-Whitney test)。对于计数资料则采用卡方检验(Chi-square test)。GraphPad Prism 6用于绘制ROC曲线及计算曲线下面积(area under the curve, AUC)来评估miR-205的诊断价值。计算约登指数(Youden’s index)选择最佳界值(Cut-off value)。二分类Logistic回归用于分析血浆miR-205联合AFP在鉴别HBV-HCC与HBV-LC时的效能。上述统计分析以P<0.05为差异有统计学意义。
2 结果 2.1 血浆miR-205在4组中表达水平的比较血浆miR-205在HBV-HCC中的表达水平明显低于健康对照组(P<0.001)和HBV-LC组(P<0.001)。然而,HBV-HCC与CHB相比差异无统计学意义(P=0.921)。此外,HBV-LC血浆miR-205的水平较CHB组升高,差异有显著统计学意义(P<0.001)。见图 1。
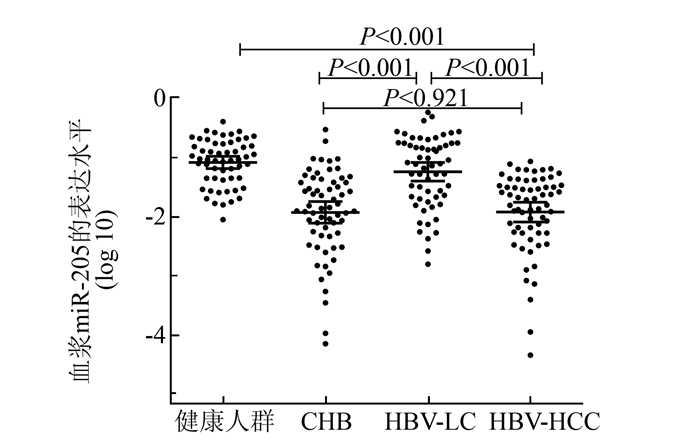
|
图 1 血浆miR-205在健康人群及HBV相关肝脏疾病患者中表达水平的比较 |
为了评估血浆miR-205作为HBV-HCC诊断标志物的潜在价值,我们分别绘制了HBV-HCC区别健康人群(图 2A)、HBV-HCC区别HBV-LC (图 2B)、HBV-LC区别CHB (图 2C)的ROC曲线,并根据最大Youden指数确定最佳Cut-off值及敏感性和特异性。另外,我们还验证了血浆miR-205联合AFP在HBV-HCC与HBV-LC (图 2D)鉴别诊断中的效能。见表 4、图 2。
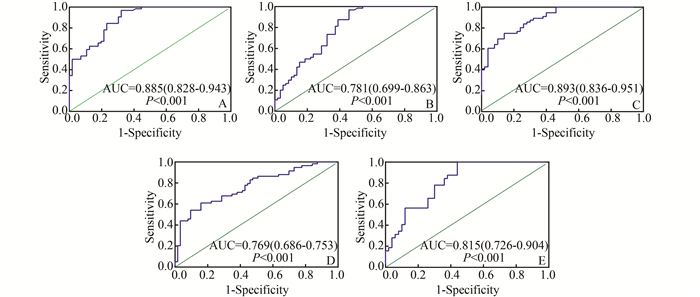
|
图 2 血浆miR-205在HBV-HCC鉴别诊断中的诊断效能 A: HBV-HCC与健康人群鉴别;B:HBV-HCC与HBV-LC鉴别;C:血浆miR-205联合AFP鉴别HBV-HCC与HBV-LC;D: HBV-LC与CHB鉴别;E:血浆miR-205鉴别AFP<400 ng/ml的HBV-HCC与HBV-LC |
| 表 4 血浆miR-205在HBV-HCC鉴别诊断中的诊断效能(x±s) |
AFP是HCC诊断中普遍应用的肿瘤标志,但是AFP诊断HCC的敏感性较低。临床上一般以AFP>400 ng/ml作为HCC的诊断标准。我们发现在收集的64例HBV-HCC患者中除8例患者未采集到AFP信息外,有32例患者AFP水平在400 ng/ml以下,占总HBV-HCC人数的50%。为了验证血浆miR-205能否较好地从AFP小于400 ng/ml的HBV-HCC患者和HBV-LC患者中鉴别出HBV-HCC, 我们应用AFP小于400 ng/ml的HBV-HCC及HBV-LC患者相对应的血浆miR-205绘制了ROC曲线,结果见表 4、图 2E。
3 讨论肝细胞癌(HCC)目前仍是全球范围内发病率、死亡率较高的癌症之一,其预后与早期诊断密切相关。然而HCC的诊断却缺乏有效可靠的标志物。近年来,越来越多的研究表明一些miRNA的表达水平受HBV感染的调控,这些异常表达的miRNA可能在乙肝病毒所致肝细胞癌的发生过程中发挥重要作用[10]。循环miRNA因此成为了HBV-HCC诊断标志物的研究热点并获得了比较满意的诊断价值。
Zhang等[11]发现与癌旁组织相比,miR-205在HCC组织中的表达水平明显降低,且乙肝病毒X蛋白(HBx)的表达水平与miR-205呈明显的负相关关系。随后他们发现高表达miR-205可抑制HBx诱导的肝癌细胞的增殖,并证实HBx mRNA是miR-205的靶基因,HBx在与miR-205相互作用时可引起miR-205启动子高度甲基化而使这一抑癌基因的表达水平降低以促进HCC的发生。这表明miR-205在HBV-HCC中扮演着抑癌基因的作用。本研究选取抑癌基因miR-205作为对象,研究其在健康人群、CHB、HBV-LC及HBV-HCC患者血浆中的表达水平,并验证其在HBV-HCC鉴别诊断中的潜在价值。
结果显示,血浆miR-205在HBV-HCC中的表达水平与健康人群相比有明显的下降趋势(P<0.001)。这一结果与Zhang[11]研究结果相一致。ROC曲线分析显示,血浆miR-205可以作为从健康人群中鉴别HBV-HCC较好的诊断标志物,具有较高的曲线下面积及敏感性。为了验证降低的miR-205是否是由HBV肝损伤引起,我们将血浆miR-205在CHB和HBV-LC中的表达水平分别与HBV-HCC进行了比较。结果发现HBV-HCC与HBV-LC相比差异有明显的统计学意义(P<0.001),ROC曲线分析也证实血浆miR-205作为HBV-HCC与HBV-LC鉴别诊断标志物的潜在价值,但其特异性较低,仅为54.2%。我们采用二分类Logistic回归的方法通过血浆miR-205与AFP联合检测发现,虽然敏感性有所降低,但特异性和曲线下面积较血浆miR-205单独检测有明显提升。此外,我们还发现血浆miR-205在HBV-LC中表达水平明显高于CHB组,ROC曲线分析结果显示这一循环miRNA也可以作为慢性乙型肝炎发展至乙肝肝硬化过程的监测指标。遗憾的是,我们在HBV-HCC组与CHB组间没有发现统计学差异(P=0.921), 造成这一结果的原因还有待于进一步的研究。
如前所述,AFP在HCC诊断中的价值仍不能满足临床需要,尤其是AFP水平在400 ng/ml以下的HCC患者很易漏诊。由于我们的研究证实了血浆miR-205的表达量在HBV-HCC与HBV-LC间有统计学差异,我们接下来分析了血浆miR-205在从AFP小于400 ng/ml的HBV-HCC及HBV-LC患者中鉴别出HBC-HCC的效能是否优于AFP。结果显示,血浆miR-205在诊断AFP小于400 ng/ml的HBV-HCC患者中呈现出较高的阳性预测值,其敏感性为100%,AUC为0.815。这就意味着血浆miR-205能够鉴别出应用传统AFP不能诊断的早期伴有肝硬化HBV-HCC患者。
近年来,miR-205作为肿瘤标志在包括宫颈癌、前列腺癌、结直肠癌、膀胱癌等多种癌症疾病中得到了广泛深入的研究。本研究结果虽然证实血浆miR-205在CHB组与HBV-HCC中的表达水平无统计学差异,使其作为标志物应用于HBV-HCC的诊断有一定的局限性,但其在HBV-HCC早期诊断,尤其是监控由乙肝肝硬化发展至肝细胞癌过程的潜在价值是不可忽视的。这一发现为寻找新的有效循环miRNA应用于HBV-HCC的早期诊断、预后判断及基因靶向治疗提供了参考,其能否作为HBV-HCC的特异性诊断标志仍有待于更大样本数据的证实。
| [1] | El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma[J]. Gastroenterology, 2012, 142(6): 1264-1273. DOI: 10.1053/j.gastro.2011.12.061. |
| [2] | Fernandez-Rodriguez CM, Gutierrez-Garcia ML. Prevention of hepatocellular carcinoma in patients with chronic hepatitis B[J]. World J Gastrointest Pharmacol Ther, 2014, 5(3): 175-182. DOI: 10.4292/wjgpt.v5.i3.175. |
| [3] | 中华医学会肝病学分会肝癌学组. 原发性肝癌规范化诊治的专家共识[J]. 肿瘤, 2009, 29(4): 295-304. |
| [4] | Qi J, Wang J, Katayama H, et al. Circulating microRNAs (cmiRNAs) as novel potential biomarkers for hepatocellular carcinoma[J]. Neoplasma, 2013, 60(2): 135-142. |
| [5] | Raza A, Sood GK. Hepatocellular carcinoma review: current treatment, and evidence-based medicine[J]. World J Gastroenterol, 2014, 20(15): 4115-4127. DOI: 10.3748/wjg.v20.i15.4115. |
| [6] | Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci USA, 2008, 105(30): 10513-10518. DOI: 10.1073/pnas.0804549105. |
| [7] | Tarocchi M, Polvani S, Marroncini G, et al. Molecular mechanism of hepatitis B virus-induced hepatocarcinogenesis[J]. World J Gastroenterol, 2014, 20(33): 11630-11640. DOI: 10.3748/wjg.v20.i33.11630. |
| [8] | Qi P, Cheng SQ, Wang H, et al. Serum microRNAs as biomarkers for hepatocellular carcinoma in Chinese patients with chronic hepatitis B virus infection[J]. PLoS One, 2011, 6(12): e28486. DOI: 10.1371/journal.pone.0028486. |
| [9] | Xu J, Wu C, Che X, et al. Circulating microRNAs, miR-21, miR-122, and miR-223, in patients with hepatocellular carcinoma or chronic hepatitis[J]. Mol Carcinog, 2011, 50(2): 136-142. DOI: 10.1002/mc.20712. |
| [10] | Zhang ZZ, Liu X, Wang DQ, et al. Hepatitis B virus and hepatocellular carcinoma at the miRNA level[J]. World J Gastroenterol, 2011, 17(28): 3353-3358. DOI: 10.3748/wjg.v17.i28.3353. |
| [11] | Zhang T, Zhang J, Cui M, et al. Hepatitis B virus X protein inhibits tumor suppressor miR-205 through inducing hypermethylation of miR-205 promoter to enhance carcinogenesis[J]. Neoplasia, 2013, 15(11): 1282-1291. DOI: 10.1593/neo.131362. |
 2016, Vol. 37
2016, Vol. 37

