根管充填材料性能好坏是根管治疗成功与失败的最终决定因素。理想的根管充填材料应具有消毒杀菌,遇唾液不收缩、坚固不根折,不受温度影响、便于医生操作,根充后具有X线阻射而透射清晰等理化特征[1];充填后能与根管壁封闭密合,不出现微渗漏,对牙髓及根尖周组织无毒和排异反应而利于生长发育等生物相容性[2]。氢氧化钙因具有根充材料应有的良好理化特性和生物相容性而成为目前最有效的根管充填糊剂之一,但和其他根充材料一样,其分子颗粒大,不能渗透到细微而不规则的牙本质小管,与管壁不能完全密合出现微渗漏,对牙髓和牙周组织有一定的刺激性和毒性,以致仍有大部分根管治疗病例不能达到完全封闭而失败[3]。纳米氢氧化钙根充材料是以氢氧化钙根充糊剂为基础开始在一些实验室进行研制的新型充填制剂,它除了拥有氢氧化钙根充材料优点之外,更主要是充分发挥了自身纳米化优势[4]。但到目前为止,纳米氢氧化钙根管充填材料的制备和表征以及生物相容性仍处在实验室研发状态,制备方法还需改进和求证[5]。为此,本实验室在已有制备纳米氢氧化钙的基础上对制备方法进行改良和表征,通过葡萄糖定量法和红细胞溶血试验检测其生物相容性,旨在为临床上科学合理制备新型纳米氢氧化钙根充材料并将其应用于临床根管治疗提供指导方向和实验证据。
1 材料与方法 1.1 主要实验仪器和试剂仪器:数字控制注射泵(B.Braun Melsungen Ag, 德国)、超声波清洗器(KQ-500E, 昆山市超声仪器有限公司)、傅里叶红外光谱仪(NieoletNEXUSB70,日本)、扫描电子显微镜(SHIMADZU SSX-550,日本)、根管锉和高、低速手机(NSK,日本)、全自动生化分析仪(Roche Modular P800,美国)、紫外分光光度计(UV-260,上海天美科学仪器有限公司)。试剂:氯化钙、正丁醇、氢氧化钠、氢氧化钙、聚乙二醇-400(PEG400)均为国产分析纯;Vitapex(日本森田株式会社)、葡萄糖-氧化物酶试剂盒(上海申能-德赛诊断技术有限公司)。
1.2 纳米氢氧化钙根充糊剂的制备及表征采用液相声化学沉淀法原理。取150 mmol/L的CaCl2 30 ml加入到250 ml锥形瓶中,再加入4.2 mmol/L的PEG400 10 ml,超声波振动陈化2 h,得到PEG400包覆CaCl2溶液。利用注射泵和溶药注射器以及延长管组成反应体系,用注射器抽取150 mmol/L的NaOH 50 ml,向锥形瓶中CaCl2输注,同时用磁力搅拌器搅拌,超声波震荡,再磁力搅拌器搅拌,直至NaOH输注完成,后改用超声波振动30 min,离心弃除上清液,用适量蒸馏水洗涤反应沉淀物并离心,反复3次,获得纳米氢氧化钙湿凝胶。将湿凝胶转移到三角烧瓶中,加入50 ml正丁醇,磁力搅拌器搅拌,超声波振动,加热回流,温度从正丁醇和水的共沸点366 K,逐步升到正丁醇的共沸点399 K,使水和正丁醇挥发,得到湿凝胶放入真空干燥机抽滤,干燥箱加热24 h,得到实验粉体。取制备粉体1 mg进行KBr压片,用红外光谱分析仪测定材料中是否含有氢氧化钙和聚乙二醇的红外光谱图;另取粉体1 mg,平铺于单晶硅片镜面上进行透射电子显微镜检测粒径大小。
1.3 纳米氢氧化钙根充糊剂制备将上述粉体10 g倒入无菌50 ml烧杯,加入医用碘仿和甘油各3 g,用无菌牙科调刀搅拌调制5 min,后经滴度试验测定根充糊剂在15-20 min内停留在调刀一面而不从边缘滴下;拉长试验测定根充糊剂能够拉长3-5 cm粗丝而不中断,说明本实验室调制的纳米氢氧化钙糊剂符合临床根管治疗的要求。
1.4 纳米氢氧化钙根充糊剂的生物功能性测定 1.4.1 实验对象选取武汉大学口腔医学院口腔颌面外科因正畸等需要新鲜拔除根尖发育完全以及单根直管前磨牙60颗,要求牙根完整、根管通畅,牙体无折裂、表面无龋坏和隐裂,牙根的长度和直径相近。牙齿留取后用超声除去牙体表面的结石和软组织膜纤维,后贮存于4℃ 4%氯胺中备用。留取牙齿时得到患者知情同意。
1.4.2 根管预备和充填对留取牙进行常规开髓、拔髓后,用15# K锉插入根管至肉眼在根尖孔水平处看到锉尖为止,退出确定根管长度,操作长度以根管长度减1 mm。用手机3# G钻从S1号逐次扩大根管至F3号,预备至整个工作长度,每次更换器械后都用2.5%的次氯酸钠和17%的EDTA(pH=7.7)交替冲洗,预备完成后,将牙随机分为A、B、C、D四组,每组15颗。A组为阴性对照组,使用牙胶尖与含主要成分氢氧化钙的Vitapex复合根充糊剂;B组为阳性对照组仅用牙胶尖充填;C组为Vitapex根充糊剂;D组为纳米氢氧化钙根充材料;对A、C和D组采用垂直加压技术充填根管,B组不处理。要求每组牙充填材料至根中1/3,长度10 mm,后乙醇棉捻和暂封剂暂封,根尖用蜡封闭,贮存于37 ℃、100%的湿盒中48 h待用。以上操作均由同一名医师独立完成。
1.4.3 根管微渗漏测定根据徐琼等[6]建立的葡萄糖定量分析根管微渗漏模型(图 1),将A组牙根外表面,包括根管口和根尖孔均用黏蜡封闭;B、C和D组牙根外表面除根管口和根尖孔外涂粘蜡。把每组根充牙安装到底部有开口的Eppendorf管内,后将整个装置安放在37 ℃、100%湿度的环境中,分别于第1,2,4,7,14,21,28天的同一时间段取玻璃瓶中样品10 μl,置于全自动生化分析仪,用葡萄糖氧化酶比色法检测各样品中葡萄糖浓度,反映微渗漏的大小。每次取样后补充同体积灭菌蒸馏水,保持整个试验过程中输液管内葡萄糖液面高度不变。
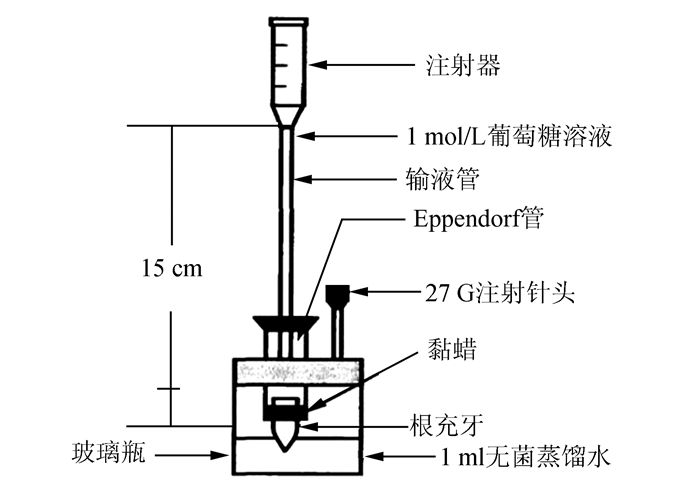
|
图 1 葡萄糖定量检测根管微渗漏的模型 |
实验由0.9%生理盐水的阴性对照Ⅰ组、蒸馏水的阳性对照Ⅱ组和2 g纳米氢氧化钙根充材料粉末溶于10 ml蒸馏水而制成浸提液经高压灭菌1 h的Ⅲ组形成。每组各取2 ml加入到3支无菌5 ml试管,置于37 ℃水浴锅30 min。抽取人体新鲜血液2 ml,抗凝后加入8-12 ml生理盐水,使其血红蛋白含量为(1.25±0.125) mg/ml,分别抽取稀释后血液0.2 ml加入各组试管,37 ℃水浴振荡1 h,后800 r/min离心5 min,取每管上清液3份,各200 μl加于比色杯,用分光光度计测定血红蛋白数值,波长545 nm,取平均值作为各组血红蛋白相对值(OD值)。生物安全性用溶血率(%)=ODⅢ组-ODⅠ组/ODⅡ组-ODⅠ组×100%表示。溶血率≤5%为材料不引起溶血反应;溶血率>5%为材料引起溶血反应;当肉眼观察试管上层液透明红色,管底无红细胞沉集为全溶血;当上层液澄色或茶色,管底有少量红细胞残留为部分溶血;当上层液淡黄色透明状,红细胞全部下沉为无溶血,但振摇后管底红细胞不分散时为凝集,并用显微镜观察各组管底红细胞的形态和分布特点。
1.6 统计学处理数据用Origin 8.0软件多样本比较的单因素方差分析(One-way ANOVA)进行统计学分析。因数据变量为非正态分布,采用多个样本比较的秩和检验。若结果差异有显著性(P<0.05),则进行多个样本的两两比较。
2 结果 2.1 纳米氢氧化钙的制备经对制备纳米氢氧化钙方法的改良,使得制备时间明显缩短,避免了空气中细菌污染和飞尘微粒干扰,减轻了实验者的劳动强度和精神负担,降低了制备成本;制得的纳米氢氧化钙粉体分散均匀,没有软或硬团聚。
2.2 纳米氢氧化钙粉体的表征与标准氢氧化钙和聚乙二醇红外光谱图比较,本实验制备的粉体分别在872.49 cm-1、1 640.74 cm-1附近处有明显吸收峰,这是氢氧化钙存在表征;在1 098.13 cm-1、3 444.48 cm-1附近有非常强吸收峰,是聚乙二醇存在表征(图 2A)。经透射电子显微镜检测,本实验制备的粉体粒径为100-200 nm,形态呈球形和链球形等多种形态,分散性好(图 2B所示)。
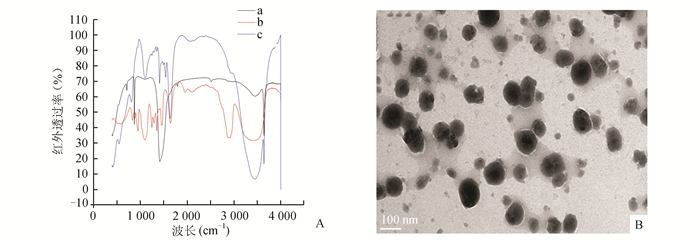
|
图 2 纳米氢氧化钙粉体的表征 A:标准氢氧化钙a、标准聚乙二醇b和聚乙二醇包覆改性纳米氢氧化钙c的红外光谱图;B:透射电镜观察纳米氢氧化钙粒径大小,放大倍数为100 nm |
从图 3发现,随着天数增加,A组微渗漏值几乎没有变化,B、C组逐步明显增加,D组先期变化较弱,后期变化稍微明显。四组测定的微渗漏值在开始几天呈偏态分布,后期趋于近似正态分布。从表 1可知,D组在第1至14天,微渗漏值之间没有显著性差异(P>0.05),随后微渗漏值是28 d>21 d>14 d(P均<0.01);与C组比较,D组微渗漏值在第1至4天减小不明显(P>0.05),在随后在相同天数内均显著减小(P<0.05或0.01)。
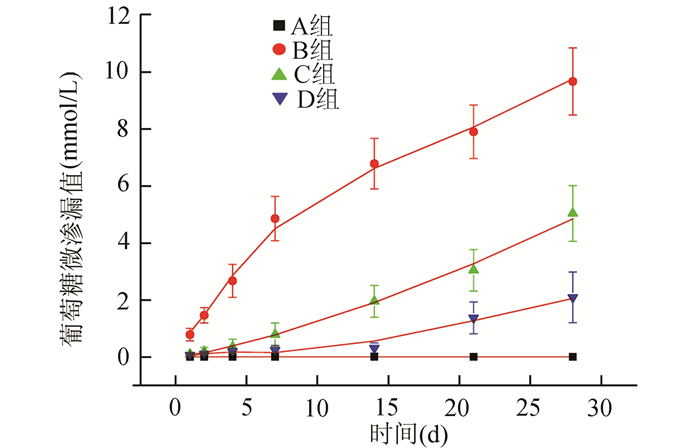
|
图 3 四组牙在不同天数中葡萄糖微渗漏值变化趋势 |
| 表 1 四组牙在不同天数中葡萄糖微渗漏值比较(mmol/L, x±s) |
经肉眼观察上层液和管底红细胞,Ⅰ组为浅黄色,底部沉集红细胞;Ⅱ组为浅红色,底部无红细胞沉集;Ⅲ组状况几乎和Ⅰ组一致。显微镜下,Ⅰ组和Ⅲ组管底红细胞形态完整,没有破裂状况,Ⅱ组没有发现完整红细胞;Ⅲ组的OD值为0.05±0.02,明显低于Ⅱ组的OD值为0.7±0.08(P<0.01),高于Ⅰ组的OD值为0.02±0.01(P<0.05);Ⅲ组溶血率为4.41%。
3 讨论根管充填在整个根管治疗过程中起着决定性作用,它可防止充填材料和牙本质小管壁之间出现间隙产生微渗漏、细菌再定植和根尖周组织染色以及病变。氢氧化钙根充糊剂是目前临床上根管治疗中最常用的材料,但和其他根充糊剂一样,依然存在着根管治疗不成功的问题[7]。纳米氢氧化钙根充材料在承接氢氧化钙根充糊剂理化特性、生物相容性和生物活性的基础上,更多是利用自身粒径小、比表面积大易于渗入到牙本质小管各个区域起到长期消毒杀灭细菌的作用,纳米粒子排列紧密,强度高,韧性大、溶解度高,持久耐用利于纳米氢氧化钙流动性好、可操作性强、封闭性高,与牙本质小管壁接触不出现微渗漏[8]。但已有纳米氢氧化钙制备方法繁杂,制备过程容易团聚而不分散等状况制约了临床应用。本实验利用能够产生空穴效应超声波与化学沉淀反应相结合的液相声化学沉淀法制备纳米材料,在此制备过程中改良制备装置,利用临床上为病人静注的数字控制注射泵和无菌溶药注射器以及注射泵延长管组成封闭无菌反应体系代替传统开放式简易玻璃滴定容器,使自动化程度增高,无菌、防尘效果好,减少了人力。在液体陈化、滴定反应和分散干燥过程中均使用了超声波振动,使原有的制备纳米氢氧化钙一个循环超过48 h缩减到24 h以内,节约了时间、能源和物力,符合临床根管治疗无菌、防尘,减少患者治疗费用的要求。
本实验还用聚乙二醇代替聚乙烯醇改性氢氧化钙,因为聚乙二醇最早作为医学眼科、牙科以及美容材料的添加剂被广泛使用。作为一种含有羰基大分子聚合物,微溶于水,不与Ca2+发生强烈的络合作用,制备出纳米颗粒不易团聚,粒径均匀分散,流动性、操作性更好,经旧材料新用途改性纳米氢氧化钙,使其更容易发挥强碱效应,消毒杀菌更持久,更利于损裂的牙本质小管修复密封。在制得纳米氢氧化钙粉体的干燥过程中用正丁醇共沸蒸馏干燥法代替无水乙醇干燥法,使纳米氢氧化钙分散性更好,颗粒更均匀,不会出现软、硬团聚,容易洗脱不会残留于纳米粉体的表面。这些特征在本实验对制备粉体进行表征证实,经红外线光谱测定并与标准的氢氧化钙和聚乙二醇的吸收波峰比对,证实本实验室制备的材料含有氢氧化钙和聚乙二醇成分;经透射电子显微镜观测,改良制备的粉体粒径在100-200 nm左右,颗粒分散均匀,形态变化比较一致。说明本实验室经改良制备方法得到新的材料完全是经过改性、纳米级和分散均匀的氢氧化钙粉体,适合作为根管充填材料的基质[9]。
判断一种新制备材料是否符合根充材料要求,需要观察其防止微渗漏和生物相容性[10]。本研究发现,新制备纳米氢氧化钙根充糊剂防止微渗漏作用显著高于目前临床上使用普通氢氧化钙根充糊剂,且随使用时间延长,其防止微渗漏作用并没有完全减退,显示出本实验制备纳米氢氧化钙根充糊剂的充填、封闭效果明显优于临床根管治疗中已有根充糊剂,对裂损牙本质小管具有粘合、牢固和修复生物效应[11]。溶血试验发现,新制备纳米根充材料与人体红细胞接触后不会出现溶血后的淡红色液体,细胞形态完整,溶血率为4.41%,显著低于临床要求根管充填材料溶血率≤5%范围,说明本实验制备纳米氢氧化钙根充材料不会引起凝血反应造成溶血状态,对细胞没有明显毒副作用,符合口腔医用材料对溶血率的要求,可以作为根管充填材料应用于临床根管治疗[12]。因此,经过本实验对制备纳米氢氧化钙方法的改进和表征以及生物相容性测试,提示纳米氢氧化钙根充材料具有很好的实用价值与应用前景,并为根管充填材料的研发提供一种新的思路和方法。
| [1] | Hammad M, Qualtrough A, Silikas N. Evaluation of root canal obturation: a three-dimensional in vitro study[J]. J Endod, 2009, 35(4): 541-544. DOI: 10.1016/j.joen.2008.12.021. |
| [2] |
颜雯, 李伟. 常用根管充填材料的细胞毒性和基因毒性[J].
国际口腔医学杂志, 2013, 40(5): 608-611.
Yan W, Li W. Cytotoxicity and genotosicity of dental filling materials utilized in endodontic therapy[J]. International Stomatological Medicine Journal, 2013, 40(5): 608-611. DOI: 10.7518/gjkq.2013.05.015. |
| [3] |
吴婷, 王禹琨, 马廷建. 根管充填材料的应用比较及评价[J].
中国组织工程研究, 2012, 16(51): 9 663-9 670.
Wu T, Wang YK, Ma TJ. Comparison and evaluation of root canal filling materials[J]. Chinese Journal of Tissue Engineering Research, 2012, 16(51): 9 663-9 670. |
| [4] |
刘明, 李泽, 刘红娟, 等. 纳米氢氧化钙根管充填材料对乳牙根管治疗的安全性研究[J].
中国实用医药, 2014, 9(8): 107-108.
Liu M, Li Z, Liu HJ, et al. Safe evaluation of nanometer calcium hydroxide root canal filling material on root canal therapy with primary tooth[J]. China Prac Med, 2014, 9(8): 107-108. |
| [5] | Xu Q, Cheung GSP, Deng WJ, et al. Sucrose as a stable tracer for quantifying endodontic leakage[J]. J Dent Sci, 2012, 7(3): 267-271. DOI: 10.1016/j.jds.2012.06.002. |
| [6] |
徐琼, 樊明文, 范兵. 葡萄糖定量分析根管微渗漏模型的建立[J].
现代口腔医学杂志, 2003, 17(3): 215-217.
Xu Q, Fan MW, Fan B. A new method with glucose for quantitative analysis of endodontic microleakage[J]. J Modern Stomatol, 2003, 17(3): 215-217. |
| [7] |
惠志飞, 景双林, 周洲, 等. 百年根管治疗的成与败[J].
口腔医学, 2016, 36(6): 561-569.
Hui ZF, Jing SL, Zhou Z, et al. Success and failure of root canal therapy in one hundred years[J]. Stomatological Medicine, 2016, 36(6): 561-569. |
| [8] | Chogle SM, Duhaime CF, Michel AK, et al. Preliminary evaluation of a novel polymer nanocomposite as a root-end filling material[J]. Int Endod J, 2011, 44(11): 1 055-1 060. DOI: 10.1111/iej.2011.44.issue-11. |
| [9] | Liang YH, Li G, Shemesh H, et al. The association between complete absence of post-treatment periapical lesion and quality of root canal filling[J]. Clin Oral Investig, 2012, 16(6): 1 619-1 626. DOI: 10.1007/s00784-011-0671-3. |
| [10] | Asgary S, Nosrat A, Seifi A. Management of inflammatory external root resorption by using calcium-enriched mixture cement: a case report[J]. J Endod, 2011, 37(3): 411-413. DOI: 10.1016/j.joen.2010.11.015. |
| [11] |
路瑶, 姚丽萍, 卢志山. 新型根管倒充填材料的研究进展[J].
牙体牙髓牙周病学杂志, 2014, 24(8): 495-497.
Lu Y, Yao LP, LU ZS. Progresses in the study of root-end filling materials[J]. Chin J Conserv Dent, 2014, 24(8): 495-497. |
| [12] |
车彤. 根管治疗中不同充填材料的应用效果及其生物相容性[J].
中国组织工程研究与临床康复, 2010, 14(21): 3 927-3 930.
Che T. Different filling materials in root canal therapy and their biocompatibility[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2010, 14(21): 3 927-3 930. |
 2018, Vol. 39
2018, Vol. 39


