直接前侧入路(direct anterior approach,DAA)全髋关节置换术由浅层的缝匠肌和阔筋膜张肌间隙及深层的股直肌和臀中肌间隙,直达髋关节,相对于常规的后外侧入路(posterlateral approach, PLA), 是一种真正的从肌间隙进入的微创入路[1]。关于DAA疗效的国内外报道不尽相同。多项研究表明,DAA具有较好的肌肉软组织保护、康复快、低脱位率等优点[2-4];但也有学者认为DAA存在延长手术操作时间、增加出血量、损伤股外侧皮神经及创伤愈合等问题[3]。小切口和最小化的软组织暴露会带来一定的限制,从而使假体位置达不到最优以及增加股骨穿孔和术中骨折的可能性[4]。
髋臼假体放置的外展角、前倾角、肢体长度差异及股骨偏心距是评价假体位置好坏的重要指标,并且影响假体的稳定性和寿命。不良的假体组件位置与假体脱位、髋关节活动受限、假体磨损均具有密切关系[5, 6]。目前,国内外尚缺乏通过影像资料评价DAA疗效的相关研究。
本文基于DAA与PLA两种入路置换的髋关节术后X线摄片,对髋臼假体放置的外展角、前倾角、肢体长度差异及股骨偏心距差异作比较分析。
1 资料与方法 1.1 一般资料本组90例90髋,其中男48例,女42例,年龄51-83岁,平均65.5岁。原发疾病分别为股骨颈骨折54例,股骨头无菌性坏死合并骨关节炎26例,成人发育性髋关节脱位及髋臼发育不良等病例未纳入统计。采用直接前侧入路手术45例,其中股骨颈骨折26例、髋关节骨关节炎19例。采用后外侧入路45例,其中股骨颈骨折28例、髋关节骨关节炎17例。所有患者均采用生物型人工髋关节假体。如表 1所示,除后外侧入路组患者体质量指数(BMI)高于直接前侧入路组外,两组患者年龄、性别比较,差异均无统计学意义。
| 表 1 直接前侧入路组与后外侧入路组一般资料的比较(x±s) |
直接前侧入路:麻醉实施成功后取仰卧位,从髂前上棘外侧两横指远端两横指处开始向远端作一约8-10 cm切口,逐层切开皮肤、皮下组织、筋膜,显示阔筋膜张肌和缝匠肌间隙,保护并牵开股外侧皮神经,将阔筋膜从其中间切开并与肌纤维分离,并轻轻地向外侧牵开,暴露Smith-Peterson间隙。分离并结扎旋股外侧血管的升支,将股直肌和阔筋膜张肌之间的筋膜切开,拉钩将肌肉牵开暴露前方关节囊。切开前方关节囊后,用两把钝性拉钩环抱股骨颈,将股骨颈作两道相距1 cm的平行截骨,取出截骨块及股骨头,去除髋臼周围增生骨赘后用带双偏心距的工具磨锉髋臼植入假体和内衬。再将手术床远端下降30-40 °,患肢极度外旋内收,提升显露股骨近端。然后用带双偏心距的打击器常规逐号扩髓植入股骨假体和股骨头,复位关节,检查髋关节活动度及稳定性。
后外侧入路:患者麻醉实施成功后取侧卧位,Kidney支撑架在耻骨和骶骨处支撑骨盆,骨性突起处予以保护。以大转子为中点作髋后外侧切口约10 cm,逐层切开皮肤、皮下组织,显露阔筋膜和臀大肌,直接切开阔筋膜,向近端延长至臀大肌,劈开阔筋膜张肌纤维,使用Charnley牵开器牵开。术中注意保护臀中肌和股方肌。髋关节内旋后在大转子止点处切断外旋肌群,保留部分大转子处腱性组织以便术后缝合修复。切开后方关节囊,脱位关节,在小转子上方约1-1.5 cm水平截断股骨颈,取出股骨头;显露髋臼,去除髋臼周围增生骨赘,磨锉并植入髋臼假体和内衬。髋关节内旋、屈曲、内收,暴露股骨近端后扩髓植入合适大小股骨柄和股骨头,复位关节,检查髋关节活动度和稳定性。
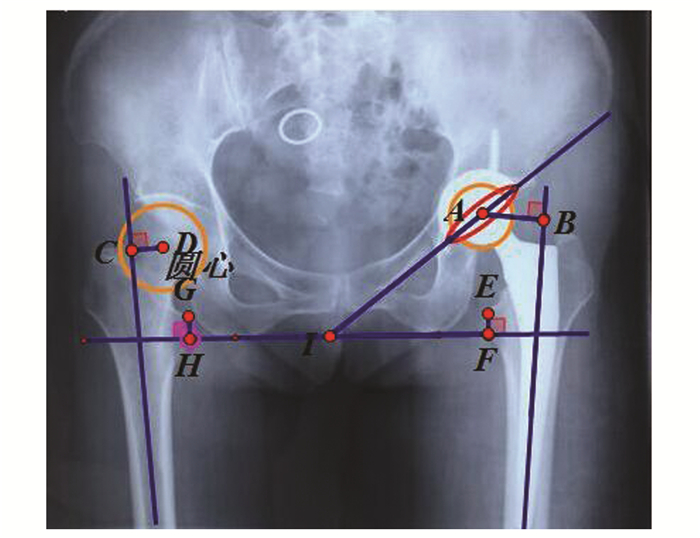
1.3 测量及计算方法收集术后2-3 d患者的骨盆正位片,在计算机上使用几何画板软件进行测量(图 1)。值得注意的是,对于长度的测量,使用图片测量的数值与实际数值存在差异。因此,需要根据股骨柄的长度对数据进行修正。以下数据均已经过修正。
|
图 1 各项测量指标示意图 AB为术侧股骨偏心距,CD为健侧股骨偏心距;EF-GH为肢体长度差异;角AIF为臼杯外展角 |
髋臼杯口上下缘连线与两侧坐骨结节连线的夹角即为外展角[7]。根据Lewinnek等人的描述,可接受的髋臼外展角应在30-50 °之间,称此区间为安全区间[7]。分别将两组数据中在此区间内的例数除以各组总例数即可得到两组样本外展角的可接受率。
1.3.2 髋臼前倾角的测量及计算方法在X线片上标记髋臼杯口形成的椭圆的最大直径D,在最大直径的1/5处标记点M,经过点M作最大直径的垂线并与椭圆相交于A、B两点。测量最大直径D和点M到点A或点B的距离P,则髋臼前倾角为arcsin[P/(0.4D)][8]。见图 1。
1.3.3 肢体长度差异的测量及计算方法连接两侧坐骨结节作一横线,再分别经双侧小粗隆作该横线的垂线,分别测出两垂直距离,再取差值即为肢体长度差异[9]。
根据Austin等人的描述,肢体长度差异大于5 mm被认为是不可接受的[10]。分别将两组数据中在[-5 mm,5 mm]区间内的例数除以各组总例数即可得到两组样本肢体长度差异的可接受率。
1.3.4 股骨偏心距差异的测量及计算方法在骨盆正位片上,作股骨干中轴线并向上延伸,找出股骨头假体的中心,经此点作股骨干轴线延长线的垂线,此点线之间的距离即为股骨偏心距差异[11]。
根据Cassidy等人的研究结果,股骨偏心距差异的安全区间应为[-5 mm,5 mm][12]。分别将两组数据中在[-5 mm,5 mm]区间内的例数除以各组总例数即可得到两组样本股骨偏距差异的可接受率。
1.4 统计学分析所有数据采用SPSS 17.0医学统计学软件进行处理、分析,计量资料以均数±标准差表示,组间比较采用t检验,计数资料采用卡方检验,P<0.05时为差异有统计学意义。
2 结果 2.1DAA组较后外侧组髋臼假体外展角的差异有统计学差异(P<0.05),两组前倾角、肢体长度差异和股骨偏心距差异的差值无统计学意义,见表 2。
| 表 2 两组入路术后髋臼假体外展角、前倾角、肢体长度差异和股骨偏距的比较(x±s) |
DAA入路组较后外侧入路组术后髋臼假体外展角具有更高的可接受率(P<0.05),前倾角、肢体长度差异和股骨偏距的可接受率无明显差别,见表 3-6。
| 表 3 外展角可接受率的比较 |
| 表 4 前倾角可接受率的比较 |
| 表 5 肢体长度差异可接受率的比较 |
| 表 6 股骨偏心距差异可接受率的比较 |
假体位置特别是髋臼假体的位置与脱位高度相关。髋臼假体的理想位置应该是外展(45±10)°、前倾(15±10)°,在该范围内人工髋关节脱位率明显下降[7]。髋臼外展角反映髋臼对股骨头的覆盖程度,适宜的髋臼外展角可达到髋臼对股骨头的良好覆盖,保证髋关节的活动度和稳定性,减少撞击及磨损。髋臼假体良好的前倾角也是假体稳定的基础,不良的位置预示着脱位和不稳定。合适的偏心距可维持髋关节周围软组织的张力,一定的软组织张力有利于保持髋关节的稳定。假体的偏距与健侧的偏距差值应在-5-5 mm之间,若小于-5 mm,将加快假体磨损;若大于5 mm,将导致外展无力,影响功能[10]。重建偏心距可使髋关节获得最大的外展功能,减少髋关节所受合力,降低磨损和无菌性松动几率。偏心距增加使股骨外移,减少其与骨盆撞击的发生,改善周围软组织张力,使髋关节更加稳定。偏心距的增加也会增加股骨假体的弯曲力矩,对假体材料的抗疲劳性能要求提高,也会增加股骨近端内侧的压力,尤其是骨水泥型假体内侧骨水泥的压力。偏心距减小,也就减小了外展肌力臂,需要外展肌充分收缩以弥补力臂上的不足,从而使髋关节所受合力和维持步态的做功增加,也增加了磨损和无菌性松动几率。肢体长度差异直接反映术侧和健侧下肢长度的差异,直观反映术后双下肢是否等长。如前所述,肢体长度差异应在-5 mm-5 mm之间,超过此范围则会导致患者步态不良、假体磨损等问题[12]。
3.2 本对比研究结果提示的意义近年来,全髋关节置换手术已逐渐成为一项成熟的常规化手术。后外侧入路具有操作简便、不损伤臀中肌及股骨侧暴露良好等优点,因此成为临床医生最常采用的手术入路[13]。但由于其破坏了髋关节的后方结构,不可避免地造成了后方软组织的薄弱,容易导致术后的髋关节后脱位。许多临床研究发现,术后对髋关节后方结构的修复和加强重建,可以明显降低脱位率[14]。直接前方入路是从股直肌和阔筋膜张肌之间的间隙进入,相比其他入路,肌肉损伤更小[15]。因此,术后人工关节的稳定性大大增强,患者术后早期便可以进行髋关节较大程度的屈曲、内旋和内收动作。因此,不破坏髋关节后侧稳定性的前方入路,具有更低的脱位率。虽然前脱位较后脱位的发生率要低得多,直接前方入路在理论上也存在前脱位的可能。同时,由于直接前入路是从肌间隙进入,无肌肉软组织离断,不仅没有破坏前方稳定性,还能减少术中出血。与常规后外侧入路侧卧位相比,前方入路患者处于仰卧位,对于髋臼假体植入时前倾角外展角的控制更加直观和准确,这可能是本研究中两组入路外展角存在差异的原因之一。然而,微创髋关节置换虽然与传统手术相比具有一定的优势,但也存在缺陷[15]。首先,该入路学习曲线长,往往手术时间相对较长。其次,该入路股骨侧的显露却相对困难,股骨侧及假体放置操作相对困难。此外,需要对旋股外侧血管分支进行良好显露和结扎,以及对股外侧皮神经的保护,以避免造成出血、血肿形成和神经支配区域感觉障碍[15]。此外,DAA术中对于术野的暴露要求患者的体重不宜过大,因此我们在筛选病例时,一般会选择BMI不是过大的患者。也正是因为对患者的选择偏倚,使得本研究中DAA组BMI低于后外侧入路组。但只要BMI不超过30 kg/m2,一般不会对临床疗效结果的真实可靠性产生影响[16]。
从本研究的结果来看,直接前侧入路组术后臼杯的外展角优于后外侧入路组,前倾角、肢体长度差异与后外侧入路组无明显差异。而它所具有的优势如创伤小、康复快等,却是后外侧入路不具备的。综合本研究结果及直接前侧入路的优缺点来看,DAA全髋关节置换术是一种有发展潜力的手术,相信在将来有更大的发展空间。
| [1] | Rachbauer F, Kain MS, Leunig M. The history of the anterior approach to the hip[J]. Orthop Clin North Am, 2009, 40(3): 311-320. |
| [2] | Matta JM, Shahrdar C, Ferguson T. Single-incision anterior approach for total hip arthroplasty on an orthopaedic table[J]. Clin Orthop Relat Res, 2005, 441: 115-124. |
| [3] | Pogliacomi F, De Filippo M, Paraskevopoulos A, et al. Mini-incision direct lateral approach versus anterior mini-invasive approach in total hip replacement: results 1 year after surgery[J]. Acta Biomed, 2012, 83(2): 114-121. |
| [4] | Sariali E, Leonard P, Mamoudy P. Dislocation after total hip arthroplasty using Hueter anterior approach[J]. J Arthroplasty, 2008, 23(2): 266-272. DOI: 10.1016/j.arth.2007.04.003. |
| [5] | Langton DJ, Jameson SS, Joyce TJ, et al. The effect of component size and orientation on the concentrations of metal ions after resurfacing arthroplasty of the hip[J]. J Bone Joint Surg Br, 2008, 90(9): 1 143-1 151. |
| [6] | Little NJ, Busch CA, Gallagher JA, et al. Acetabular polyethylene wear and acetabular inclination and femoral offset[J]. Clin Orthop Relat Res, 2009, 467(11): 2 895-2 900. DOI: 10.1007/s11999-009-0845-3. |
| [7] | Lewinnek GE, Lewis JL, Tarr R, et al. Dislocations after total hip-replacement arthroplasties[J]. J Bone Joint Surg Am, 1978, 60(2): 217-220. DOI: 10.2106/00004623-197860020-00014. |
| [8] | Bachhal V, Jindal N, Saini G, et al. A new method of measuring acetabular cup anteversion on simulated radiographs[J]. Int Orthop, 2012, 36(9): 1 813-1 818. DOI: 10.1007/s00264-012-1583-9. |
| [9] | Ranawat CS, Rao RR, Rodriguez JA, et al. Correction of limb-length inequality during total hip arthroplasty[J]. J Arthroplasty, 2001, 16(6): 715-720. DOI: 10.1054/arth.2001.24442. |
| [10] | Asutin MS, Hozack WJ, Sharky PF, et al. Stability and leg length equality in total hip arthroplasty[J]. J Arthroplasth, 2003, 18: 88-90. DOI: 10.1054/arth.2003.50073. |
| [11] | Lecerf G, Fessy MH, Philippot R, et al. Femoral offset: anatomical concept, definition, assessment, implications for preoperative templating and hip arthroplasty[J]. Orthop Traumatol Surg Res, 2009, 95(3): 210-219. |
| [12] | Cassidy KA, Noticewala MS, Macaulay W, et al. Effect of femoral offset on pain and function after total hip arthroplasty[J]. Arthroplasty, 2012, 27(10): 1 863-1 869. DOI: 10.1016/j.arth.2012.05.001. |
| [13] | Tripuraneni KR, Munson NR, Archibeck MJ, et al. Acetabular abduction and dislocations in direct anterior vs posterior total hip arthroplasty: A retrospective, matched cohort study[J]. J Arthroplasty, 2016, 31(10): 2 229-2 302. |
| [14] | Tsai SJ, Wang CT, Jiang CC. The effect of posterior capsule repair upon post-operative hip dislocation following primary total hip arthroplasty[J]. BMC Musculoskelet Disord, 2008, 29: 1-7. |
| [15] |
康鹏德, 沈彬, 裴福兴, 等. 直接前方入路全髋关节置换术[J].
中华骨科杂志, 2016, 36(15): 1 002-1 008.
Kang PD, Shen B, Pei FX, et al. Direct anterior approach total hip arthroplasty[J]. Chinese Journal of Orthopaedics, 2016, 36(15): 1 002-1 008. |
| [16] | Lin TJ, Bendich I, Ha AS, et al. A comparison of radiographic outcomes after total hip arthroplasty between the posterior approach and direct anterior approach with intraoperative fluoroscopy[J]. The J Arthroplasty, 2017, 32(2): 616-623. DOI: 10.1016/j.arth.2016.07.046. |
 2018, Vol. 39
2018, Vol. 39


