膀胱癌(bladder carcinoma, BC)是泌尿系最常见的恶性肿瘤之一,肿瘤的复发和转移则是患者死亡的最主要原因,而肿瘤的侵袭和转移通常涉及到细胞信号通路的异常改变。整合素/黏着斑激酶(integrin/focal adhesion kinase, FAK)信号通路调控着肿瘤的细胞生物学过程[1]。黏着斑(focal adhesion plaque, FAP)是Integrin信号通路转导的结构基础,踝蛋白(Talin)作为FAP结构蛋白,桩蛋白(Paxillin)作为FAP调节蛋白,均参与了Integrin/FAK信号通路的信号转导过程。目前有关Talin和Paxillin在膀胱癌中的表达的研究较少,而在食管癌、大肠癌、乳腺癌、甲状腺癌等相关研究表明其与肿瘤的生物特性有明显的相关性。本文通过采用量子点免疫荧光组织化学方法来检测膀胱癌中Talin和Paxillin的表达及其相关性,探讨其在膀胱癌的进展中的作用。
1 资料与方法 1.1 资料收集选用2009-2012年在武汉大学人民医院经病理科确诊为膀胱尿路上皮癌(bladder urothelial carcinoma, BUC)的石蜡包埋组织62例,其中男性38例,女性24例,患者年龄在39-83岁,平均年龄62岁;另收集10例癌旁正常组织,均来源于全膀胱切除术时距肿瘤边缘3 cm及以上并经病理科证实为膀胱尿路上皮癌且取下的组织均为正常膀胱组织。患者术前均未采取任何放化疗。鼠抗人Talin单克隆抗体(TA205)购自美国Santa Cruz公司。量子点超敏荧光试剂盒购自武汉珈源量子点技术开发有限责任公司。
1.2 实验方法①4 μm石蜡切片于60 ℃烤箱中烤片过夜,依次脱蜡、水化,柠檬酸缓冲液高压修复,室温自然冷却,TBS洗涤(2 min×2);②滴加2%BSA,37 ℃湿盒封闭30 min,滴加一抗(TBS稀释,Talin 1:50)4 ℃过夜;③TBS-T洗涤(5 min×3),滴加生物素化羊抗鼠IgG (2%BSA稀释,1:300),37 ℃湿盒孵育30 min,TBS-T洗涤(5 min×3),滴加2%BSA,37 ℃湿盒封闭15 min;④滴加用量子点标记的链霉素亲和复合物QDs-SA605(2%BSA稀释,1:100), 37 ℃湿盒孵育30 min,先后TBS-T洗涤(5 min×3),TBS洗涤(5 min×2),待标本干后,缓冲甘油封片,4 ℃暗处保存。
1.3 判定标准将染色切片置于荧光显微镜下蓝光激发观察成像,Talin、Paxillin蛋白阳性表达均为胞质或胞膜出现橙红色荧光,组织背景自发绿色荧光为阴性表达。评判标准按荧光强度和阳性细胞占肿瘤细胞百分比评判:无阳性细胞(-),弱荧光强度或阳性细胞数<10%(+),强荧光强度或阳性细胞数占10%-80%(
采用SPSS 17.0统计软件分析实验数据,各组间比较采用行×列表χ2检验。以P<0.05为差异有统计学意义。
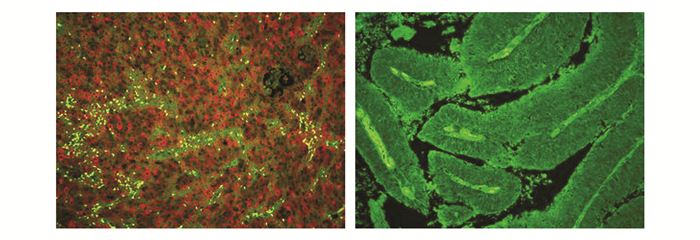
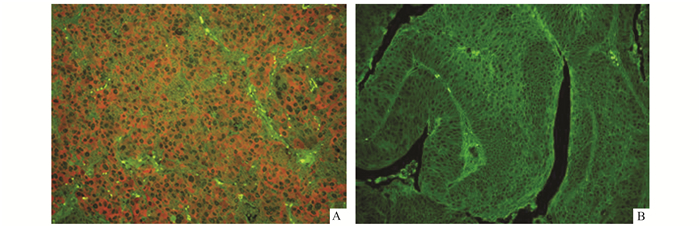
2 结果Talin、Paxillin蛋白均主要表达于癌细胞的胞膜和胞质。本实验中Talin蛋白的表达阳性率为56.45%(图 1),Paxillin蛋白的表达阳性率为51.61%(图 2),两者在癌旁正常组织均无表达。它们与膀胱尿路上皮癌的有无淋巴结转移、病理分级、临床分期有关(P<0.05),差异具有统计学意义;而与患者的性别、年龄、肿瘤大小与数目无明显相关(P>0.05),差异无统计学意义(表 1)。结果显示随着临床分期、分级的增高,病情的逐渐进展,Talin、paxillin蛋白的表达阳性率也增高,两者表达呈正相关(表 2)。
|
图 1 Talin在膀胱尿路上皮癌组织中的阳性及阴性表达(×200) |
|
图 2 Paxillin在膀胱尿路上皮癌组织中的阳性及阴性表达(×200) |
| 表 1 Talin和Paxillin在BUC中的表达及其与肿瘤临床病理特征的关系 |
| 表 2 膀胱尿路上皮癌中Talin和Paxillin表达的关系 |
肿瘤的复发、转移通常涉及到肿瘤细胞迁移、黏附能力的改变。Integrin/FAK通路是细胞内重要的信号传导通路,参与调节多种细胞功能,如细胞生长、增殖、迁移、凋亡等[2, 3]。FAP作为Integrin通路的结构基础,可促使信号从细胞外基质经Integrin途径向细胞内传递,其上存在多种细胞骨架蛋白,如Paxillin,Talin,Vinculin (纽蛋白)等。Paxillin是一种能与癌基因结合的含酪氨酸的磷酸化蛋白,其可与v-Src蛋白、v-Crk蛋白和BCR/ABL癌性融合蛋白等多种致瘤性蛋白结合, 干扰了控制细胞正常黏附、细胞增殖等的信号联级反应[4],因而,Paxillin的异常表达与肿瘤的发生、发展存在一定关系。Petit等[5]研究发现,奈良膀胱癌(NBT-Ⅱ)细胞的黏附、伸展与Paxillin的酪氨酸磷酸化有关,若将Paxillin中酪氨酸的31Y和118Y突变为苯丙氨酸并过表达,则细胞黏附和扩散就不会受其影响。Hagel等[6]证实Paxillin表达水平与细胞的迁移、黏附能力、形态等相关,当表达低下时,细胞形态变圆,细胞黏附能力下降,在培养基中扩散运动能力下降。由于肿瘤的浸润和转移与细胞的黏附、迁移能力的改变直接相关,因而Paxillin与肿瘤细胞的浸润和转移存在着一定的关系。本实验结果显示,Paxillin在膀胱癌旁正常组织中无表达,其表达水平与患者的性别、年龄、肿瘤大小与数目无明显相关,在62例膀胱癌组织中的阳性率为51.61%(32/62),且随着肿瘤的分期分级的增高,其表达水平升高。另外,在伴有淋巴结转移的膀胱癌中Paxillin表达的阳性率明显高于无淋巴结转移的膀胱癌。提示着膀胱肿瘤Paxillin的表达水平升高在膀胱肿瘤的复发、转移中起到了一定的作用,可能与Paxillin的过表达导致癌细胞的黏附能力下降、易于脱落转移有关。因而,Paxillin有可能成为膀胱肿瘤的预后、进展的分子标记物。
Talin是一种可与Integrin结合的细胞骨架蛋白,作为FAP结构蛋白,介于Integrin和细胞骨架肌动蛋白(Actin)之间,可将Actin连接到Integrin上,激活Integrin信号通路,调节细胞的迁移黏附能力,进而促进肿瘤的进展[7, 8]。相关研究表明,Talin与Integrin β1胞质区的结合是Integrin激活通路中最重要的一步,Talin调控着Integrin β1的活性水平,而活化的Integrinβ1能促进肿瘤细胞通过血管外渗和肝脏转移[9, 10]。Sakamoto等[11]研究发现,Talin明显促进前列腺癌细胞的侵袭、转移和抗失巢凋亡,Talin表达降低能使肿瘤的转移能力下降。本实验结果发现,Talin在BUC中表达的阳性率明显高于正常膀胱组织,其表达与肿瘤的分期、分级相关,随着肿瘤的分期分级的增高,其表达水平升高,且在伴有淋巴结转移的膀胱癌中Talin表达的阳性率明显高于无淋巴结转移的膀胱癌。提示Talin表达越高,患者预后越差。可能与Talin过表达导致Integrin β1活性升高有关,进而肿瘤细胞迁移、黏附能力增强,促进肿瘤发展。
通过采用Spearman等级相关分析BUC中Paxillin和Talin的表达,两者呈正相关。这可能与两者均为FAP组成分子,直接或间接参与了Integrin/ FAK信号通路传导的过程,且Paxillin募集到FAP需要Talin的参与有关。但具体作用机制尚不清楚,需要进一步研究。
上述研究提示,Paxillin和Talin的高表达可能促进膀胱肿瘤的复发、转移,与BUC的进展密切相关,联合检测两种蛋白有助于判断膀胱肿瘤的进展、恶性程度及提供一定的诊疗理论依据。
| [1] | Schober M, Fuchs E. Tumor-initiating stem cells of squamous cell carcinomas and their control by TGF-β and integrin/focal adhesion kinase (FAK) signaling[J]. PNAS USA, 2011, 108(26): 10. |
| [2] | Brakebusch C, Fassler R. Betal integrin function in vivo:adhesion, migration and more[J]. Cancer Metastasis Rev, 2005, 24(3): 403-411. DOI: 10.1007/s10555-005-5132-5. |
| [3] | Mitra SK, Hanson DA, Schlaepfor DD. Focal adhesion kinase:in command and control of cell motility[J]. Nat Rev Mol Cell Bid, 2005, 6(1): 56-68. DOI: 10.1038/nrm1549. |
| [4] | Smith MA, Blankman E, Deakin NO, et al. LIM domains target actin regulators paxillin and zyxin to sites of stress fiber strain[J]. PLoS One, 2013, 8(8): e69378. DOI: 10.1371/journal.pone.0069378. |
| [5] | Petit V, Boyer B, Lentz D, et al. Phosphorylation of tyrosine residues 31 and 118 on paxillin regulates cell migration through an association with CRK in NBT-II cells[J]. The Journal of Cell Biology, 2000, 148(5): 957-970. DOI: 10.1083/jcb.148.5.957. |
| [6] | Hagel M1, George EL, Kim A, et al. The adaptor protein paxillin is essential for normal development in the mouse and is a critical transducer of fibronectin signaling[J]. Molecular and Cellular Biology, 2002, 22(3): 901-915. DOI: 10.1128/MCB.22.3.901-915.2002. |
| [7] | Calderwood DA. Talin controls integrin activation[J]. Biochem Soc Trans, 2004, 32(3): 434-437. DOI: 10.1042/bst0320434. |
| [8] | Goksoy E, Ma YQ, Wang X, et al. Structural basis for the autoinhibition of talin in regulating integrin activation[J]. Mol Cell, 2008, 31(1): 124-133. DOI: 10.1016/j.molcel.2008.06.011. |
| [9] | Tadokoro S1, Shattil SJ, Eto K, et al. Talin binding to integrin beta tails:a final common step in integrin activation[J]. Science, 2003, 302(5 642): 103-106. |
| [10] | Kato H, Liao Z, Mitsios JV, et al. The primacy of 131 integrin activation in the metastatic cascade[J]. PLoS One, 2012, 7(10): e46576. DOI: 10.1371/journal.pone.0046576. |
| [11] | Sakamoto S, McCann RO, Dhir R, et al. Talinl promotes tumor invasion and metastasis via focal adhesion signaling and anoikis resistance[J]. Cancer Res, 2010, 70(5): 1 885-1 895. DOI: 10.1158/0008-5472.CAN-09-2833. |
 2016, Vol. 37
2016, Vol. 37

 ,
,