2. 北京世纪坛医院腹膜肿瘤科 北京 100038
2. Dept. of Surgical Oncology, Beijing Shijitan Hospital of the Capital Medical University, Beijing 100038, China
胃癌是世界范围内第四常见肿瘤,居癌症死因第三位[1]。包括手术、放疗和化疗在内的胃癌综合治疗策略在不断发展,但胃癌仍易出现不同形式、不同程度的侵袭和转移,包括血液转移、淋巴转移和腹腔播散转移。既往的肿瘤基础研究多立足于关键癌基因,癌细胞增生-凋亡的信号通路等,然而,越来越多的研究发现癌细胞与肿瘤微环境协同进化的重要性[2]。因此,充分理解微环境内相应成分对癌细胞的影响,有助于认识胃癌患者的不良预后[3, 4]。
在胃癌发生发展的进程中,微环境经历动态复杂的变化,包括肿瘤相关炎症反应和血管新生反应[2]。其中,最重要的一点即是炎性细胞的趋向聚集,尤其是巨噬细胞存在的重要作用。从血液或淋巴管迁移至癌巢的巨噬细胞成为肿瘤相关巨噬细胞(tumor-associated macrophages, TAM),在肿瘤发生发展的不同部位,TAM可以产生并释放不同的生长因子、细胞因子、趋化因子等,调节癌细胞的增殖、侵袭和转移[5]。所以,TAM的作用具有双重性质。此外,研究表明TAM对不同肿瘤患者的预后意义也存在差异[6, 7]。根据不同的研究结果,我们通过Meta分析来检验TAM与胃癌预后的关联。
1 资料与方法 1.1 检索策略由2名评价员检索英文公开发表的病例对照研究。计算机检索PubMed、EMbase、CBM数据库。检索时间均为建库至2016年2月1日。同时,手检纳入文献的参考文献。如试验报告不详或资料缺乏,与作者进行联系后尽量增加纳入文献资料。以PubMed为例,英文检索关键词为:“gastric cancer” or “gastric carcinoma” or “gastric neoplasm” or “Stomach Neoplasms” and “Macrophages” or “tumor-associated macrophage” or “tumor-infiltrating macrophage” or “intratumoral macrophage”。
1.2 文献纳入和排除标准以下条件用来评价是否纳入文献:①发表语言为英文;②组织病理学确诊为胃癌患者;③检测巨噬细胞的一抗均为抗-CD68;④均为研究TAM和总体生存期(overall survival, OS)或无病生存期(disease free survival, DFS)的病例对照研究;⑤高密度TAM同低密度TAM指标在评价胃癌患者预后时的风险比(hazard ratio, HR)值可从原始文献提取,包括直接获得或通过生存曲线获得近似值。
1.3 文献质量评价根据Newcastle-Ottawa Scale (NOS)量表[8]中的要求,从病例的选取、病例的可比性和预后的可比性三个方面,对纳入文献统计评分。NOS评分从0分到9分,其中>6分提示纳入研究质量高。
1.4 资料提取阅读全文后进行资料提取,由2位评价员独立完成,若遇争议则通过第3位评价员介入讨论。内容包括作者、发表年份、地区、种族、研究类型、研究人数(男/女比例)、平均年龄、胃癌患者的TNM分期、病理分型、生存期以及TAM的检测方法、HR值等。
1.5 统计分析Meta分析采用STATA软件(Version 12.0, Stata Corporation, College Station, TX, USA)进行。通过计算HR和95 % CI来评估TAM的预测价值。无法直接提取HR的文献,使用Engauge Digitizer软件(version 4.1, free software down-loaded from http://sourceforge.net)读取Kaplan-Meier生存曲线,导出相应的HR和95%CI值。若HR>1,提示TAM可作为胃癌不良预后的指标,若95%CI的范围不包括1,则提示该结果具有统计学意义。
使用Z检验评估HR的统计学意义。使用Q-检验和I2检验评估不同研究之间的异质性。通过亚组分析来探讨异质性的产生原因,敏感性分析评估纳入的单个研究对整体结果的影响,使用森林图和漏斗图评价发表偏倚,P < 0.05提示存在明显的发表偏倚。
2 结果 2.1 纳入研究的特征及质量评价结果初检英文文献451篇。最终纳入10篇合格文献[3, 4, 6, 7, 9-14],共930例受试者。纳入研究的一般情况及基线特征见表 1。纳入研究的发表时间从2003年至2014年,中位随访时间是38.28月到62月,胃癌患者Ⅰ/Ⅱ期比例约为43%。
| 表 1 纳入研究的一般情况 |
纳入7项研究,病例总数为710,其中>50%为亚洲人。纳入研究无异质性(I2=0, P < 0.001),采用固定效应模型分析。结果提示,TAM密度值与胃癌OS有相关性,即高密度TAM提示预后较差(HR=1.72, 95%CI=1.30-2.13, P < 0.001)(图 1)。
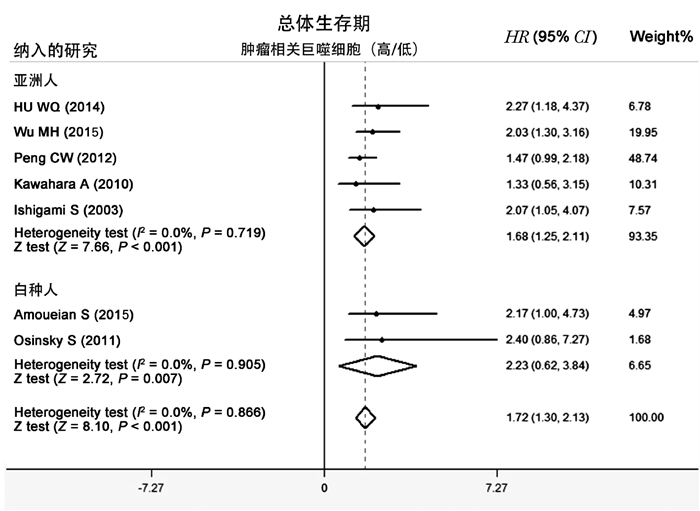
|
图 1 TAM与胃癌OS的Meta分析 |
纳入4项研究,病例总数为404例。纳入的研究存在异质性(I2=70.3 %, P=0.018),采用随机效应模型。结果提示,TAM密度值与胃癌DFS的关联意义不大(HR=1.10, 95%CI=0.16-2.03, P=0.022),即TAM不能提示胃癌DFS长短(图 2)。
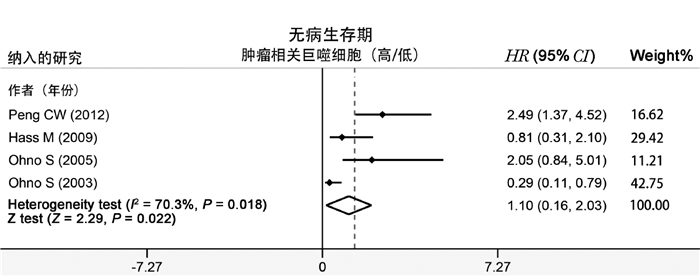
|
图 2 TAM与胃癌DFS的Meta分析 |
STATA软件绘制的漏斗图结果提示(图 3),TAM与胃癌OS关联性研究中不存在明显的发表偏倚(P=0.913)。Egger’s检验提示不存在明显的发表偏倚(t=0.52, P=0.619)。
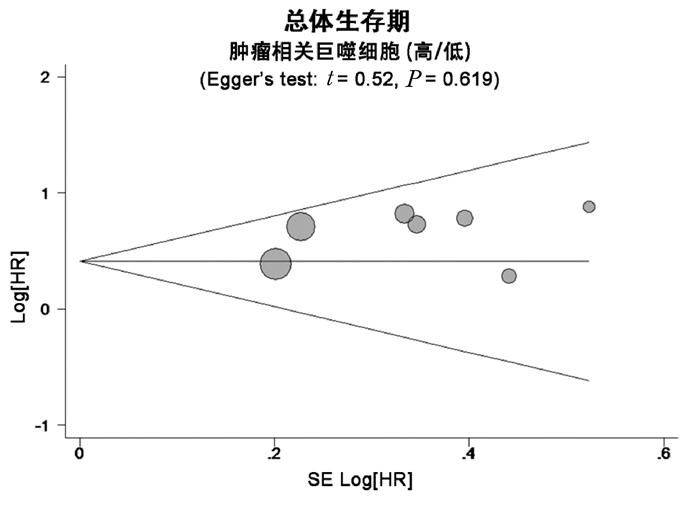
|
图 3 TAM与胃癌OS的漏斗图分析 |
TAM在胃癌发生发展过程中起双向调节作用[5]。一方面,TAM吞噬杀伤癌细胞,起到抗肿瘤作用;另一方面,TAM发生表型转变,从M1型转化为M2型[15],参与癌细胞的免疫逃逸、细胞外基质的重塑改造以及肿瘤血管的新生,促进肿瘤发展[16]。在肿瘤侵袭部位,TAM促进癌细胞的迁移侵袭能力;在肿瘤基质和血管周围,TAM促进癌转移;在缺少血管及坏死缺氧区域,TAM会促进血管新生[5]。
TAM密度与胃癌预后的关联性研究存在不同的结论,因此有必要通过Meta分析对既往研究进行汇总和定量分析。本文纳入10例研究,通过分析HR提示TAM的密度值与胃癌OS存在关联,高TAM值提示总体生存差。TAM与胃癌DFS相关性研究的纳入文献(n=4)数较少,异质性较大,95%CI的范围包括HR=1,目前尚不能认为高TAM提示较差的DFS。因此,本研究提示TAM可以作为胃癌OS的预后标志物。
本文的研究存在一些优势,首先,本文全面检索并分析,再者,纳入研究的数据包括亚洲人和白种人在内,所以荟萃分析的结果适用于东西方国家,同时,检测巨噬细胞的一抗均为抗-CD68,避免产生较大的异质性,结果分析更为可靠。然而,本文也存在一些缺陷。关于胃癌患者总体生存与TAM的研究仅有7个,相对来说,原始数据来源较少。同时,Meta分析是回顾性研究,是对已发表文献的二次分析,无法规避发表偏倚的存在。
总之,TAM可以作为胃癌OS的预后指标。今后需要更为全面和更具代表性的Meta分析进一步探讨TAM与胃癌预后的关系。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61: 69-90. DOI: 10.3322/caac.v61:2. |
| [2] | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144: 646-674. DOI: 10.1016/j.cell.2011.02.013. |
| [3] | Peng CW, Tian Q, Yang GF, et al. Quantum-dots based simultaneous detection of multiple biomarkers of tumor stromal features to predict clinical outcomes in gastric cancer[J]. Biomaterials, 2012, 33: 5742-5752. DOI: 10.1016/j.biomaterials.2012.04.034. |
| [4] | Hu WQ, Fang M, Zhao HL, et al. Tumor invasion unit in gastric cancer revealed by QDs-based in situ molecular imaging and multispectral analysis[J]. Biomaterials, 2014, 35: 4125-4132. DOI: 10.1016/j.biomaterials.2014.01.059. |
| [5] | Lewis CE, Pollard JW. Distinct role of macrophages in different tumor microenvironments[J]. Cancer Res, 2006, 66: 605-612. DOI: 10.1158/0008-5472.CAN-05-4005. |
| [6] | Ishigami S, Natsugoe S, Tokuda K, et al. Tumor-associated macrophage (TAM) infiltration in gastric cancer[J]. Anticancer Res, 2003, 23: 4079-4083. |
| [7] | Wu MH, Lee WJ, Hua KT, et al. Macrophage infiltration induces gastric cancer invasiveness by activating the β-catenin pathway[J]. PLoS One, 2015, 10: e0134122. DOI: 10.1371/journal.pone.0134122. |
| [8] | Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidemiol, 2010, 25: 603-605. DOI: 10.1007/s10654-010-9491-z. |
| [9] | Amoueian S, Attaranzadeh A, Montazer M. Intratumoral CD68-, CD117-, CD56-, and CD1a-positive immune cells and the survival of Iranian patients with non-metastatic intestinal-type gastric carcinoma[J]. Pathol Res Pract, 2015, 211: 326-331. DOI: 10.1016/j.prp.2014.12.013. |
| [10] | Kawahara A, Hattori S, Akiba J, et al. Infiltration of thymidine phosphorylase-positive macrophages is closely associated with tumor angiogenesis and survival in intestinal type gastric cancer[J]. Oncol Rep, 2010, 24: 405-415. |
| [11] | Ohno S, Inagawa H, Dhar DK, et al. Role of tumor-associated macrophages (TAM) in advanced gastric carcinoma: the impact on FasL-mediated counterattack[J]. Anticancer Res, 2005, 25: 463-470. |
| [12] | Ohno S, Inagawa H, Dhar DK, et al. The degree of macrophage infiltration into the cancer cell nest is a significant predictor of survival in gastric cancer patients[J]. Anticancer Res, 2003, 23: 5015-5022. |
| [13] | Haas M, Dimmler A, Hohenberger W, et al. Stromal regulatory T-cells are associated with a favourable prognosis in gastric cancer of the cardia[J]. BMC Gastroenterol, 2009, 9: 65. DOI: 10.1186/1471-230X-9-65. |
| [14] | Osinsky S, Bubnovskaya L, Ganusevich I, et al. Hypoxia, tumour-associated macrophages, microvessel density, VEGF and matrix metalloproteinases in human gastric cancer: interaction and impact on survival[J]. Clin Transl Oncol, 2011, 13: 133-138. DOI: 10.1007/s12094-011-0630-0. |
| [15] | Liu XY, Miao ZF, Zhao TT, et al. Milky spot macrophages remodeled by gastric cancer cells promote peritoneal mesothelial cell injury[J]. Biochem Biophys Res Commun, 2013, 439: 378-383. DOI: 10.1016/j.bbrc.2013.08.073. |
| [16] | Siveen KS, Kuttan G. Role of macrophages in tumour progression[J]. Immunol Lett, 2009, 123: 97-102. DOI: 10.1016/j.imlet.2009.02.011. |
 2017, Vol. 38
2017, Vol. 38

