2. 武汉大学基础医学院生物医学工程系 湖北 武汉 430071
2. Dept. of Biomedical Engineering, School of Basic Medical Sciences, Wuhan University, Wuhan 430071, China
肝细胞癌、肝血管瘤与肝转移瘤为肝脏最常见占位性病变。尽管在常规磁共振成像(magnetic resonance imaging, MRI)、计算机断层扫描(computed tomography, CT)平扫和增强上有各自不同特点,但约有16%-30%的非典型肝血管瘤由于影像表现缺乏特征性,容易误诊为肝癌或肝转移瘤[1],鉴别诊断困难。不仅如此,临床上也常会遇到造影剂过敏或肾功能不全、不适宜进行增强扫描患者,在非增强情况下鉴别诊断更加困难。目前,MRI使用越来越普及,且肝脏扩散加权成像(diffusion weighted imaging, DWI)表观扩散系数(apparent diffusion coefficient, ADC)值在其良恶性肿瘤的比较中存在明显差异,但仍有重叠。随着磁共振技术发展,一种崭新的基于非高斯分布高b值扩散加权成像技术即扩散峰度成像技术(diffusion kurtosis imaging, DKI)逐渐应用于临床,能够提供特有的诊断信息。DKI在中枢神经系统应用较多,但在肝脏中应用鲜有报道。本研究旨在探讨DKI定量参数在鉴别肝脏占位性病变中的应用价值,尤其针对不能行CT和MRI增强扫描或非典型血管瘤难以鉴别时的患者。
1 材料与方法 1.1 临床资料回顾性分析我院2015年12月至2016年6月行肝脏MRI平扫及增强,DWI和DKI检查资料完整的患者。所有患者均经手术病理(49例)和临床综合诊断(20例)为肝癌、肝转移瘤、肝血管瘤。其排除标准为:①呼吸配合不佳导致图像伪影大,无法满足诊断要求患者;②弥漫性肝癌患者;③检查前经过各自治疗后患者。共收集100例,满足诊断要求和标准病例69例,其中肝癌24例,男16例,女8例,平均年龄56岁;肝转移瘤33例,男21例,女12例,平均年龄55岁;肝血管瘤12例,男8例,女4例,平均年龄50岁。
1.2 检查方法所有受试患者检查前空腹4-6 h,常规平扫后行DKI扫描和增强扫描。DKI扫描参数:采用单次激发自旋回波的平面回波序列,TR4 700 ms,TE 57 ms;层厚5 mm,层间距1 mm;矩阵128×128,FOV 330 mm;采用5个b值:200, 500, 1 000, 1 500, 2 000 s/mm2,每个b值平均次数分别为1、3、3、3、3,扫描时间约3 min 17 s;自由平静呼吸。
1.3 图像分析多发病灶病例勾画最大病灶及邻近上下两层各3层,获取以下参数平均值(x±s表示):ADC,表观扩散峰度(apparent kurtosis, K)以及真实扩散系数(true diffusion, D)。使用Matlab 2013b版(MathWorks)中编程的内部软件拟合计算ADC,D和K值,其拟合公式为[2]:
S=S0×exp(-b×D + b2×D2×K/6)。(K是表观扩散峰度,与单指数拟合相比,K能反映病变组织的复杂程度。D是真实ADC值,S0是当b=0 s/mm2时信号强度,b是扩散敏感梯度)。
1.4 统计学分析采用SPSS 19.0统计学软件(IBM公司)。方差分析比较肝癌、肝转移瘤与及肝血管瘤三组病灶间ADC值、D值、K值,统计分析前对数据进行正态性检验及方差齐性检验。若方差齐则用最小显著差异法(LSD)检验,方差不齐用Dunnett’s T3检验,P<0.05视为差异有统计学意义。对有差异的参数,进行受试者操作特征曲线(ROC curve),对其诊断效能及阈值进行分析。
2 结果 2.1 3组病例各参数值之间比较3组病例中,肝癌与肝血管瘤、肝转移瘤与肝血管瘤的ADC值、D值、K值两两比较P值均小于0.05,有统计学意义。肝癌与肝转移瘤的ADC值、D值、K值差异均无统计学意义(表 1-3)。典型病例的DKI及DWI照片见图 1-12。
| 表 1 肝癌与肝转移瘤各DKI参数之间的比较结果 |
| 表 1 肝癌与肝血管瘤各DKI参数之间的比较结果 |
| 表 3 肝转移瘤与肝血管瘤各DKI参数之间的比较结果 |

|
图 1-12 肝脏占位性病变的DKI及DWI照片 图 1-4为同一肝右叶巨快型肝癌患者ADC、D、K值伪彩图及DWI图;图 5-8为同一肝转移瘤患者ADC、D、K值伪彩图及DWI图;图 9-12为同一血管瘤患者ADC、D、K值伪彩图及DWI图。图中圆圈为ROI选取方法示意图 |
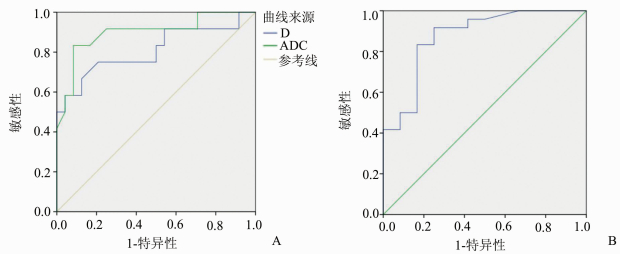
肝癌/肝血管瘤的D值、ADC值、K值ROC曲线见图 13。肝转移瘤/肝血管瘤的D值、ADC值、K值ROC曲线见图 14。其诊断效能见表 4,5。其中D值与K值ROC曲线下面积(AUC)均大于0.8。在肝癌与肝血管瘤的鉴别中K值的敏感性最高,为91.7%;ADC值的特异性最高,为91.7%。在肝转移瘤与肝血管瘤的鉴别诊断中同样是K值敏感性最高,为81.8%;ADC值的特异性最高,为84.8%。
|
图 13 肝癌/肝血管瘤D值,ADC,K值ROC曲线 A: ADC值、D值ROC曲线图; B: K值ROC曲线图 |

|
图 14 肝转移瘤/肝血管瘤D值,ADC值,K值ROC曲线 A: ADC值、D值ROC曲线图; B: K值ROC曲线图 |
| 表 4 DKI参数区分肝癌与肝血管瘤效能 |
| 表 5 DKI参数区分肝转移瘤与肝血管瘤效能 |
MRI对于肝脏占位性病变检出率较高,早期对肝脏良恶性肿瘤MRI研究主要局限性在常规T1WI、T2WI序列,既往有发现T2WI序列与肿瘤血流动力学及组织学分级有显著关联性[3]。在诊断中,T2WI信号对于鉴别肝癌、肝转移瘤以及肝血管瘤有一定价值。但是,由于MRI成像技术复杂,在图像采集过程中容易出现多种伪影,对MR信号造成干扰,单纯依靠T2WI信号对非典型血管瘤的鉴别诊断,结果存在偏差。增强检查对于肝癌,肝转移瘤以及肝血管瘤鉴别有重要价值,但有约16%-30%的非典型肝血管瘤即使增强检查也缺乏特征性影像征象;且部分患者因肾功能受损或造影剂过敏并不适宜增强检查,对于上述病变,尤其是富血管性病变鉴别困难。常规DWI是基于单指数扩散模型,不能反映肝癌、肝转移瘤、非典型肝血管瘤结构复杂性程度。Jensen等人[4]在2005年提出DKI模型其目的是为了定量评估水分子扩散偏离高斯分布的程度,能更好地映组织微观结构对水分子扩散的影响。这为肝癌、肝转移瘤、非典型血管瘤在不增强情况下的鉴别提供了新的解决方案。
在运用DKI技术时,关键在于采集高信噪比(SNR)高b值图像以准确计算DKI各参数,否则信号强度(signal intensity,SI)衰减图易受“本底噪声”影响。伪影会影响SI信号衰减图曲率,造成K值偏移。体部成像本身就易受到呼吸运动影响,为了获得高b值的高SNR图像,难度很大。采集过程中采用呼吸补偿和导航技术可以减少运动伪影。后期图像处理时应用非刚性运动校正是非常必要。有时还需要降低分辨率、增加平均次数来提高信噪比。另外TE降低也能提升SNR,并且获得较好空间分辨率[5]。即便如此,噪声仍是获得好高b值图像最大难题。DKI序列也不是b值数目越多越好。以前研究表明至少有三个不同b值和至少15个不同扩散梯度方向才能完全表征各向异性组织方向依赖性,如脑白质[2]。实际上,针对脑部疾病和异常的研究通常使用3-6个b值和15-30个扩散梯度方向超过10 min的扫描时间[6, 7]。最近研究表明DKI对前列腺成像新应用,前列腺不像人脑被认为是各向异性组织[8]。作者对于DKI的5个b值为0, 500, 1 000, 1 500和2 000 s/mm2,3个正交运动探测梯度方向。据报道,用平均峰度鉴别肿瘤良恶性敏感性明显高于ADC值(分别为93.3%和78.5%)。我们对肝脏DKI的研究也使用了5个b值和3个运动探测梯度方向,其5个b值分别为200, 500, 1 000, 1 500, 2 000 s/mm2,本研究不选取200以下b值是为了尽量避免低b值微循环灌注效应对扩散影响,较真实反映高b值的扩散效应的价值。
Jensen等[4]报道人脑组织中平均峰度值和ADC之间相关性不强,认为DKI可以提供与DWI相比更丰富信息。肝癌、肝转移瘤及肝血管瘤病灶呈高信号,且随b值增高,病灶信号不衰减或轻微衰减。本研究中,肝癌和肝转移瘤ADC值、D值均低于肝血管瘤,而肝癌和肝转移瘤K值相反较高。且肝癌和肝转移瘤ADC值、D值、K值与肝血管瘤比较均有统计学意义。然而肝癌与肝转移瘤之间差异无显著性。ADC值和K值之间结果差异可能由于ADC和K测量复杂多因素过程(如扩散、灌注和组织纤维化)等。肝血管瘤富含血窦,血容量较大,而肝细胞癌组织结构紊乱,血管壁不完整,通透性增加,血液外渗,因而毛细血管内血容量较少。另外,肝癌和肝转移瘤病灶D值均高于肝实质和肝血管瘤,提示恶性肿瘤组织内水分子扩散受限更为明显。
本研究还发现不同参数在诊断肝癌、肝转移瘤和肝血管瘤上诊断效能存在显著性差别。其中K值在诊断肝癌与肝血管瘤、肝转移瘤与肝血管瘤的敏感性分别高达91.7%和81.8%。表明在肝癌和肝血管瘤、肝转移瘤和肝血管瘤的鉴别诊断上高b值优势更大,取代CT或MRI增强检查。然而肝癌与肝转移瘤的三个参数间均无统计学差异,其诊断效能有限。提示两者之间细胞微成分相同或相似,而结构复杂性比肝血管瘤更复杂。但是在诊断肝癌与肝血管瘤、肝转移瘤与肝血管瘤的特异性上,K值特异性反而不如ADC值和D值特异性,可能是因为肝癌、肝转移瘤和肝血管瘤三者之间虽然细胞微环境复杂程度不一样,但是还是有一部分相似结构存在。因此,可以在各向异性分数(FA)、扩散峰度各向异性分数(FAK)、轴向扩散峰度(Ka)和径向扩散峰度(Kr)等方面做更进一步的研究,以期在非增强情况下对肝癌、肝转移和肝血管瘤做出准确鉴别。
尽管如此,本研究存在一些局限性。首先,本研究使用单个MRI系统在单一机构进行,缺乏多种成像参数多中心试验研究。另外,尽管我们修改了b值(≤2 000 s/mm2)和梯度方向的数量来压缩采集时间,但最近的一项离体报告[9]报道了高b值(≤3 500 s/mm2)扩散成像数据在慢性肝病评估的拉伸指数和扩散峰度模型中的有用性,因此,应建立标准化协议。其次,我们在本研究中并不是所有病变均获得组织病理学结果,具有明确组织病理学相关性研究有助于研究K值与微结构复杂度之间的关系。
总之,肝脏DKI能提供肝内占位性病变额外信息,可以替代影像学增强检查;提高对肝癌与肝血管瘤、肝转移瘤与肝血管瘤鉴别诊断效能。
| [1] |
史凤霞, 刘建滨, 郭一清. VIBE技术结合磁共振扩散加权成像对不典型肝血管瘤和肝细胞癌的鉴别诊断价值[J].
中国CT和MRI杂志, 2015, 13(3): 56-59.
Shi FX, Liu JB, Guo YQ. Study of diagnostic values of VIBE technology combined with magnetic resonance imaging diffusion-weighted imaging in atypical liver hemangioma and hepatocellulr carcinoma[J]. Chinese Journal of CT and MRI, 2015, 13(3): 56-59. |
| [2] | Jensen JH, Helpern JA. MRI quantifcation of non-Gaussian water diffusion by kurtosis analysis[J]. NMR Biomed, 2010, 23(7): 698-710. DOI: 10.1002/nbm.1518. |
| [3] | Shinmura R, Matsui O, Kobayashi S, et al. Cirrhotic nodules: association between MR imaging signal intensity andintranodular blood supply[J]. Radiology, 2005, 237(2): 512-519. DOI: 10.1148/radiol.2372041389. |
| [4] | Jensen JH, Helpern JA, Ramani A, et al. Diffusional kurtosis imaging: the quantifcation of non-gaussian water diffusion by means of magnetic resonance imaging[J]. Magn Reson Med, 2005, 53(6): 1 432-1440. DOI: 10.1002/(ISSN)1522-2594. |
| [5] |
王科, 潘婷, 周欣, 等. 基于非高斯分布模型的扩散加权成像在体部疾病中的应用[J].
磁共振成像, 2016, 7(1): 71-76.
Wang K, Pan T, Zhou X, et al. The application of non-gaussion DWI model in body diseases[J]. Chinese Journal of Magnetic Resonance Imaging, 2016, 7(1): 71-76. |
| [6] | Wang JJ, Lin WY, Lu CS, et al. Parkinson disease:diagnostic utility of diffusion kurtosis imaging[J]. Radiology, 2011, 261(1): 210-217. DOI: 10.1148/radiol.11102277. |
| [7] | Raab P, Hattingen E, Franz K, et al. Cerebral gliomas: diffusional kurtosis imaging analysis of microstructural differences[J]. Radiology, 2010, 254(3): 876-881. DOI: 10.1148/radiol.09090819. |
| [8] | Rosenkrantz AB, Sigmund EE, Johnson G, et al. Prostate cancer: feasibility and preliminary experience of a diffusional kurtosis model for detection and assessment of aggressiveness of peripheral zone cancer[J]. Radiology, 2012, 264(1): 126-135. DOI: 10.1148/radiol.12112290. |
| [9] | Anderson SW, Barry B, Soto J, et al. Characterizing non-gaussian, high b-value diffusion in liver fibrosis: stretched exponential and diffusional kurtosis modeling[J]. J Magn Reson Imaging, 2014, 39(4): 827-834. DOI: 10.1002/jmri.24234. |
 2018, Vol. 39
2018, Vol. 39


