2. 北京世纪坛医院腹膜肿瘤科 北京 100038
2. Dept. of Surgical Oncology, Beijing Shijitan Hospital of the Capital Medical University, Beijing 100038, China
近年研究发现,肿瘤相关成纤维细胞(carcinoma associated fibroblasts,CAFs)作为肿瘤微环境中的主要成分,通过分泌各种细胞因子和蛋白酶等参与了肿瘤细胞的生长、浸润和转移等多种生物学行为的调节[1]。成纤维细胞激活蛋白(fibroblast activation protein, FAP)是新近发现的一种促肿瘤生长因子,它特异性表达于CAFs,通过发挥蛋白酶水解作用,促进肿瘤细胞生长和浸润,同时它也可以促进肿瘤内皮细胞增殖和新生血管的生成,加速肿瘤细胞的远处转移[2, 3]。目前FAP在肿瘤发生中的具体作用机制尚不完全明了,而且FAP与胃癌生物学行为及预后的关系尚存在一定争议。因此,本文主要通过研究FAP在胃癌中的表达情况以探索FAP表达与胃癌生物学行为和预后的关系,为胃癌的临床诊治和预后判断提供理论依据。
1 资料与方法 1.1 一般资料选取2009年2月至2011年4月在我院就诊的胃癌患者作为研究对象,收集术后胃癌手术切除标本60例,并选取距肿瘤>5 cm的正常胃组织作为对照。其中男35例,女25例,年龄38-73(52.5±10.2)岁。根据2010年国际抗癌联盟(UICC)制定的TNM分期标准进行临床分期,Ⅰ期12例,Ⅱ期13例,Ⅲ期27例,Ⅳ期8例。所有患者术前均未接受过任何放化疗或分子靶向治疗,所有标本经10%多聚甲醛固定,石蜡包埋后4 μm切片,常规行HE染色普通镜检。
1.2 方法常规脱水及石蜡包埋,连续切片厚度约4 μm做免疫组化染色。采用链霉菌抗生物素蛋白-过氧化物酶连接法(SP法)进行免疫组织化学染色。3%过氧化氢(H2O2)溶液在室温下作用10 min,然后在非免疫血清室温孵育10 min;试剂FAP兔抗人一抗(效价1:200,Santa Cruz公司)4 ℃孵育过夜;生物素标记的二抗孵育20 min;DAB显色5 min,PBS终止反应;苏木素复染、乙醇梯度脱水和二甲苯透明,中性树胶封固。
1.2.1 FAP阳性计数FAP表达于肿瘤间质CAFs的细胞质中,为棕黄色染色。每张切片在低倍视野下选取5个阳性细胞密集区,分别于400倍视野下计数100个CAFs细胞中的FAP阳性表达比例,计数标本的x±s。
1.2.2 免疫组化(IHC)常规组织连续切片4 μm厚、裱片、烘烤,HE染色与免疫组化染色。IHC具体步骤如下:室温下用3% H2O2孵育15 min,消除内源性过氧化物酶。每张切片用2% BSA 37 ℃封闭30 min,防止抗原与抗体非特异性结合。然后倾去BSA,滴加鼠抗人FAP一抗,37 ℃孵育2 h,然后用PBS冲洗3次,每次5 min,滴加相应二抗,37 ℃孵育15 min,最后用过氧化物酶标记的链霉素孵育15 min。再用PBS冲洗3次,每次5 min。每张切片滴加新鲜配制的DAB溶液显色,镜下观察显色反应,显色适度时终止反应。自来水充分冲洗,用苏木素复染,盐酸乙醇分化,封片。阴性对照组的一抗用PBS替代。
1.2.3 图像观察图像采集系统为Olympus BX51荧光显微镜,配备Olympus DP72照相机(Olympus Optical Co., Ltd., Tokyo, Japan)。在显微镜明场下,分别于“×10”、“×20”、“×40”视野观察切片并拍照。
1.2.4 统计学处理所有数据均用均数±标准差(x±s)表示, SPSS 16.0统计软件分析, 配对资料间的比较采用配对t检验。生存分析采用Kaplan-Meier分析, 组间比较采用Log-rank法。两组间比较用Mann-Whitney U test法,三组间比较采用Kruskall-Wallis test法。当P < 0.05时表示差异有统计学意义。
2 结果 2.1 胃癌组织与正常胃组织中FAP阳性细胞计数FAP在肿瘤间质成纤维细胞胞质内阳性表达,呈棕黄色或浅黄色。60例胃癌组织中FAP阳性表达率在91.7%(55例)。FAP在正常胃组织和肿瘤细胞中基本上无明显表达。60例胃癌组织与60例正常胃组织中FAP阳性细胞数平均值分别为32.80±19.3和0.41±0.21,差异具有统计学意义(P < 0.01)。
2.2 胃癌组织中FAP表达与临床病理参数的关系胃癌组织中FAP的表达水平与肿瘤的大小、分化程度及临床分期明显相关(P < 0.05)。肿瘤直径越大、分化程度越低、分期越晚的癌组织中FAP表达水平越高。癌组织中FAP表达水平与患者性别、年龄、吸烟状况无明显统计学差异(P > 0.05)(表 1)。
| 表 1 FAP的表达与胃癌患者临床病理特征的关系 |
镜下观察显示胃癌组织内FAP染色结果为阳性,其表达主要位于胞质或胞膜。FAP在胃癌间质内少量表达,主要位于胃癌间质中靠近肿瘤血管内皮细胞处,该表达特征需要进一步研究,推测FAP与癌细胞黏附血管内皮具有相关性。FAP虽然在胃癌的表达具有普遍性,但不同分化程度的胃癌组织内FAP表达量无明显差异,提示FAP与胃癌恶性程度的关联意义不大(图 1)。
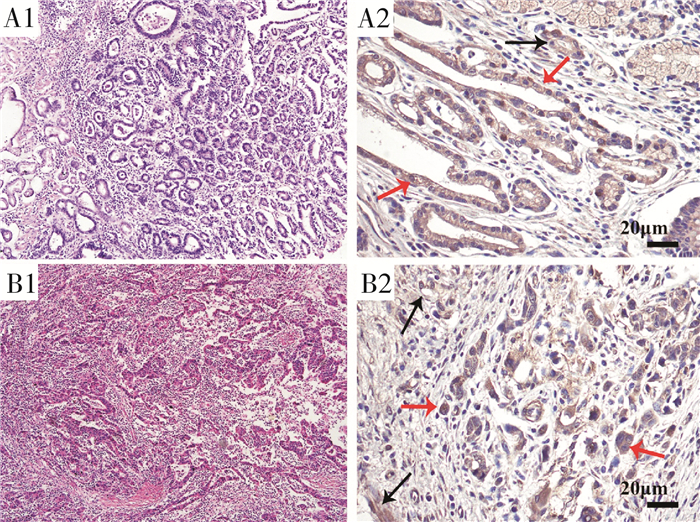
|
图 1 胃癌组织切片HE染色和FAP免疫组化染色 A1+B1(×100):胃癌组织HE染色;A1+A2:中-高分化胃腺癌;B1+B2:中-低分化肠型腺癌;A2+B2(×200):免疫组化染色结果示FAP主要表达于胃癌细胞的胞质和胞膜,FAP在间质内主要表达于靠近肿瘤血管内皮细胞处;红色箭头指示癌组织内FAP染色阳性部位,蓝色箭头指示间质内FAP的表达。 |
60例患者中有3例患者失访,所有患者按照FAP阳性细胞数平均值为(32.80±19.3)%,分为低表达组和高表达组。Kaplan-Meier分析显示FAP低表达组胃癌患者术后的生存时间明显高于高表达组,差异有显著统计学意义(P < 0.05)。FAP高表达组和低表达组的中位生存时间分别为30.2和37.8月(图 2)。
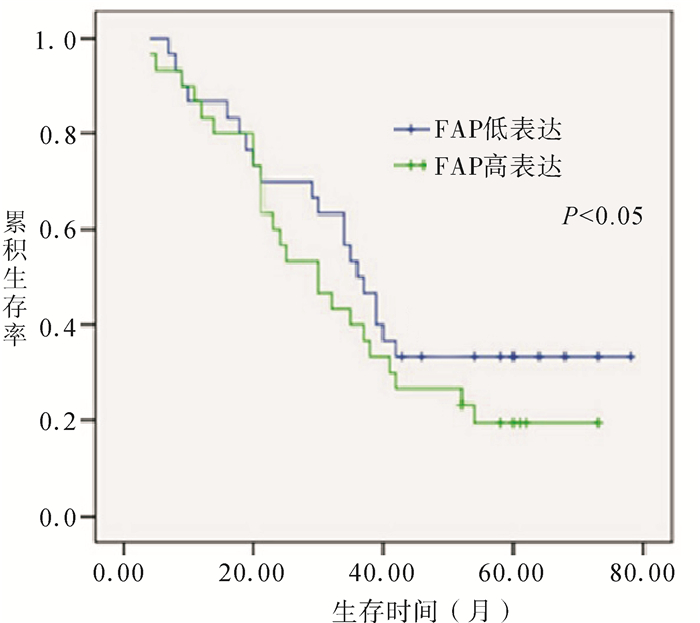
|
图 2 FAP的表达与胃癌患者预后的关系 |
胃癌是我国发病率和死亡率最高的恶性肿瘤之一。这是由于胃癌的早期诊断困难,大多数胃癌患者确诊时已经属中晚期,失去手术机会,放化疗疗效不佳。因此,寻找一种有效的早期诊断、指导治疗和预后的分子标志物具有极其重要的临床价值。近年研究发现,特异性表达与肿瘤相关成纤维细胞中的FAP在肿瘤的发生、浸润和转移等一系列过程中发挥重要作用[2]。FAP是CAFs的特异性标志物之一,在肿瘤间质中呈高度特异性表达[4];在肿瘤的早期诊断、预后判定和治疗中的应用有重要价值,已成为近年研究热点。
FAP是在1986年由Retting等用单克隆抗体F19 (用肺成纤维细胞免疫小鼠获得)在培养的成纤维细胞上识别的一种细胞表面抗原,所以最初被称为F19抗原[5]。FAP存在于多种恶性上皮性肿瘤的间质(如肺癌、乳腺癌、肠癌及胃癌等)和活化的成纤维细胞膜上,而在良性肿瘤间质及正常成人静息的成纤维细胞中不表达[6]。这提示了FAP是一个增生的成纤维细胞标志物,与恶性肿瘤的生物学行为可能有关。FAP的生物学特性研究发现,FAP是一种丝氨酸肽酶,在细胞表面发挥着蛋白水解酶活性,它在降解细胞外基质组份中发挥着至关重要的作用,对肿瘤浸润、血管生成和转移起到很好的促进作用[2]。其机制可能是FAP通过直接或间接溶解与毗邻的细胞外基质和参与肿瘤微血管生成[1],从而发挥上述作用。
近年来,在多种实体瘤间质中发现FAP的表达,FAP的表达水平与肿瘤的增生、侵袭和转移生物学行为明显相关。在肠癌手术标本及肠癌小鼠移植瘤模型中,发现90%以上的标本表达FAP,且其表达水平与肿瘤的浸润深度、大小、淋巴结转移明显相关,同时高表达FAP患者的总生存时间明显下降[7]。同样,在胃癌患者肿瘤间质细胞中,FAP也呈高表达,另外还发现,FAP在恶性程度高的硬癌中的表达水平明显高于其他组织类型[8]。Wang等发现FAP在胃癌间质中高表达,并且通过小干扰RNA敲除FAP表达基因,可以明显抑制肿瘤细胞的转移,这说明FAP的表达水平与胃癌的远处转移和淋巴结转移相关[8, 9]。本研究与Wang的研究结果一致,发现FAP在胃癌间质中大量表达,另外本研究还发现,FAP的表达与肿瘤的分化、大小、远处转移和临床分期明显相关,且首次发现胃癌间质中FAP的表达水平与胃癌的预后呈负相关,这为以后胃癌预后判断提供重要理论依据。
总之,我们的研究表明FAP表达与胃癌的肿瘤大小、分化程度、TNM分期和预后明显相关。FAP所具有的酶活性使其在肿瘤中的生长、侵袭和转移中发挥着重要作用,并使它成为肿瘤诊断、预后判断和治疗的一个新的潜在靶点。
| [1] | Albrengues J, Meneguzzi G, Gaggioli C. Carcinoma-associated fibroblasts in cancer: the great escape[J]. Med Sci (Paris), 2014, 30(4): 391-397. DOI: 10.1051/medsci/20143004012. |
| [2] | Fearon DT. The carcinoma-associated fibroblast expressing fibroblast activation protein and escape from immune surveillance[J]. Cancer Immunol Res, 2014, 2(3): 187-193. DOI: 10.1158/2326-6066.CIR-14-0002. |
| [3] | Jia CC, Wang TT, Liu W, et al. Cancer-associated fibroblasts from hepatocellular carcinoma promote malignant cell proliferation by HGF secretion[J]. PLoS One, 2013, 8(5): e63243. DOI: 10.1371/journal.pone.0063243. |
| [4] | Tchou J, Conejo-Garcia J. Fibroblast activation protein, a potential diagnostic and therapeutic target for cancer-reply[J]. Hum Pathol, 2014, 45(7): 1553-1554. |
| [5] | Rettig WJ, Chesa PG, Beresford HR, et al. Differential expression of cell surface antigens and glial fibrillary acidic protein in human astrocytoma subsets[J]. Cancer Res, 1986, 46(12pt1): 6406-6412. |
| [6] | Brennen WN, Isaacs JT, Denmeade SR. Rationale behind targeting fibroblast activation protein-expressing carcinoma-associated fibroblasts as a novel chemotherapeutic strategy[J]. Mol Cancer Ther, 2012, 11(2): 257-266. DOI: 10.1158/1535-7163.MCT-11-0340. |
| [7] | Wikberg ML, Edin S, Lundberg IV, et al. High intratumoral expression of fibroblast activation protein (FAP) in colon cancer is associated with poorer patient prognosis[J]. Tumour Biol, 2013, 34(2): 1013-1020. DOI: 10.1007/s13277-012-0638-2. |
| [8] | Wang RF, Zhang LH, Shan LH, et al. Effects of the fibroblast activation protein on the invasion and migration of gastric cancer[J]. Exp Mol Pathol, 2013, 95(3): 350-356. DOI: 10.1016/j.yexmp.2013.10.008. |
| [9] | Shan LH, Sun WG, Han W, et al. Roles of fibroblasts from the interface zone in invasion, migration, proliferation and apoptosis of gastric adenocarcinoma[J]. J Clin Pathol, 2012, 65(10): 888-895. DOI: 10.1136/jclinpath-2012-200909. |
 2016, Vol. 37
2016, Vol. 37

