2. 武汉大学人民医院重症医学科 湖北 武汉 430060;
3. 湖北省赤壁市人民医院消化内科 湖北 咸宁 437300;
4. 武汉大学人民医院普通外科 湖北 武汉 430060
2. Dept. of Critical Care Medicine, Renmin Hospital of Wuhan University, Wuhan 430060, China;
3. Dept. of Gastroenterology, Renmin Hospital of Chibi City, Xianning 437300, Hubei, China;
4. Dept. of General Surgery, Renmin Hospital of Wuhan University, Wuhan 430060, China
急性胰腺炎(acute pancreatitis,AP)是一种急性发作的胰腺炎症,20%-25%可发展为重症急性胰腺炎(severe acute pancreatitis,SAP),病情凶险,死亡率高达40%[1],其发病机制目前仍未完全清楚。既往的研究表明,SAP会导致大量促炎细胞因子的释放,肿瘤坏死因子-α(TNF-α)和白细胞介素1β(IL-1β)被认为是功能最强的细胞因子,能促进胰腺组织局部进一步的破坏,并诱导远处器官的损伤,提高急性胰腺炎的死亡率[2]。
瑞香素是一种从植物中提取的活性单体成分,它已经被证实在镇痛和抗炎方面有重要作用。在对佐剂诱导的大鼠关节炎的研究中发现其对血清TNF-α和IL-1具有很强的抑制作用,可用于治疗多种自身免疫性疾病,如类风湿性关节炎(RA)、系统性红斑狼疮(SLE)等[3]。而应用瑞香素治疗SAP,目前还没有相关报道。因此,本研究建立大鼠SAP模型,用瑞香素处置做阳性对照,检测SAP后血清中TNF-α和IL-1β含量的变化,探讨瑞香素是否对大鼠SAP有保护作用。
1 材料与方法 1.1 实验动物及分组雄性Wistar大鼠,体重200-250 g,从湖北省实验动物研究中心获得。以标准大鼠饲料喂养,自由进食和饮水。室温控制在20-22 ℃,明暗周期为12 h。实验前大鼠禁食12 h,但自由饮水。72只大鼠随机分为4组,每组18只,分别为假手术组(SO组)、药物对照组(SO-D组)、模型组(SAP组)和干预组(SAP-D组)。SO-D组和SAP-D组分别在假手术前或造模前30 min腹腔注射瑞香素(4 mg/kg)。
1.2 试剂瑞香素由上海同田生物技术有限公司提供;牛磺胆酸钠购自美国Sigma-Aldrich公司;检测TNF-α和IL-1β的试剂盒购自美国R&D公司;苏木素染液购自美国Thermo公司。
1.3 SAP动物模型制备按照以前的方法诱导大鼠重症急性胰腺炎模型[4]。简言之,将大鼠麻醉后固定在操作台上,按无菌手术流程从上腹正中切口进入腹腔,将十二指肠提出,从十二指肠乳头逆行穿刺进入胰胆管约5 mm,夹闭胆总管和胰胆管。将5%牛磺胆酸钠溶液(1 ml/kg)注入胰胆管,建立重症急性胰腺炎模型。假手术组大鼠打开腹腔,取出十二指肠,拨弄2 min后放回腹腔。所有大鼠缝合腹腔并消毒伤口,给予生理盐水2 ml皮下补液。分别在三个时间点(3 h、6 h和12 h)从每组随机选择6只大鼠麻醉后分批剖杀。
1.4 标本的获取与处理从大鼠左心室抽取3 ml以上血液,离心血液标本(3 000 g,15 min),将上清液分装后放入-20 ℃冰箱中保存备用。取胰头组织置入4%多聚甲醛中固定,石蜡包埋切片,HE染色,观察和评估病理改变。
1.5 胰腺组织病理学观察将胰腺组织切片HE染色后置于光镜下观察,对胰腺的损伤情况进行评估[5],按照水肿、胰腺腺泡坏死、出血和脂肪坏死、炎症和血管周围浸润等方面进行病理学评分(见表 1)
| 表 1 胰腺组织病理学评分标准(x±s) |
应用ELISA双抗体夹心法检测血清中TNF-α和IL-1β的含量。按说明书的操作步骤进行,将标本放入自动酶标仪读取每个样本吸光度,然后绘制标准曲线,通过标准曲线计算TNF-α和IL-1β的浓度。
1.7 统计学分析实验数据以均数±标准差表示,两样本均数比较采用t检验,多样本均数比较采用方差分析。数据采用SPSS 17.0统计学软件进行分析,P < 0.05时表示差异具有统计学意义。
2 结果 2.1 胰腺组织的病理损伤肉眼观,SAP组大鼠造模后6 h可见腹腔内有少量腹水和皂化斑,胰腺组织明显出血、小片状坏死;12 h后可见肠管淤张,大量腹水和皂化斑,胰腺组织紫暗,大片状坏死。而SO组和SO-D组大鼠胰腺结构未见明显变化。光镜观察,SO组和SO-D组大鼠胰腺组织无明显病理改变;SAP造模后3 h胰腺组织出现出血、水肿、点状坏死及炎性细胞浸润等变化,6 h胰腺组织炎性细胞浸润及坏死程度等加重,12 h胰腺组织坏死程度进一步加重、出现大范围坏死、腺体结构发生破坏;SAP-D组各时间点胰腺组织水肿、坏死、出血及炎性细胞浸润等变化,较SAP组相应各时间点有所减轻。随病程进展,胰腺组织病理学评分逐渐升高,各时间点与SO组和SO-D组比较,均有统计学差异(P < 0.01)。而SAP-D组胰腺组织病理学评分较SAP组各相应时间点均有所下降,以12 h改善最为明显,差异有统计学意义(P < 0.05),表明瑞香素预处理减轻了大鼠胰腺组织的病理损伤(图 1A-D)。
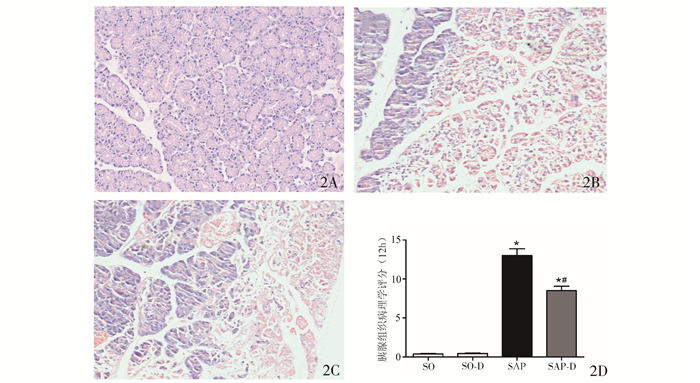
|
图 1 胰腺组织切片代表性HE染色(HE×200) A. SO组和SO-D组,大鼠胰腺组织结构均清晰完整;B. SAP组,造模后12 h胰腺组织大片坏死,明显炎症细胞浸润;C. SAP-D组,造模后12 h胰腺组织弥散型局部坏死,有较少炎症细胞浸润;D.假手术或造模后12 h胰腺组织病理学评分比较; 与SO组比较,*P < 0.01;与SAP组比较,#P < 0.05 |
SAP组血清中TNF-α的水平明显高于SO组(P < 0.01),而SAP-D组用瑞香素处理以后,各个时间点TNF-α的水平都明显低于SAP组(P < 0.05),但SO组和SO-D组之间无明显统计学差异(表 1)。
| 表 1 血清中TNF-α的水平(x±s, pg/ml) |
SAP组血清中IL-1β的水平明显高于SO组(P < 0.01),而SAP-D组用瑞香素处理以后,各个时间点IL-1β的水平都明显低于SAP组(P < 0.05),但SO组和SO-D组之间无明显统计学差异(表 2)。
| 表 2 血清中IL-1β的水平(x±s,pg/ml) |
急性胰腺炎典型的表现为胰腺组织的水肿、坏死、出血和超强的急性炎症反应,是一种较为常见的疾病,但是其具体的发病机制目前还没有完全阐明。炎症介质理论为AP的研究提供了线索[6]。在AP早期阶段,被过度激活的胰酶损伤了邻近的胰腺细胞,导致大量巨噬细胞以及中性粒细胞等炎性细胞局部浸润,而且这些炎性细胞还会促进胰腺细胞不断产生和释放更多促炎性因子。大量实验研究证实,在与AP相关的大量炎性介质中,TNF-α和IL-1β被认为是发挥促炎作用最强,作用效果最大的细胞因子,它能够促进胰腺组织局部进一步破坏,还可以诱导远处器官产生损伤,从而增加了重症急性胰腺炎的发生率和死亡率[2]。
3.2 瑞香素对促炎细胞因子TNF-α和IL-1β的影响研究表明,瑞香素具有镇痛和抗炎作用,而且还具有抗缺氧、抗菌的性能,能抑制蛋白酶活性,对胶原诱导的关节炎具有明显的治疗作用[7]。最近的研究显示,瑞香素在佐剂诱导的关节炎大鼠血清中TNF-α和IL-1具有较强的抑制作用。目前AP标准的治疗方法依然是支持治疗,众多研究人员一直在努力寻找新的治疗方法和药物,希望能改变这种疾病的自然病程。不断涌现的证据表明,炎性因子可能成为一种有效的治疗靶点。许多药物已经被测试,试图抑制在AP发病机制中作用比较明确的一些炎性介质的影响,特别是通过抑制TNF-α和IL-1β的活性以减轻胰腺的局部损伤和全身系统性炎症反应,许多AP的实验性治疗已经对不同的抑制方法进行了评估,并获得了一定的疗效[8]。本研究的实验数据显示,瑞香素能明显抑制促炎细胞因子TNF-α和IL-1β的分泌,减轻胰腺组织的坏死、出血、炎症浸润等,延缓重症急性胰腺炎的发展。
以上的研究表明,瑞香素可能通过抑制促炎细胞因子TNF-α和IL-1β的活性来减轻胰腺的局部损伤以及全身的系统性炎症反应,从而对大鼠SAP发挥保护作用。然而,这些发现都是基于动物实验,瑞香素对AP发挥保护作用的具体机制尚未完全阐明。因为人和大鼠存在种属差异,在将来的研究中,应该更多关注人体试验,以利于阐明瑞香素在急性胰腺炎发生发展的不同阶段对人体健康和疾病的影响和作用。
| [1] | Nicola C, Mia K, Prem C. Improving the management of acute pancreatitis in a district general hospital[J]. BMJ Quality Improvement Reports, 2015, 24(1): 1-4. |
| [2] | Wang XY, Tang QQ, Zhang JL, et al. Effect of SB203580 on pathologic change of pancreatic tissue and expression of TNF-α and IL-1β in rats with severe acute pancreatitis[J]. Eur Rev Med Pharmacol Sci, 2014, 18(3): 338-43. |
| [3] | Gao Q, Shan J, Di L, et al. Therapeutic effects of daphnetin on adjuvant-induced arthritic rats[J]. Ethnopharmacol, 2008, 120(5): 259-263. |
| [4] | He XB, Yu J, Guo WY, et al. Effects of thymosin β4 on a rat model of severe acute pancreatitis[J]. Experimental and therapeutic Medicine, 2015, 10(2): 2389-2395. |
| [5] | Zhao KL, Niyaz B, Liu LM, et al. Rosiglitazone attenuates the severity of hyperlipidemic severe acute pancreatitis in rats[J]. Experimental and Therapeutic Medicine, 2013, 6(4): 989-994. |
| [6] | Wu XL, Li JX, Li ZD, et al. Protective effect of tetrandrine on sodium taurocholate-induced severe acute pancreatitis[J]. Evid Based Complement Alternat Med, 2015, 2015(9): 1-8. |
| [7] | Tu L, Li S, Fu Y, et al. The therapeutic effects of daphnetin in collagen-induced arthritis involve its regulation of Th17 cells[J]. International Immu nopharmacology, 2012, 13(1): 417-423. |
| [8] | Luan ZG, Zhang J, Yin XH, et al. Ethyl pyruvate significantly inhibits tumour necrosis factor-α, interleukin-1β and high mobility group box 1 releasing and attenuates sodium taurocholate-induced severe acute pancreatitis associated with acute lung injury[J]. Clin Exp Immunol, 2013, 172(1): 417-426. |
 2016, Vol. 37
2016, Vol. 37

