胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是消化道最常见的间叶性实体肿瘤,约占消化道肿瘤的1%-3%,其可发生于消化道的任何部位,以胃(50%-60%)和小肠(30%-35%)最为常见[1]。据国外统计[1,2],GIST每年发病率介于11-19.5/百万,主要好发于中老年患者。microRNA(miRNA)是一类长约18-24个核苷酸内源性非编码的单链小RNA分子。现已证实,miRNA可通过参与细胞的增殖、凋亡、代谢,进而调控肿瘤的发生发展。本课题组前期利用miRNA芯片筛选GIST患者肿瘤组织和周边正常组织差异表达的miRNA,其中就发现miR-376c-3p的表达显著降低[3]。CASP-7是Caspase凋亡信号通路中重要的执行者,而miRNA 可作为一种“抑癌” 或“促癌”基因,直接或间接参与到Caspase 凋亡途径。本研究首先检测了miR-376c-3p在人胃间质瘤组织中的表达变化,然后利用GIST-T1细胞分析miR-376c-3p表达对其生物学行为的影响,并就miR-376c-3p与CASP-7之间可能存在的分子机制作初步探讨,拟为寻求GIST潜在的肿瘤标志物和新的分子治疗提供部分理论基础。
1 材料与方法 1.1 组织标本标本采用2014年间在武汉大学中南医院腹部肿瘤外科住院行手术治疗的13例胃间质瘤患者,患者术前均未接受甲磺酸伊马替尼等其它辅助治疗。收集的组织包括手术切除的肿瘤组织和对应的2 cm以上的癌旁正常组织,所有病例均经免疫组织化学染色确诊。
1.2 细胞和试剂人胃肠道间质瘤细胞系(GIST-T1) 购自爱森源(武汉)科技公司;细胞培养基DMEM、胎牛血清(FBS)和胰蛋白酶均购自Sigma;Lipofectamine 2000转染试剂和Annexin V-FITC试剂盒购自Invitrogen公司;CCK8试剂盒为碧云天生物公司产品;miRNA提取试剂盒、逆转录试剂盒均购自TAKARA公司、SYBR实时定量试剂盒购自Bioteke Corporation;兔抗人CASP-7多克隆抗体和辣根过氧化物酶标记的山羊抗兔IgG均购自CST公司;miR-376c-3p mimic、inhibitor 及其阴性对照均由上海吉玛制药公司提供合成。
1.3 细胞转染与实验分组使用含10%FBS的DMEM培养基在37 ℃、 5% CO2饱和湿度条件下培养,每隔1-2 d换液1次。收集对数生长期的细胞接种于6孔板,每孔2×105个细胞。实验设置5个组:①空白对照(NC组),不做处理;②转染miR-376c-3p mimic(mimic组);③转染过表达阴性对照(mimic NC组);④转染miR-376c-3p inhibitor(inhibitor组);⑤转染抑制阴性对照(inhibitor NC组)。根据上述分组,按照Lipofectamine 2000说明书完成转染,6 h后更换为10%FBS的DMEM培养基继续培养。
1.4 实时定量逆转录PCR(qRT-PCR)检测组织标本和细胞转染后miR-376c-3p表达将收集的组织标本用匀浆机匀浆,同时将转染后48 h的各组细胞,分别提取总RNA,验证纯度。逆转录反应合成 cDNA后,用SYBR试剂盒检测组织和细胞中miR-376c-3p表达量。以U6作为内参基因,各种引物序列见表 1。反应条件:95 ℃预变性3或10 min(组织),95 ℃ 10 s,60 ℃30 s,72 ℃ 30 s,40个循环。所有反应均设立3个复孔。记录每个基因的CT值。实验结果采用2-△△CT方法进行分析。
| 表 1 RT-qPCR引物列表 |
GIST-T1细胞转染 48 h后,各加入RIPA裂解液及蛋白酶抑制剂,10 000 g离心5 min,取上清转移到1.5 ml管中。BCA 法测定蛋白浓度。转移蛋白至醋酸纤维素膜上,用含5% 脱脂奶粉的TBST封闭1 h后,加入Ⅰ抗,摇床孵育过夜,TBST液洗涤3次(每次>5 min)后加入 HRP 标记的Ⅱ抗,室温下温育1 h,ECL自显影。用 Image J软件分析各蛋白区带的灰度值,以 GAPDH 作为内参照,CASP-7的相对含量用CASP-7/GAPDH灰度比值表示。另外CASP-7 mRNA的检测参照上述miR-376c-3p qRT-PCR检测的方法,以GADPH为内参。
1.6 CCK8检测细胞活性转染后48 h,在96孔板接种待测细胞悬液100 μl(约5×103细胞/孔),放在培养箱预培养24 h后加入10 μl CCK8试剂(避免产生气泡),继续放在细胞培养箱内孵育2 h,然后用酶标仪检测在450 nm处吸光度,每组重复3次。
1.7 流式细胞仪检测细胞凋亡率转染后用PBS将细胞清洗1-2次,弃上清,用Annexin结合液重悬细胞,调整细胞浓度为(2-5) ×105个/ml,取100 μl细胞悬液,加入5 μl Annexin V-FITC和5 μl PI染液,室温避光孵育15 min,流式细胞仪检测各组凋亡率(总凋亡率=Q2-UR+Q2-LR),每组重复3次。
1.8 Transwell法检测细胞迁移能力转染后收集细胞,用无血清培养基制成单细胞悬液(1×106个/ml),取100 μl细胞悬液于上室,600 μl完全培养基于下室,于细胞培养箱内培养24 h,4%多聚甲醛室温固定30 min,结晶紫染色10 min。每次显微镜下随机选取5个视野计数后取平均值,穿过transwell聚碳酸酯膜的细胞即为迁移的细胞,每组重复3次。
1.9 统计学处理所有数据采用SPSS 22.0软件进行统计学处理,数据采用xx±s,两组比较采用独立t检验,两组以上组间比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
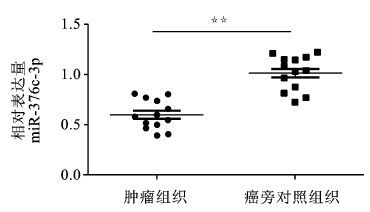
2 结果 2.1 qRT-PCR检测miR-376c-3p在人胃间质瘤组织中的表达情况将收集的13对手术切除的人胃间质瘤组织提取总RNA,用qRT-PCR检测miR-376c-3p,结果显示(见图 1) :肿瘤组织中miR-376c-3p mRNA的相对表达量相比癌旁对照组织明显下降,是癌旁对照组的58.7%(P<0.01) 。
|
图 1 人胃间质瘤与癌旁对照组织中miR-376c-3p的相对表达量 两组比较,☆☆P<0.01 |
转染后48 h收集细胞,采用qRT-PCR检测miR-376c-3p的相对表达量。PCR结果显示(见图 2) :转染miR-376c-3p mimic后mimic组miR-376c-3p的表达量显著高于其他组,为mimic NC组的3.73倍(P<0.01) ;而转染inhibitor后inhibitor组miR-376c-3p的表达量则显著低于其他组,为inhibitor NC组的42.2%( P<0.01) 。证实转染成功。

|
图 2 GIST-T1细胞转染后检测各组miR-376c-3p相对表达量 与mimic NC 组比较,**P<0.01;与inhibitor NC组比较,##P<0.01 |
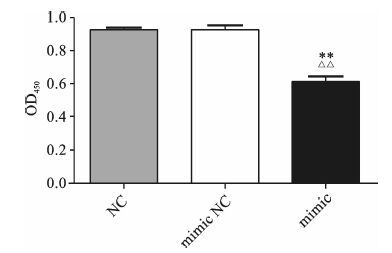
细胞在450 nm处吸光度越高,表明细胞增殖能力越强。我们设置了3个组:NC组,mimic NC和mimic组。转染成功后预培养24 h,CCK8结果显示(见图 3) :相比NC组和mimic NC组,mimic组细胞的增殖能力明显下降(P<0.01) 。表明上调miR-376c-3p的表达会显著降低GIST-T1细胞的增殖。
|
图 3 上调miR-376c-3p表达对细胞增殖能力的影响 与mimic NC组比较,**P<0.01;与NC组比较,△△P<0.01 |
mimic和阴性对照转染GIST-T1细胞后48 h,流式细胞仪检测各组凋亡细胞的变化。结果显示(见图 4) ,mimic组细胞的总凋亡率显著高于NC和mimic NC组(P<0.05) 。结果说明上调miR-376c-3p表达可以促进GIST-T1细胞的凋亡。

|
图 4 上调miR-376c-3p表达对细胞凋亡的影响 与mimic NC组比较,*P<0.05;与NC组比较,△P<0.05 |
我们同样设置了3个组,行transwell试验检测各组细胞迁移能力的变化。结果显示(见图 5) :mimic组与NC和mimic NC组相比,穿过transwell小室的数量明显降低(P<0.01) 。表明miR-376c-3p过表达能显著抑制GIST-T1细胞的迁移能力。

|
图 5 上调miR-376c-3p表达对细胞迁移能力的影响(结晶紫染色×200) A:NC组;B:mimic NC组;C:mimic组;与mimic NC组比较,**P<0.01;与NC组比较,△△P<0.01 |
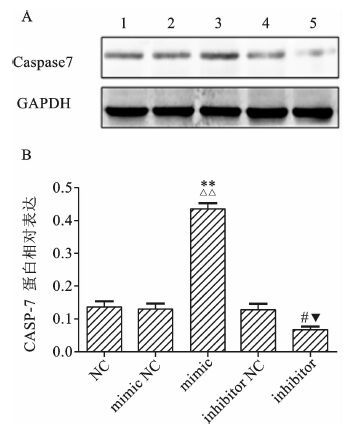
我们设置了5个组,GIST-T1细胞转染成功后,利用Western Blot检测miR-376c-3p过表达和抑制对CASP-7蛋白水平影响。Western Blot结果显示(见图 6) :mimic组的CASP-7蛋白表达量显著高于NC组和mimic NC组(P<0.01) ,而inhibitor组CASP-7的表达量则低于NC和inhibitor NC组(P<0.05) 。结果表明miR-376c-3p可以上调CASP-7蛋白水平的表达。
|
图 6 miR-376c-3p对CASP-7蛋白水平的表达影响 1:NC组;2:mimic NC组;3:mimic组;4:inhibitor NC组;5:inhibitor组 与mimic NC组比较,**P<0.01;与inhibitor NC组比较,#P<0.05;与NC组比较,△△P<0.01,▼P<0.05 |
我们同样设置了5个组,从mRNA水平再次进行检测。qRT-PCR结果显示(见图 7) :mimic组CASP-7 mRNA相对表达量比NC和mimic NC组明显升高(P<0.01) ;相反地,下调miR-376c-3p表达,inhibitor 组CASP-7的表达量则低于inhibitor NC组(P<0.05) 。结果同样表明miR-376c-3p可以激活CASP-7 mRNA水平的表达。

|
图 7 miR-376c-3p对CASP-7 mRNA水平的表达影响 与mimic NC组比较,**P<0.01;与inhibitor NC组比较,#P<0.05;与NC组比较,△△P<0.01 |
GIST是消化道最常见的间叶性肿瘤,目前关于GIST发生发展的机制尚未完全阐明。原癌基因c-kit/PDGFRα的获得性突变是GIST发生的中心事件。两者基因均位于人染色体4q12,编码的蛋白同属Ⅲ型酪氨酸激酶家族,其异常活化,可以激活下游的酪氨酸激酶信号通路(PI3K/Akt、Ras/ERK、Jak/STAT3等),导致细胞的增殖分化失控,最终形成肿瘤[4, 5]。近年来大量研究表明,miRNA异常表达可以通过调节肿瘤相关基因的表达,参与肿瘤的发生、发展和侵袭。已有研究显示[4],miR-221/222、miR-218、miR-494等参与了GIST的发病过程。
miR-376c-3p是本实验室前期利用miRNA芯片在GIST患者中筛选出差异表达的miRNA,其基因位于人染色体14q32区域。此区域存在人类最大的miRNA基因簇,大约有10%的miRNA基因位于该区域,包括miR-376家族(miR-376a,miR-376b,miR-376c)。最近研究发现[4, 5],在胃间质瘤患者65%以上的患者存在完全或者部分的14q染色体缺失,并且大部分存在于14q11.2和14q32这两个脆性位点。Haller等[6]miRNA表达谱芯片分析了12例GIST,发现 44 个定位于染色体 14q32.31的miRNA表达非常一致,均在14q缺失的 GIST中呈低表达。Choi[7]研究结果也得出类似的结论,GIST的 miRNA表达类型与14q缺失、肿瘤原发部位以及危险度等因素有关。并且在以上两者的研究中[6, 7],筛选出低表达miRNA中就有miR-376c-3p,这也与我们筛选结果相符。据此我们推测GIST患者可能由于染色体14q的缺失,导致了miR-376c-3p的低表达,从而促进了肿瘤的发生发展。另外亦有研究表明[8-10],miR-376c在肝细胞癌,肺癌、黑色素瘤、骨肉瘤、前列腺等肿瘤中表达下调,表明miR-376c极可能是一种抑癌基因。本研究首先通过qRT-PCR技术,发现胃间质瘤肿瘤组织中miR-376c-3p的表达水平为癌旁组织的58.7%左右,差异具有显著性,提示miR-376c-3p中异常低表达可能参与了GIST的发病机制。
miR-376c-3p在其它许多肿瘤中低表达及其抑制肿瘤细胞的增殖迁移作用已得到证实[8-10],但其与GIST研究工作目前还只是停留在表达谱芯片的筛选结果,没有更深入的生物功能学研究。为了进一步探索miR-376c-3p在人胃肠道间质瘤细胞中的作用,本研究通过转染技术在人胃肠道间质瘤GIST-T1细胞系中高表达miR-376c-3p,利用qRT-PCR验证转染效率后,采用CCK8、流式细胞分析检测以及transwell法研究了miR-376c-3p对胃肠道间质瘤生物学行为的影响。结果显示,在GIST-T1中过表达miR-376c-3p后,细胞的增殖活力下降,同时能够显著抑制细胞的迁移能力,促进其凋亡,差异均有统计学意义。这进一步证实了miR-376c-3p在GIST中可能发挥的抑癌基因样作用。
CASP-7是Caspase凋亡信号通路中重要的执行者,是大部分凋亡信号通路的必经之路,在细胞凋亡中起关键性作用,正常凋亡机制抑制往往会导致肿瘤的发生。在GIST主要发病机制中突变基因c-kit正是由于持续激活PI3K/Akt通路,通过下游多种途径对靶蛋白进行磷酸化而发挥抗凋亡作用[4, 5]。其中就包括抑制Caspase家族成员的活化,抑制Caspase导致的细胞凋亡。那么作为凋亡通路中核心成员CASP-7,已有研究报道[11, 12],其在消化道肿瘤如胃癌、结直肠癌等肿瘤中低表达。而miRNA 可作为一种“促癌”或“抑癌”基因,直接或间接参与到Caspase 凋亡途径。Cui等的研究[13]就发现,miR-224的可以直接靶向CASP-7,抑制其表达,增强小细胞肺癌(NSCLC)的细胞增殖和迁移能力,并且在NSCLC患者中检测到CASP-7的低表达。
为进一步探寻miR-376c-3p在GIST中可能的抑癌样作用机制, 本研究就miR-376c-3p与CASP-7之间可能存在的直接或间接分子机制作初步探讨。我们将miR-376c-3p mimic转染GIST-T1细胞, 发现CASP-7基因无论是蛋白还是mRNA水平均显著降低, 而转染miR-376c-3p inhibitor结果则正好相反。miRNA作用机制主要是与靶基因mRNA的3’UTR互补配对, 通过靶基因mRNA的降解或阻遏蛋白的翻译, 在转录后水平调控靶基因的表达。而本研究却显示miR-376c-3p上调CASP-7基因表达, 我们推测可能是miR-376c-3p靶向CASP-7上游的某个促癌基因, 导致PI3K/Akt通路受到抑制, 间接导致了CASP-7基因进一步激活。今后可以从这方面进一步研究, 这也是本研究不足之处。总之, 这些结果表明miR-376c-3p可以激活CASP-7基因表达, GIST患者可能由于miR-376c-3p低表达, 间接抑制下游信号基因CASP-7, 从而参与GIST发生发展。iR-376c-3p低表达,间接抑制下游信号基因CASP-7,从而参与GIST发生发展。
综上所述,本研究表明miR-376c-3p在人胃间质瘤组织中明显下调,在人胃肠道间质瘤GIST-T1细胞中miR-376c-3p可以间接调控CASP-7的表达抑制细胞增殖、迁移能力,促进细胞凋亡。因此,miR-376c-3p有望成为GIST特异性的诊断标志物,并为寻找GIST新的靶向药物提供了一定的理论基础。但GIST发病机制复杂,并非仅受单一miRNA调控,而且miRNA也不仅仅只是调控某个单一靶基因,因此这一复杂的调控网络还有待于深入研究。
| [1] | Joensuu H, Vehtari A, Riihimaki J, et al. Risk of recurrence of gastrointestinal stromal tumor after surgery: an analysis of pooled population-based cohorts[J]. Lancet Oncol, 2012, 13: 265-274. DOI: 10.1016/S1470-2045(11)70299-6. |
| [2] | Nilsson B, Bumming P, Meis-Kindblom JM, et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical courtm, and prognostication in the preimatinib mesylate era——a population-based study in western Sweden[J]. Cancer, 2005, 103(4): 821-829. DOI: 10.1002/cncr.20862. |
| [3] | Xiao J, Wang QX, Zhu YQ. Altered expression profile of micrornas in gastric stromal tumor[J]. J Hua Zhong Univ Sci Technol Med Sci, 2015, 35(6): 842-850. DOI: 10.1007/s11596-015-1516-0. |
| [4] | Akcakaya P, Lui WO. MicroRNAs and Gastrointestinal Stromal Tumor[J]. Adv Exp Med Biol, 2015, 889: 51-70. DOI: 10.1007/978-3-319-23730-5. |
| [5] | Yamamoto H, Oda Y. Gastrointestinal stromal tumor: recent advances in pathology and genetics[J]. Pathol Int, 2015, 65(1): 9-18. DOI: 10.1111/pin.2015.65.issue-1. |
| [6] | Haller F, von Heydebreck A, Zhang JD, et al. Localization- and mutation-dependent microRNA (miRNA) expression signatures in gastrointestinal stromal tumors (GISTs), with a cluster of co-expressed miRNAs located at 14q32.31[J]. J Pathol, 2010, 220(1):71-86. |
| [7] | Choi HJ, Lee H, Kim H, et al. MicroRNA expression profile of gastrointestinal stromal tumors is distinguished by 14q loss and anatomic site[J]. Int J Cancer, 2010, 126(7): 1640-1650. |
| [8] | Jiang W, Tian Y, Jiang S, et al. MicroRNA-376c suppresses non-small-cell lung cancer cell growth and invasion by targeting LRH-1-mediated Wnt signaling pathway[J]. Biochem Biophys Res Commun, 2016, 473(4): 980-986. DOI: 10.1016/j.bbrc.2016.04.002. |
| [9] | Iwaki J, Kikuchi K, Mizuguchi Y, et al. MiR-376c down-regulation accelerates EGF-dependent migration by targeting GRB2 in the HuCCT1 human intrahepatic cholangiocarcinoma cell line[J]. PLoS One, 2013, 8(7): e69496. DOI: 10.1371/journal.pone.0069496. |
| [10] | Zehavi L, Avraham R, Barzilai A, et al. Silencing of a large microRNA cluster on human chromosome 14q32 in melanoma: biological effects of mir-376a and mir-376c on insulin growth factor 1 receptor[J]. Mol Cancer, 2012, 11: 44. DOI: 10.1186/1476-4598-11-44. |
| [11] | Yoo NJ, Lee JW, Kim YJ, et al. Loss of caspase-2, -6 and -7expression in gastric cancers[J]. APMIS, 2004, 112: 330-335. DOI: 10.1111/apm.2004.112.issue-6. |
| [12] | Palmerini F, Devilard E, Jarry A, et al. Caspase 7 downregulation as an immunohistochemical marker of colonic carcinoma[J]. Hum Pathol, 2001, 32: 461-467. DOI: 10.1053/hupa.2001.24328. |
| [13] | Cui R, Kim T, Fassan M, et al. MicroRNA-224 is implicated in lung cancer pathogenesis through targeting caspase-3 and caspase-7[J]. Oncotarget, 2015, 6(26): 21802-21815. DOI: 10.18632/oncotarget. |
 2017, Vol. 38
2017, Vol. 38

