2. 武汉大学基础医学实验教学中心 湖北 武汉 430071
2. Experimental Teaching Center,School of Basic Medical Sciences, Wuhan University, Wuhan 430071 ,China
动脉粥样硬化(atherosclerosis,AS)是迄今最常见的危害大、中动脉,严重影响人类健康的一种慢性疾病[1]。AS是遗传和环境等一系列因素复合作用的结果,近年来,倾向于认为AS是一种血管壁的慢性炎症免疫性疾病,脂代谢紊乱和免疫反应在AS形成过程中共同发挥作用[2]。已知血浆低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)与心血管疾病发病风险相关,高浓度LDL会增加AS的风险[3]。 正常情况下,LDL通过LDL受体(LDLR)识别,内吞入细胞与溶酶体结合并降解,此途径LDLR受细胞内胆固醇含量的负反馈调节。高浓度LDL情况下,部分LDL滞留于内皮下,被氧化为ox-LDL,巨噬细胞通过清道夫受体结合并不断摄取ox-LDL,此途径无负反馈调节,导致巨噬细胞的泡沫化,启动并促进AS的发展[4]。因此,研究LDL的抗氧化在减缓AS的发生发展中有重要意义。然而,LDL氧化机制并不清楚。有研究[5]表明,巨噬细胞细胞膜表面可形成封闭微区,排斥环境中的物质,具有保护作用。因此,我们着眼于细胞膜的屏障作用,认为LDL的氧化可能发生在细胞膜上被隔开的微区——脂质筏(Lipid Raft)内,造成了临床上抗氧化药物抗氧化能力受限的临床现状。
脂质筏是膜脂双层内含有特殊脂质及蛋白质的一种液态有序相纳米级微区,近年研究表明,脂质筏及其信号平台是细胞接受刺激后氧化还原信号产生并传输的重要装置[6]。有研究表明,脂质筏参与ox-LDL的摄取[7]。本文通过探究LDL刺激是否会诱导细胞膜上脂质筏的聚集,为研究脂质筏在细胞的生理活动中的重要作用奠定基础。
1 材料与方法 1.1 实验材料Raw264.7细胞为本实验室保存;DMEM高糖培养基购自美国Hyclone公司;胎牛血清购自Merk Millipore公司;OptiPrepTM分离液购自挪威奥斯陆Fresenius Kabi Norge AS公司;LDL购自以色列Pro Spec-Tany公司;胆固醇试剂盒(Amplex Red Cholesterol Assay Kit,Catalog no.A12216)购自Invitrogen公司(Grand Island,NY);BCA 蛋白检测试剂盒(PierceBCA Protein Assay Kit)、Alexa-Fluor488-CBT系列染料购自美国Thermo公司;小鼠flotillin-1抗体购自美国BD公司;小鼠caveolin-1抗体购自美国CST公司。激光扫描共聚焦荧光显微镜DM6000来自德国Leica公司;超高速冷冻离心机来自Beckman公司;Infinite F50全波长多功能酶标仪来自奥地利TECAN公司;细胞超声破碎仪JY92-IIN 来自中国宁波新芝公司;Western Blot系列装置来自Bio-rad公司。
1.2 细胞培养小鼠单核细胞白血病细胞Raw264.7培养在含10%胎牛血清、1%青霉素、1%链霉素的DMEM培养基中。细胞生长在湿度适宜、含5%CO2的37 ℃恒温箱中。
1.3 FRAP观察细胞膜流动性将状态良好的细胞接种于共聚焦专用培养皿中,细胞密度适宜,待细胞贴壁。同步化处理2 h,加CTB488(终浓度为2 μg/ml)在DMEM培养基中,于37 ℃恒温箱中染色2 h后,在激光共聚焦荧光显微镜20倍镜头下观察细胞形态及染色状况。实验组用LDL(终浓度为100 μg/ml)处理15 min,分别选择对照组和实验组适宜膜部位各3处,用100%的488 nm激光进行荧光漂白,实时观察并记录漂白部位细胞膜荧光恢复时间。荧光恢复在低激光强度下每隔868 ms记录一次,共记录234 s。
1.4 用不含表面活性剂的方法分离脂质筏所有的过程在冰上进行。实验组和对照组各两皿细胞,实验组用LDL(终浓度为100 μg/ml)处理15 min,PBS清洗后,用细胞刮将其刮入到base buffer(20 mmol/L的Tris-HCL,1 mmol/L CaCl2,1 mmol/L MgCl2,pH 7.8,250 mmol/L蔗糖)中。250 g离心2 min得到细胞沉淀,用base buffer重悬。细胞超声破碎3 min(破碎3 s停2 s),裂解产物10000 g离心10 min。将上清移置于新的离心管中,沉淀加入1 ml base buffer重悬,再次超声3 min。10000 g离心10 min后,将两次的上清液混合。用BCA试剂盒测蛋白浓度后,将实验组和对照组总蛋白浓度调为相同,使各上清终体积为2 ml。
加入与上清等体积(2 ml)的包含50% OptiPrep的base buffer至混合的上清中(变为25% OptiPrep)。采用顶替法依次将4 ml base buffer(即0%的OptiPrep)、4 ml 20%的OptiPrep(用base buffer配置)、4 ml 25%的OptiPrep(用base buffer配置)铺于离心管底部。使用Beckman超速离心机,SW-41转子梯度离心,52000 g,90 min。离心后,从上往下1/3处及在20%和25%界面交界处各看到一条明显的带,离液面1/3处的带即为脂质筏带[8]。从上往下每次吸取0.67 ml,共计18层,其中第6,7,8层对应脂质筏层。
1.5 密度梯度离心产物胆固醇含量的测定分别取18层中样品,稀释后用胆固醇含量测定试剂盒Amplex Red Cholesterol Assay Kit分别对实验组以及对照组各层中总胆固醇含量进行测定。
1.6 密度梯度离心产物Western Blot分析分别取对照组和实验组的18层产物与5×Loading Buffer混合,SDS-PAGE电泳后转印到NC膜上,于含5%脱脂奶粉的TBST中室温封闭2 h后弃封闭液,加一抗4 ℃孵育过夜(flotillin-1,caveolin-1均用新鲜的封闭液以1∶1000稀释)。弃一抗并用TBST洗去未结合的一抗,加入酶标二抗(辣根过氧化物酶HRP,1∶5000用封闭液稀释),室温孵育2 h后洗去,ECL法显影。
1.7 β-环糊精结合实验β-环糊精(5 mmol/L,2 h)与细胞孵育,2.5%戊二醛4 ℃固定过夜,脱水,干燥,扫描电子显微镜观测细胞形态,胆固醇试剂盒检测细胞胆固醇含量变化。
2 结果 2.1 LDL刺激后的Raw 264.7细胞细胞膜荧光漂白恢复时间延长荧光淬灭后,共聚焦实时观察记录对照组和实验组各3个点荧光强度,对照组3个点荧光漂白恢复时间分别为50,40,50 s,实验组3个点荧光漂白恢复时间分别为140,100,120 s。用SPSS分析软件对两组荧光漂白恢复时间进行统计学分析,T检验得P<0.05,具有统计学意义。表明LDL刺激后的Raw 264.7细胞细胞膜的荧光漂白恢复时间延长(荧光漂白恢复时间:漂白后细胞相对荧光强度趋于稳定所需时间)。见图 1。
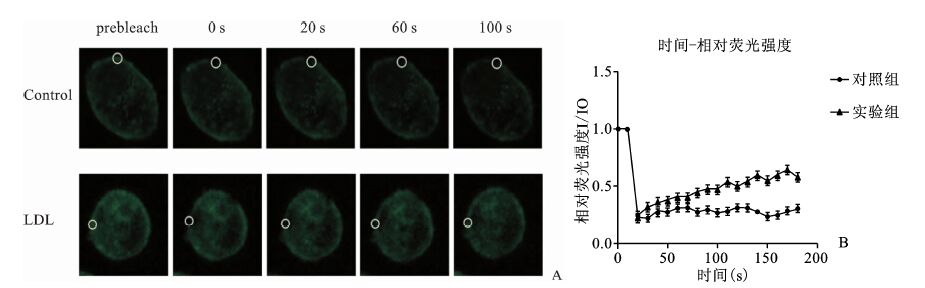
|
图 1 荧光漂白恢复实时数据 相对荧光强度:漂白后荧光强度与漂白前荧光强度之比;A.对照组与LDL刺激组激光漂白后,分别在0,20,60,100 s的荧光恢复情况。B.记录漂白后180 s内多个细胞的荧光强度值,绘制时间-相对荧光强度曲线(每个点代表 3处相对荧光强度的均值)。实验组荧光漂白恢复时间 s比对照组 延长,*P<0.05 |
对LDL刺激组和对照组的细胞进行密度梯度离心。测定各层中胆固醇的含量,发现在6-8层刺激组胆固醇含量 高于对照组 ,T检验P<0.05,差异有统计学意义;其它层刺激组胆固醇含量 低于对照组 ,t检验P<0.05,差异有统计学意义。见图 2。
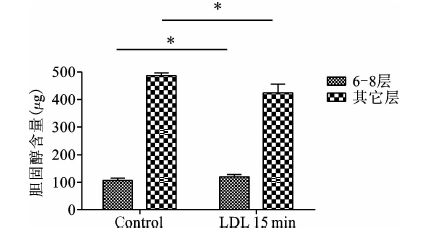
|
图 2 LDL刺激前后6-8层和其它层中胆固醇含量的变化 n=3,与对照组相比,*P<0.05 |
我们对脂质筏标志性蛋白flotillin-1和caveolin-1进行Western Blot分析,数据表明,经LDL处理后,第6,7,8层(脂质筏存在区域)出现了flotillin-1和caveolin-1蛋白的增多。见图 3。
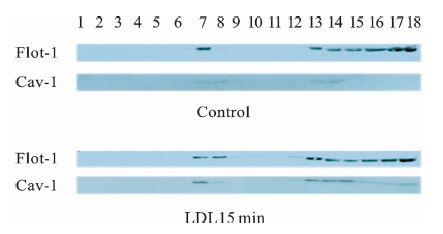
|
图 3 LDL刺激前后6-8层和其它层中胆固醇含量的变化 n=3,与对照组相比,*P<0.05 |
用5 mmol/L的β-环糊精处理细胞2 h后,扫描电子显微镜显示细胞形态发生改变(图 4A),进一步检查细胞胆固醇含量,也明显下降(图 4B)。
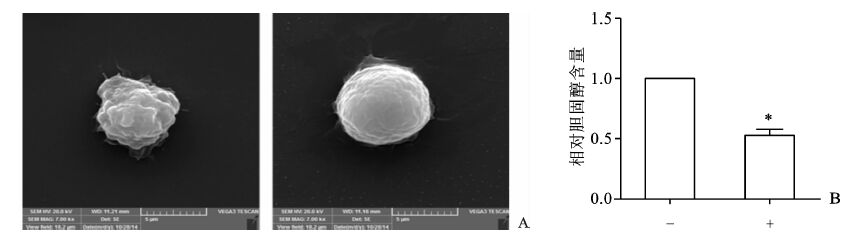
|
图 4 与β-环糊精的作用结果 A. 扫描电镜观察β-环糊精处理前后Raw 264.7细胞形态的变化。B.β-环糊精处理前后,Raw 264.7细胞胆固醇含量变 化,与对照组相比,*P<0.05 |
脂质筏是膜脂双层内含有特殊脂质及蛋白质的一种液态有序相纳米级微区,微区内陷可形成囊泡,主要脂质成分是胆固醇、鞘磷脂(sphingomyelin,SM)和神经节苷脂(ganglioside,GM)[9]。鞘磷脂有着较长的饱和酰基链尾巴,而且通过和胆固醇的相互作用,形成一种脂质有序相,比周围的细胞膜区域具有更高的有序性和稳定性,降低了细胞膜的流动性。FRAP是使用亲脂性或亲水性的荧光分子,如荧光素、绿色荧光蛋白等与蛋白或脂质耦联,用于检测所标记分子在活体细胞表面或细胞内部运动及其迁移速率。 利用高能激光照射细胞的某一特定区域,使该区域内标记的荧光分子不可逆的淬灭,这一区域称荧光漂白(photobleaching)区。随后,由于细胞质中的脂质分子或蛋白质分子的运动,周围非漂白区荧光分子不断向光漂白区迁移。结果使荧光漂白区的荧光强度逐渐地恢复。因此,我们通过CTB488标记细胞膜上的GM1,对细胞膜进行染色,通过漂白后的荧光恢复时间,判断细胞膜流动性的差异。与对照组相比,经LDL处理后的Raw264.7细胞细胞膜荧光漂白恢复时间延长,说明巨噬细胞在经LDL刺激以后细胞膜流动性降低,其原因可能是LDL诱导了细胞膜上脂质筏的聚集。
脂质筏的主要脂质成分之一是胆固醇,此外,还富含多种蛋白,包括flotllin-1,caveolin-1,受体酪氨酸激酶等,这些蛋白可以作为脂质筏的标志性蛋白[8]。实验发现,经LDL刺激后的Raw 264.7细胞经蔗糖梯度超速离心后,脂质筏所在分离层胆固醇含量升高,Western Blot的结果显示脂质筏标志性蛋白flotillin-1和caveolin-1增多,说明经LDL刺激后,确实诱导了细胞膜上脂质筏的聚集。
由于胆固醇是脂质筏的重要组分,使用胆固醇结合试剂,如甲基β-环糊精、菲律宾毒素等能破坏脂质筏的脂质有序结构,从而破坏脂质筏。实验结果显示,β-环糊精处理细胞2 h后,细胞形态发生改变,进一步测定细胞胆固醇含量,也明显下降。相关研究显示,经β-环糊精处理的细胞,在与LDL(100 μg/ml)孵育12,24 h后,TBARS值明显低于对照组,说明脂质筏参与巨噬细胞介导的LDL氧化[10]。
高浓度的LDL会被氧化,进而由巨噬细胞摄取,导致其泡沫化。研究表明,经LDL处理过的巨噬细胞会发生泡沫化,即LDL发生了氧化。而通过实验,我们又发现了LDL能诱导细胞膜上脂质筏的聚集。因此,我们将LDL的氧化和脂质筏聚集联系在一起,认为LDL的氧化需要脂质筏的参与。
这一推论不仅解释了实验中出现的细胞膜流动性的降低、脂质筏区域胆固醇含量的增多以及flotillin-1和caveolin-1蛋白含量的增多的现象,更重要的是,LDL刺激后引起脂质筏聚集、LDL氧化等现象共同揭示了脂质筏可能存在的潜在功能,即脂质筏参与了LDL的氧化过程,为LDL的抗氧化研究指出了方向。同时,着眼于LDL被氧化为ox-LDL的过程,从LDL源头上研究动脉粥样硬化发生的原因,为从根本上治疗动脉粥样硬化寻找途径。
| [1] | Ammirati E, Moroni F, Magnoni M, et al. The role of T and B cells in human atherosclerosis and atherothrombosis[J]. Clin Exp Immunol, 2015, 179(2): 173-187. |
| [2] | Qu B, Qu T. Causes of changes in carotid intima-media thickness: a literature review[J]. Cardiovasc Ultrasound, 2015, 13: 46. DOI: 10.1186/s12947-015-0041-4. |
| [3] | Spinas E, Kritas SK, Saggini A, et al. Role of mast cells in atherosclerosis: a classical inflammatory disease[J]. Int J Immunopathol Pharmacol, 2014, 27(4): 517-521. DOI: 10.1177/039463201402700407. |
| [4] | Goldstein JL, Brown MS. A century of cholesterol and coronaries: from plaques to genes to statins[J]. Cell, 2015, 161(1): 161-172. DOI: 10.1016/j.cell.2015.01.036. |
| [5] | Heiple JM, Wright SD, Allen NS, et al. Macrophages form circular zones of very close apposition to IgG-coated surfaces[J]. Cell Motil Cytoskeleton, 1990, 15(4): 260-270. |
| [6] | Jin S, Zhou F, Katirai F, et al. Lipid raft redox signaling: molecular mechanisms in health and disease[J]. Antioxid Redox Signal, 2011, 15(4): 1043-1083. |
| [7] | Rios FJ, Ferracini M, Pecenin M, et al. Uptake of oxLDL and IL-10 production by macrophages requires PAFR and CD36 recruitment into the same lipid rafts[J]. PLoS One, 2013, 8(10): e76893. DOI: 10.1371/journal.pone.0076893. |
| [8] | Macdonald JL, Pike LJ. A simplified method for the preparation of detergent-free lipid rafts[J]. J Lipid Res, 2005, 46(5): 1061-1067. |
| [9] | Lingwood D, Simons K. Lipid rafts as a membrane-organizing principle[J]. Science, 2010, 327(5961): 46-50. |
| [10] | Song J, Ping LY, Duong DM, et al. Native low density lipoprotein promotes lipid raft formation in macrophages[J]. Mol Med Rep, 2016, 13(3): 2087-2093. |
 2017, Vol. 38
2017, Vol. 38

