量子点(quantum dots, QDs)是一种半导体纳米晶体,因其独特的光学特性作为荧光标记物被广泛应用在生物医学领域,如生物标记、活体成像、药物载体靶向等。在免疫组织化学技术中,作为荧光标记物,量子点免疫荧光法较传统的免疫荧光法检测抗原灵敏度高,稳定性强,荧光持续时间长,操作方便[1-4]。量子点免疫荧光技术对生物分子标记和示踪具有明显的优势。本实验分别采用不同的量子点免疫荧光组织化学方法对膀胱癌BIU-87固定细胞和活细胞中前列腺干细胞抗原(prostate stem cell antigen, PSCA)进行特异性标记,探讨不同量子点免疫荧光法对细胞标记的效果,以优化细胞标记方法,并分析活体内肿瘤非侵入性的靶向成像的可行性。
1 材料与方法 1.1 材料人膀胱癌BIU-87细胞购于中国科学院昆明细胞库。胎牛血清、RPMI 1640培养液、0.25%胰蛋白酶购于美国Hyclone公司,鼠抗人PSCA单克隆抗体购于美国Abcam公司,量子点抗体偶联试剂盒、量子点标记的链霉亲和素(QD605-SA)、量子点标记的羊抗鼠(QD605-IgG)购于武汉珈源量子点公司技术开发有限责任公司。
1.2 细胞爬片与固定将对数生长期的膀胱癌BIU-87细胞消化离心重悬后,按每孔细胞数5×105个接种于已装有无菌盖玻片的6孔培养板中,放入37 ℃、5%CO2饱和湿度的培养箱中培养,待细胞贴壁长满约50%-70%范围时,将盖玻片取出,滴加冰丙酮溶液覆盖整个盖玻片,待丙酮自然干燥后制成固定细胞爬片,于-20 ℃冰箱保存备用。
1.3 固定细胞量子点免疫荧光标记 1.3.1 三步法标记TBS冲洗(2×3 min),滴加0.1% Triton-X 100,37 ℃湿盒孵育10 min,ddH2O冲洗(2×2 min),TBS洗(2×2 min);滴加2%BSA,37 ℃封闭30 min;滴加PSCA一抗(TBS稀释, 1:50),4 ℃过夜;TBS-T冲洗(3×5 min),滴加2%BSA 37 ℃封闭10 min,滴加生物素化的二抗,37 ℃孵育30 min;TBS-T冲洗(3 ×5 min),再上2%BSA 37 ℃封闭20 min,滴加QD605-SA (2% BSA稀释,1:100),37 ℃湿盒孵育30 min;TBS-T冲洗洗(3×5 min),TBS洗5 min后, 滴加DAPI染色3 min,TBS冲洗(3×5 min),用中性甘油封片,4 ℃暗处保存。每个爬片实验组和阴性对照组各做1张,对照组中一抗采用TBS代替,其余操作同阳性。
1.3.2 二步法标记同三步法标记一抗过夜后,滴加2%BSA 37 ℃封闭20 min,滴加QD605-IgG (2% BSA稀释,1:100),37 ℃湿盒孵育60 min。之后DAPI染色方法同三步法。对照组中一抗采用TBS代替。
1.3.3 一步法标记首先制备量子点标记的一抗(QD605-PSCA), 具体步骤简述如下: ①量子点活化和纯化:将100 μl氨基量子点置于2 ml离心管内,加入配置好的10 mmol/L SMCC溶液11 μl,充分混匀,摇床反应1 h。离心将管壁内液体甩至底部,取出反应液加入至脱盐柱内,加入MES缓冲进行洗脱,收集有颜色的部分备用。②抗体还原和纯化:取300 μl (1 mg/ml,即300 μg)的抗体置于2 ml离心管内,加入配置好的1 mol/L DTT溶液6.1 μl,充分混匀,摇床反应0.5 h。离心将管壁内液体甩至底部,取出反应液加入至脱盐柱内洗脱,收集抗体部分备用。③偶联与纯化:将两种洗脱液取出置于2 ml离心管内混合,室温下摇床偶联反应1 h。根据分子尺寸大小,采用分子筛柱层析及超滤的方法除去未标记上的抗体得到量子点标记的一抗。QD605-PSCA标记BIU-87固定细胞实验步骤:固定细胞通透后,直接滴加QD605-PSCA (TBS稀释,1:50),4 ℃过夜。接着DAPI染色方法同三步法。对照组中QD605-PSCA分别用TBS和游离的QD605替代。
1.4 量子点免疫荧光一步法标记膀胱癌活细胞6孔板培养的BIU-87细胞生长汇合达70%左右时,弃原培养基,PBS洗涤(2 ×2 min),滴加培养基稀释的QD605-PSCA (1:50),37 ℃孵育30 min,PBS洗涤(3 ×3 min), 荧光显微镜下观察标记效果。阴性对照组为等比例稀释的游离的QD605。
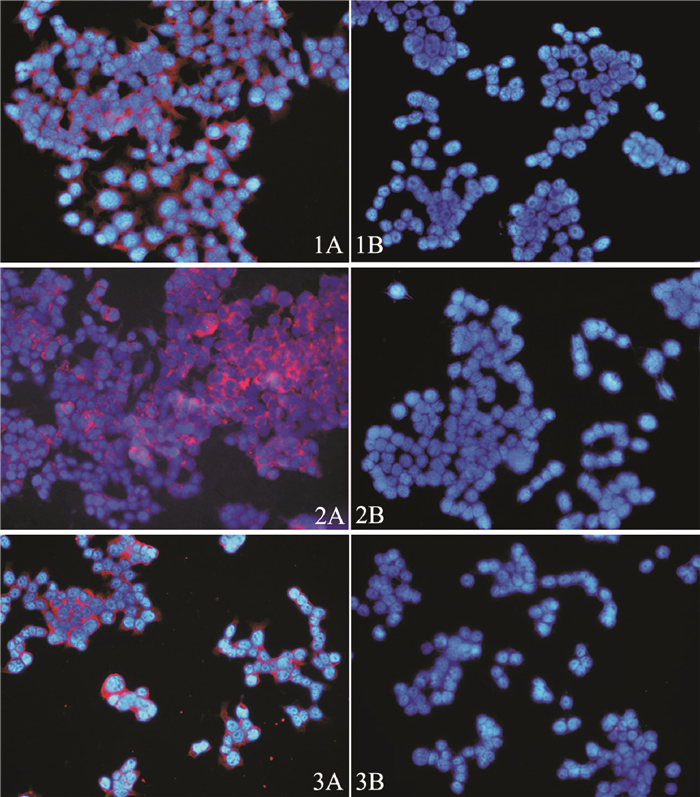
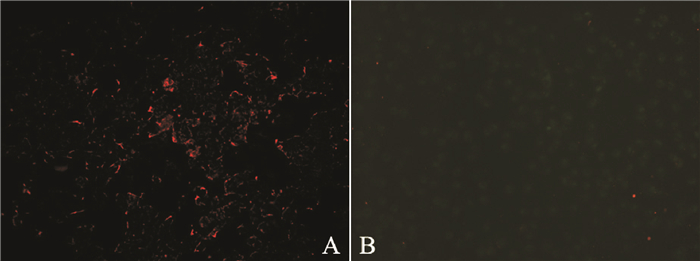
2 结果本实验中,将固定细胞切片置于激发光为紫外的荧光显微镜下观察,固定细胞量子点免疫荧光标记的PSCA特异性的表达于BIU-87细胞胞质或膜,三种方法实验组均能观察到表达部位明显的红色荧光,核为DAPI染色后表现出的蓝色荧光;对照组中标记的未经PSCA单抗连接的游离QD605,因在缓冲液的反复冲洗下,非特异性吸附的量子点和游离的量子点被冲洗掉,未见量子点发出的荧光,只见DAPI标记的细胞核所发出的蓝色荧光(图 1)。活细胞标记的细胞在蓝光激发下可见PSCA特异性的表达于细胞膜,可见一圈明显的橙红色荧光(图 2A),对照组细胞表现为与背景一致的绿色荧光,可见QD605少量吸附(图 2B)。
|
图 1 三种量子点免疫荧光法对BIU-87固定细胞PSCA抗原的标记 (×200,1A、1B:一步法;2A、2B:二步法;3A、3B:三步法) |
|
图 2 一步法量子点免疫荧光法BIU-87活细胞PSCA抗原的标记(×200) |
量子点是具有独特光学特性的半导体纳米晶体,由Ⅱ-Ⅵ(如CdSe、CdTe等)或Ⅲ-Ⅴ(如InP、InAs等)族元素组成,粒径一般介于1-10 nm之间。量子点激发光谱宽且连续,发射光谱窄且对称,这样在同时使用不同光谱特征的量子点时,不容易产生光谱重叠的现象;此外,量子点的荧光发射波长可以通过改变自身尺寸进行调节,因此可实现一元激发多元发射的同时标记或组分检测。量子点还具有荧光强度高且持续时间长、荧光稳定、抗光漂白能力强的特点;通过各种表面化学修饰,如偶联特异性抗体、多肽等,可以得到水溶性和生物相容性好的量子点,可对生物活体进行靶向标记和示踪检测[5-7]。目前相关研究也表明,功能化的量子点在常规实验使用浓度下标记活细胞几乎没有毒性,对细胞的增殖分化无明显影响[8, 9]。
本实验采用量子点(CdSe/ZnS,QD605)免疫荧光组织化学的方法,分别利用三种不同量子点免疫荧光标记方法检测了膀胱癌BIU-87细胞中PSCA的表达。PSCA在膀胱癌中过度表达,其表达水平的检测可以作为预测浅表性膀胱移行细胞癌复发的有价值的预后指标[10]。本实验结果显示, 利用量子点免疫荧光法可对癌细胞表面抗原进行特异性标记,本研究中对固定细胞荧光标记中,三种标记方法具有各自的特点,三步法实验技术成熟,量子点标记的链霉亲和素性质稳定,检测灵敏度高,但实验步骤繁琐,耗时较长,不宜用于进一步活细胞标记研究,活细胞长时间脱离培养环境以及实验过程中的反复冲洗,会导致细胞活性降低、脱壁、甚至死亡;二步法量子点免疫荧光标记,实验步骤和操作时间都相对有所减少,但量子点标记的二抗QD605-IgG性质不太稳定,非特异性吸附较强,标记后切片背景不清晰;一步法量子点直接标记一抗QD605-PSCA后与抗原结合,操作简便,省时,标记效果也明显,更适合活细胞标记,但是一步法标记一抗成本较贵,且对一抗的剂量要求较大。另外,QD605-PSCA荧光探针一步法标记膀胱癌BIU-87活细胞实验中,实验组活细胞可见一圈橙红色荧光,与背景自发绿色荧光形成鲜明对比,标记后继续培养48 h,仍可见到明显荧光,进一步表明了量子点荧光的稳定性,以及在体外活体动态示踪中的优势。另外,也显示出量子点单抗荧光探针在活体内肿瘤早期诊断、靶向定位、药物靶向治疗中巨大的应用价值,有可能成为体内肿瘤靶向研究的重要工具。
| [1] | Singh G, Kumar M, Soni U, et al. Cancer Cell Targeting Using Folic Acid/Anti-HER2 Antibody Conjugated Fluorescent CdSe/CdS/ZnS-MPA and CdTe-MSA Quantum Dots[J]. J Nanosci Nanotechnol, 2015, 15(12): 9382-9395. DOI: 10.1166/jnn.2015.10767. |
| [2] | Chen H, Xue J, Zhang Y, et al. Comparison of quantum dots immunofluorescence histochemistry and conventional immunohistochemistry for the detection of caveolin-1 and PCNA in the lung cancer tissue microarray[J]. J Mol Histol, 2009, 40(4): 261-268. DOI: 10.1007/s10735-009-9237-y. |
| [3] | Cheng F, Yu W, Zhang X, et al. Quantum-dot-based technology for sensitive and stable detection of prostate stem cell antigen expression in human transitional cell carcinoma[J]. Int J Biol Markers, 2009, 24(4): 271-276. |
| [4] | Qu YG, Zhang Q, Pan Q, et al. Quantum dots immunofluorescence histochemical detection of EGFR gene mutations in the non-small cell lung cancers using mutation-specific antibodies[J]. Int J Nanomedicine, 2014, 9: 5771-5778. |
| [5] | Cai W, Shin DW, Chen K, et al. Peptide-labeled near-infrared quantum dots for imaging tumor vasculature in living subjects[J]. Nano Lett, 2006, 6(4): 669-676. DOI: 10.1021/nl052405t. |
| [6] | Lu Z, Zhu Z, Zheng X, et al. Biocompatible fluorescence-enhanced ZrO2-CdTe quantum dot nanocomposite for in vitro cell imaging[J]. Nanotechnology, 2011, 22(15): 155604. DOI: 10.1088/0957-4484/22/15/155604. |
| [7] | Rosenthal SJ, Chang JC, Kovtun O, et al. Biocompatible quantum dots for biological applications[J]. Chem Biol, 2011, 18(1): 10-24. DOI: 10.1016/j.chembiol.2010.11.013. |
| [8] | Lei Y, Tang H, Yao L, et al. Applications of mesenchymal stem cellslabeled with Tat peptide conjugated quantum dots to cell tracking inmouse body[J]. Bioconjug Chem, 2008, 19(2): 421-427. DOI: 10.1021/bc0700685. |
| [9] | Yuan R, Yu WM, Cheng F, et al. Effect of quantum dots on the biological behavior of the EJ human bladder urothelial carcinoma cell line[J]. Mol Med Rep, 2015, 12(4): 6157-6163. |
| [10] | Elsamman E, Fukumori T, Kasai T, et al. Prostate stem cell antigen predicts tumour recurrence insuperficial transitional cell carcinoma of the urinary bladder[J]. BJU Int, 2006, 97(6): 1202-1207. DOI: 10.1111/bju.2006.97.issue-6. |
 2017, Vol. 38
2017, Vol. 38

 ,
,