我们前期研究发现,肝癌细胞在HBSS缓冲液中营养剥夺培养时,缺氧诱导因子(hypoxia inducible factor, HIF)-1α表达显著升高。而肿瘤在局部缺血、缺氧、乏营养微环境下,HIF-1α被视为促肿瘤侵袭、转移的关键细胞因子[1-3]。因而阐明肝癌细胞表达HIF-1α的机制有助于探寻减轻肝癌侵袭、转移的新方法。近来研究发现细胞因子信号转导抑制蛋白(suppressor of cytokine signaling,SOCS)是抑制炎症介质产生的关键蛋白分子,在肿瘤局部炎症性微环境中也显著表达[4, 5]。因此本研究以Hanks平衡盐缓冲液饥饿培养肝癌细胞以诱导肝癌细胞HIF-1α表达,同时应用脂氧素A4处理,观察其对营养剥夺条件下,肝癌细胞SOCS和HIF-1α表达的影响。另一方面应用RNA干扰技术抑制肝癌细胞SOCS表达,观察SOCS抑制后,脂氧素A4对营养剥夺处理的肝癌细胞HIF-1α表达的影响,并探讨其机制。
1 材料与方法 1.1 主要材料和试剂蛋白裂解液M-PER购自美国Thermo Pierce公司。HIF-1α一抗,SOCS一抗购自美国Abcam公司,相应的二抗购自武汉博士德生物工程有限公司。脂氧素A4购自上海抚生实业有限公司。超敏ECL化学发光试剂盒购自碧云天生物技术研究所。胎牛血清和高糖DMEM培养基购自美国Hyclone公司。Hanks平衡盐溶液购自美国Hyclone公司。去细胞因子基质胶购自美国Sigma-Aldrich公司。
1.2 细胞培养HepG2和BEL7402肝癌细胞系由华中科技大学同济医学院附属协和医院普通外科实验室保存提供。细胞培养于含10%胎牛血清的高糖DMEM完全培养基中,置于37 ℃, 5%CO2培养箱,2-3 d传代一次。
1.3 SOCS-siRNA的构建与转染SOCS基因的cDNA序列由Genbank (NW_007359841.1)获得,针对该序列的三种不同siRNA由在线RNAi设计算法设计(http://www.ambion.com/techlib/misc/siRNA_finder.html).所有设计siRNAs由上海吉玛生物制药有限公司合成纯化。合成纯化的siRNAs用全式金脂质体转染试剂盒依说明书(北京全式金生物技术有限公司)转染入HepG2和BEL7402细胞。经实时定量PCR鉴定,siRNA-SOCS序列:正义链:5′-AGTTACUGATCCUGATTA-3′, 反义链:5′-UTCCAGGTATAGCUAGGT-3′具有最佳干扰效率。再将siRNA-SOCS(100 nmol/L)用上述方法和试剂盒分别转染入HepG2和BEL7402细胞。细胞转染48 h后用于实验,细胞活性由台盼蓝染色鉴定。
1.4 肝癌细胞饥饿处理将转染与未转染的HepG2和BEL-7402细胞系按30 000/cm2密度接种于细胞培养瓶,以含10%胎牛血清的高糖DMEM完全培养液48 h后,将处于对数生长期的每种细胞用Hanks平衡盐溶液做饥饿处理。再将上述细胞加入或不加入脂氧素A4(100 nmol/L)孵育,以单纯饥饿处理组细胞作为对照。
1.5 Western Blotting细胞按上述分组处理8 h,洗涤加入蛋白裂解液提取总蛋白。蛋白定量后,煮沸变性后按30 μg/孔上样,经12% SDS-PAGE凝胶电泳后转移至PVDF膜,以5%脱脂奶粉封闭60 min,分别加入SOCS(1:1 000)一抗、HIF-1α(1:1 000)一抗,4 ℃孵育过夜,二抗室温孵育1 h后,ECL化学发光,以Bio-Rad荧光成像系统显影。
1.6 统计学处理数据以均数±标准差(x±s)表示,应用SPSS 11.0统计软件进行方差分析和t检验。以P<0.05为差异有统计学意义。
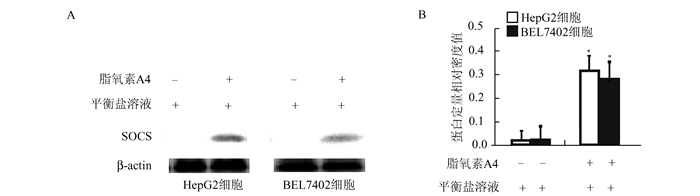
2 结果 2.1 脂氧素A4诱导肝癌细胞表达SOCS免疫蛋白印迹检测(图 1)显示,在单纯Hanks平衡盐溶液营养剥夺培养条件下,HepG2和BEL7402细胞,无显著SOCS表达,而联合脂氧素A4培养的HepG2和BEL7402细胞,SOCS的表达显著升高(P<0.05)。
|
图 1 脂氧素A4诱导肝癌细胞表达细胞因子信号转导抑制蛋白(SOCS) A:免疫蛋白印迹检测; B:蛋白印迹相对定量, *P<0.05 |
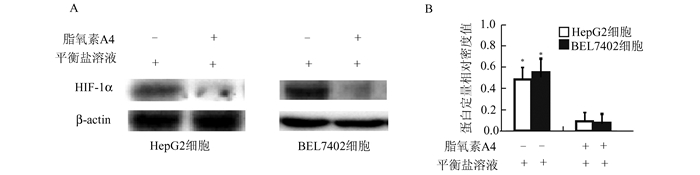
免疫蛋白印迹检测(图 2)显示,单纯Hanks平衡盐溶液营养剥夺培养8 h的HepG2和BEL7402细胞,HIF-1α呈现高表达,而联合脂氧素A4培养的HepG2和BEL7402细胞,HIF-1α的表达显著下调(P<0.05)。
|
图 2 脂氧素A4抑制营养剥夺培养诱导的肝癌细胞缺氧诱导因子-1α表达 A:免疫蛋白印迹检测; B:蛋白印迹相对定量, *P<0.05 |
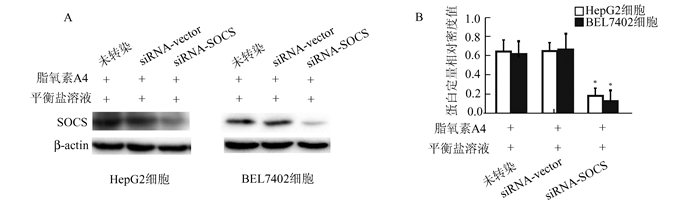
免疫蛋白印迹检测(图 3)显示,与未转染组和转染siRNA-Vector组比较,转染siRNA-SOCS后,即使经脂氧素A4孵育,HepG2和BEL7402细胞内SOCS的表达也明显受抑制(P<0.05)。
|
图 3 siRNA-SOCS抑制脂氧素A4诱导的SOCS表达 A:免疫蛋白印迹检测; B:蛋白印迹相对定量, *P<0.05 |
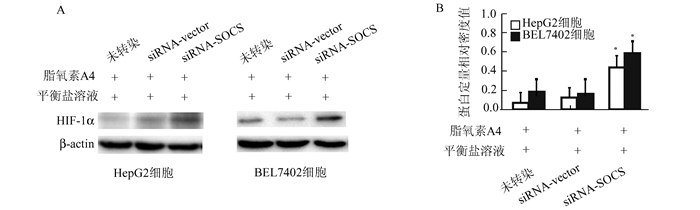
免疫蛋白印迹检测(图 4)显示,转染siRNA-SOCS,抑制肝癌细胞SOCS表达后,在联合脂氧素A4的Hanks平衡盐溶液培养下,HepG2和BEL7402细胞仍显著表达HIF-1α(P<0.05)。
|
图 4 siRNA-SOCS补救脂氧素A4抑制的缺氧诱导因子-1α表达 A:免疫蛋白印迹检测; B:蛋白印迹相对定量;*P<0.05 |
HIF-1α是在肿瘤局部缺血、缺氧及营养缺乏微环境中表达明显升高的细胞因子之一。近来多种研究发现“营养缺乏、乏氧-HIF通路”在肝癌的侵袭转移作用中扮演重要角色,HIF-1α可促进肝癌组织血管新生内皮形成,促进肿瘤新生血管形成而促进肝癌转移,同时HIF-1α可对抗凋亡,逃避免疫系统监视,增加侵袭力和转移能力,促进肝癌转移[1-3],因此阐明肝癌细胞在缺氧及营养缺乏微环境中HIF-1α表达的机制,有助于临床抑制肝癌转移治疗策略的开发,提高临床肝癌患者治疗效果,改善预后。
我们前期研究发现,HBSS缓冲液中营养剥夺培养肝癌细胞可显著诱导缺氧诱导因子-1α表达,并促进肝癌细胞侵袭力的增加,证实HIF-1α是肝癌细胞在局部营养缺乏环境下促进肝癌细胞侵袭的关键细胞因子。研究发现,脂氧素可抑制小鼠肝癌移植瘤的血管生成及肿瘤转移[6],在细胞水平则减弱肝癌细胞的侵袭[7]。而我们研究发现,脂氧素A4可显著抑制肝癌细胞在营养缺乏环境下表达HIF-1α,同时细胞因子信号转导抑制蛋白3的表达明显升高。如采用RNA干扰技术,在脂氧素A4孵育条件下抑制细胞因子信号转导抑制蛋白3的表达,则脂氧素A4对HIF-1α的表达抑制作用也明显减弱,提示脂氧素诱导细胞因子信号转导抑制蛋白3表达是抑制肝癌细胞HIF-1α表达的主要机制。而细胞因子信号转导抑制蛋白3表达的沉默则可使肝癌细胞在局部营养缺乏环境下诱导HIF-1α表达产生。
我们的研究也提示细胞因子信号转导抑制蛋白3作为细胞产生的反馈性抑制细胞因子信号转导的调节因子[8],在负性调节信号转导的同时,也可抑制相关细胞因子的表达。已知HIF-1α可激活PI3K/Akt等信号通路的活化[9],则表明细胞因子信号转导抑制蛋白对信号转导的抑制可发生在信号起始层面,直接抑制信号起始因子的表达。因此开发诱导细胞因子信号转导抑制蛋白表达和(或)抑制HIF-1α产生的临床策略,将有助于防治肝癌的侵袭、转移,提高肝癌治疗疗效,改善患者临床预后。
| [1] | Sitkovsky M, Lukashev D. Regulation of immune cells by local-tissue oxygen tension: HIF1 alpha and adenosine receptors[J]. Nat Rev Immunol, 2005, 5(9): 712-721. DOI: 10.1038/nri1685. |
| [2] | Nguyen DX, Bos PD, Massagué J. Metastasis: from dissemination to organ-specific colonization[J]. Nat Rev Cancer, 2009, 9(4): 274-284. DOI: 10.1038/nrc2622. |
| [3] | Zhang L, Hill RP. Hypoxia enhances metastatic efficiency by up-regulating Madm2in KHT cells and increasing resistance to apoptosis[J]. Cacer Res, 2004, 64(12): 4180-4189. |
| [4] | Yin Y, Liu W, Dai Y. SOCS3 and its role in associated diseases[J]. Hum Immunol, 2015, 76(10): 775-780. DOI: 10.1016/j.humimm.2015.09.037. |
| [5] | Lee JH, Kim C, Sethi G, et al. Brassinin inhibits STAT3 signaling pathway through modulation of PIAS-3 and SOCS-3 expression and sensitizes human lung cancer xenograft in nude mice to paclitaxel[J]. Oncotarget, 2016(8): 6386-6405. |
| [6] | Chen Y, Hao H, He S, et al. Lipoxin A4 and its analogue suppress the tumor growth of transplanted H22in mice: the role of antiangiogenesis[J]. Mol Cancer Ther, 2010, 9(8): 2164-2174. DOI: 10.1158/1535-7163.MCT-10-0173. |
| [7] | Zhou XY, Li YS, Wu P, et al. Lipoxin A(4) inhibited hepatocyte growth factor-induced invasion of human hepatoma cells[J]. Hepatol Re, 2009, 39(9): 921-930. DOI: 10.1111/hep.2009.39.issue-9. |
| [8] | Carow B, Rottenberg ME. SOCS3, a Major Regulator of Infection and Inflammation[J]. Front Immunol, 2014, 5: 58. |
| [9] | Courtnay R, Ngo DC, Malik N, et al. Cancer metabolism and the Warburg effect: the role of HIF-1 and PI3K[J]. Mol Biol Rep, 2015, 42(4): 841-851. DOI: 10.1007/s11033-015-3858-x. |
 2018, Vol. 39
2018, Vol. 39


