2. 华中科技大学同济医学院附属同济医院药剂科 湖北 武汉 430030
2. Dept. of Pharmacy, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
肿瘤微环境中的炎性反应在结直肠癌的发生发展过程中起到重要的作用。微环境中较低的淋巴细胞浸润预示着较弱的、不充分的抗肿瘤的免疫反应[1];而浸润的中性粒细胞和单核细胞则与肿瘤的发生和进展相关[2]。微环境中浸润的免疫细胞多是来自于外周血,外周血白细胞在针对肿瘤的系统性免疫应答中有重要意义[3]。已有研究表明,外周血的中性粒细胞与淋巴细胞的比值[4]以及淋巴细胞与单核细胞的比值[5]在结直肠癌中显示了较好的对预后的预测价值。
本研究将在一项来自中国人群的前瞻性研究中探讨外周血中淋巴细胞与单核细胞和中性粒细胞之和的相对数量与晚期结直肠癌预后的关系。
1 材料与方法 1.1 研究对象共有125例接受了FOLFIRI方案一线化疗并且有可用基线期血细胞计数的患者纳入研究。受试者均是病理确诊的转移性结直肠癌患者,2011-2014年期间就诊于华中科技大学同济医学院附属同济医院。
入组标准:病理确诊的结肠癌或者直肠癌;不可切除的转移灶;18-75岁;以实体瘤疗效评价标准1.1版(Response Evaluation Criteria In Solid Tumors 1.1, RECIST 1.1)[6]评估的可评估病灶;既往没有接受含伊立替康的化疗;卡氏评分(Karnofsky performance status, KPS)>60%或者东部合作肿瘤小组性能状态量表≤2;总胆红素≤1.5倍正常值上限(upper limit of normal, ULN);谷氨酸氨基转移酶和天冬氨酸氨基转移酶[(≤2.5倍ULN (当有肝转移时,≤5倍ULN)];肌酐清除率>50 ml/min或者血清肌酐≤1.5倍ULN。
本研究方案得华中科技大学伦理委员会的批准。所有受试者均签署了知情同意书。
1.2 疗效和生存的评估每名患者的疗效按照RECIST 1.1标准,每6-8周评估一次。通过计算机断层扫描或磁共振成像以及肿瘤标志物来评估。无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)是研究的共同终点。PFS定义为:从转移性结直肠癌的诊断开始至初次进展或者死亡;如果患者在末次随访依然存活且未发生进展事件,该条数据记为右删失。OS定义为:从转移性结直肠癌的诊断开始至死亡;如果患者在末次随访依然存活,该条数据记为右删失。
1.3 基线期的变量基线期的变量均收集于一线化疗开始之前,包括人口统计学特征,KPS评分,肿瘤相关的特征和疾病史。淋巴细胞与单核细胞和中性粒细胞之和的比值(lymphocyte-to-sum-of-monocyte-and-neutrophil, LTMNR)定义为外周血淋巴细胞的绝对计数与外周血单核细胞和中性粒细胞绝对计数之和的比值。考虑到外周血象容易受到急性感染、创伤后应激反应、细胞毒性药物和人粒细胞集落刺激因子等因素的影响,外周血细胞计数均是化疗前1月内的数据,且删除了有急性感染征象或应激性反应的记录。
1.4 统计学方法LTMNR的分界值由时间依赖的受试者工作特征曲线(receiver operating characteristic curve, ROC)分析确定。时间依赖的ROC分析通过R语言(3.0.2版)中的survival ROC数据包来实现(http://www.r-project.org)。LTMNR被分为≥0.6和 < 0.6的两组。用SPSS16.0软件(美国芝加哥,SPSS公司)进行统计学分析。临床病理学特征在LTMNR的两组间的差异通过卡方检验来分析。PFS和OS的生存曲线通过Kaplan-Meier方法绘制,组间差异通过log-rank检验计算。临床病理特征和预后的潜在关系通过单因素Cox回归模型进行分析。LTMNR对预后的预测价值通过调节了潜在混杂因素变量的多因素Cox回归模型评估。所有显著性检验均采用双侧概率检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 研究对象的一般特征基线期的人口统计学和临床病理特征如表 1所示。125例患者的中位年龄为49(18-72)岁,56.8%是男性,21.6%的KPS小于80%。90(72.0%)例被诊断为腺癌,20(16.0%)例为黏液腺癌或者印戒细胞癌,其余的是混合型或者未能识别型。原发灶以脾区为界,35(28.0%)例发生于右半结肠,90(72.0%)例发生于左半结肠(包括直肠)[7]。LTMNR的中位值是0.4(0.1-1.2)。123例作了疗效评估,3例达到完全缓解(CR,2.4%),37例达到部分缓解(PR,29.6%),56例病情稳定(SD,44.8%),27例病情进展(PD,21.6%)。2例未作评估的患者是由于不可耐受的副反应或其他的抗肿瘤治疗的干预导致其化疗小于4周期。
| 表 1 人口统计学和临床病理学特征 |
基于最大约登指数的时间依赖的ROC分析结果显示,最佳的LTMNR分界值是0.6。ROC曲线如图 1所示,曲线下面积(AUC=0.668)。所有患者被分为高LTMNR组(LTMNR≥0.6, n=22)和低LTMNR组(LTMNR < 0.6, n=103)。
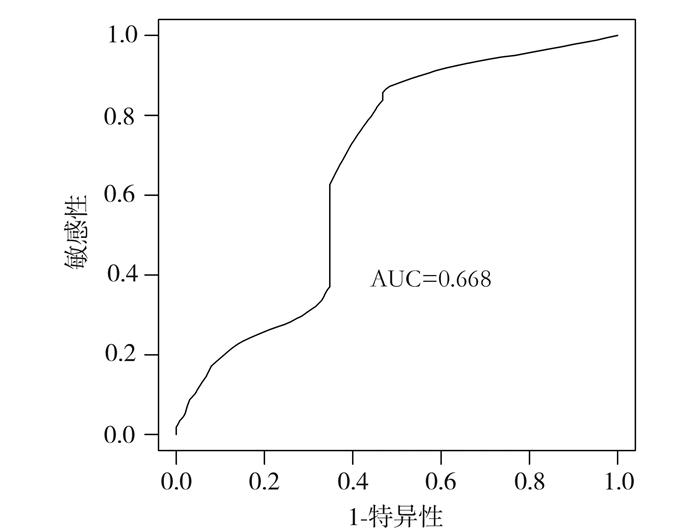
|
图 1 时间依赖的ROC确定LTMNR的分界值 |
如表 2所示,在单因素Cox回归分析中,年龄、性别、原发灶位置和组织学类型与PFS和OS无相关性。KPS评分较低的患者死亡风险增高,但未达统计学意义(P=0.059);KPS与PFS无明显相关性。低LTMNR组与高LTMNR组相比,疾病进展的风险[风险比(HR)=2.390; 95%置信区间(CI)=1.328-4.300; P=0.004]和死亡风险(HR=2.327; 95%CI=1.148-4.716; P=0.019)均升高。
| 表 2 临床特征在单因素分析中对于无进展生存期和总生存期的预测作用 |
如表 3所示,125例患者中,疾病进展事件和死亡事件分别是100例(80%)和70例(56%)。低LTMNR组与高LTMNR组相比,PFS较短(中位值:12.3月vs 7.9月);调节了年龄、性别、KPS、原发灶位置和组织学类型的多因素Cox回归分析显示低LTMNR组疾病进展风险增高了3倍(HR=3.025; 95%CI=1.672-5.626; P < 0.001)。低LTMNR组与高LTMNR组相比,OS较短(中位值:29.6月vs 18.0月);调节了年龄、性别、KPS、原发灶位置和组织学类型的多因素Cox回归分析显示低LTMNR组死亡风险进一步增高(HR=3.226; 95%CI=1.511-6.891; P=0.002)。低LTMNR和高LTMNR组的PFS和OS生存曲线分别如图 2A和2B所示。
| 表 3 LTMNR对无进展生存期(PFS)和总生存期(OS)的预测作用 |
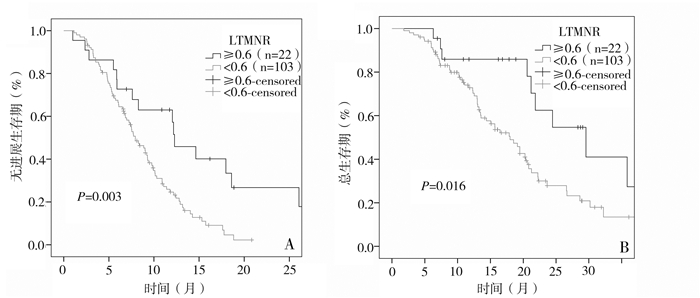
|
图 2 LTMNR在转移性结直肠癌中的预后作用 以LTMNR分界值分组的Kaplan-Meier生存曲线:PFS如(A)所示,OS如(B)所示。P是高LTMNR和低LTMNR两组比较的log-rank检验所得。 |
我们进一步分析了年龄、性别、KPS、原发灶位置和组织学类型在LTMNR两组人群中的分布差异。如表 4所示。LTMNR < 0.6组男性的比例更高(61.2 % vs 36.4%)。年龄、KPS、原发灶位置和组织学类型在两组间的分布无统计学差异。
| 表 4 临床病理特征在LTMNR较高和较低的两组间的分布差异[n(%)] |
在接受FOLFIRI方案一线化疗的转移性结直肠癌的中国人群中,我们发现LTMNR可将患者分成预后较差和预后较好的两组。低LTMNR组的PFS和OS较高LTMNR组分别短4.4月和11.6月。这种由单个血检结果识别的生存差异具有显著的临床意义。我们进一步分析了年龄、性别、KPS、原发灶部位和组织学类型在LTMNR较低和较高两组间的分布,发现只有性别在两组间有统计学差异,而性别并非结直肠癌预后相关的临床指标;结合调节了混杂因素的多因素分析的结果,我们得出LTMNR是转移性结直肠癌的独立的预后标志物。
关于外周血白细胞亚群间的比值与肿瘤预后的关系已经有较多的研究,这些研究均一致地显示,基线期外周血淋巴细胞的比例较高的人群其预后更好。如在弥漫大B细胞淋巴瘤[8]、经典型和结节型淋巴细胞为主型霍奇金淋巴瘤[9, 10],以及软组织肿瘤[11]中,淋巴细胞和单核细胞的比值(LMR)较高者预后较好;在小细胞肺癌[12]、肝细胞癌[13]、胰腺癌[14]以及结直肠癌[4]中,中性粒细胞与淋巴细胞比值(NLR)较低者预后较好。
LTMNR较高意味着升高的淋巴细胞和/或减少的单核和中性粒细胞。淋巴细胞在诱导细胞毒性的细胞死亡和抑制肿瘤细胞的增殖和迁移方面有重要的作用[2]。相反地,大量的中性粒细胞会抑制淋巴细胞或自然杀伤细胞的活性,利于肿瘤的生长[15]。有研究显示,肿瘤相关的中性粒细胞有促肿瘤效应,机制包括释放基因毒性活性氧,通过基质金属蛋白酶9诱导抗凋亡并促进肿瘤血管生成,通过中性粒细胞弹性蛋白酶促进肿瘤的生长、浸润和转移,以及抑制获得性免疫应答[16, 17]。巨噬细胞来源于单核-巨噬细胞系统,是单核细胞在组织中的进一步分化。肿瘤相关的巨噬细胞亦有促进肿瘤进展的作用,机制包括支持肿瘤新生血管形成,同时促进肿瘤细胞的浸润、迁移和穿透血管,或者抑制抗肿瘤的免疫应答[18]。另外,巨噬细胞可以产生SPARC/骨连接素,这对于转移灶的形成有重要作用[19]。粒细胞/巨噬细胞集落刺激因子作为重要的粒细胞/巨噬细胞的血源性调节因子在多种实体瘤中是一种不良的预后因素,包括结直肠癌。外周血的中性粒细胞和单核细胞的水平可反映肿瘤相关中性粒细胞和肿瘤相关巨噬细胞的相对数量,可以作为高肿瘤负荷的替代标志物。
我们的研究尚有不足。首先是病例数有限,故所得结果需在更大样本的研究中验证。该研究对于LTMNR分界值的选择,采用时间依赖的ROC方法获得兼顾敏感性和特异性的最佳分界值。在后续的研究中,该分界值需要进一步的验证或者根据不同的临床终点调整。尽管我们对于化疗前血细胞记录的纳入经过有经验的医师评估,排除了受到急性感染影响或者术后应激的血象,但是无法排除其他可能影响血细胞计数的混杂因素的干扰,如甲亢、糖尿病等代谢性疾病、风湿免疫性疾病、以及其他慢性或隐性感染。
化疗前的LTMNR是一项容易获得的且非常直观明了的临床指标。我们的研究表明较低的LTMNR在中国人群中是转移性结直肠癌患者预后不良的指标。该结果经过大样本的多中心临床试验验证后,对于临床医生判断患者预后有一定的指导意义。
| [1] | Hoffmann TK, Dworacki G, Tsukihiro T, et al. Spontaneous apoptosis of circulating T lymphocytes in patients with head and neck cancer and its clinical importance[J]. Clin Cancer Res, 2002, 8(8): 2553-2562. |
| [2] | Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7 203): 436-444. |
| [3] | Allavena P, Garlanda C, Borrello MG, et al. Pathways connecting inflammation and cancer[J]. Curr Opin Genet Dev, 2008, 18(1): 3-10. DOI: 10.1016/j.gde.2008.01.003. |
| [4] | Chua W, Charles KA, Baracos VE, et al. Neutrophil/lymphocyte ratio predicts chemotherapy outcomes in patients with advanced colorectal cancer[J]. Br J Cancer, 2011, 104(8): 1288-1295. DOI: 10.1038/bjc.2011.100. |
| [5] | Stotz M, Pichler M, Absenger G, et al. The preoperative lymphocyte to monocyte ratio predicts clinical outcome in patients with stage Ⅲ colon cancer[J]. Br J Cancer, 2014, 110(2): 435-440. DOI: 10.1038/bjc.2013.785. |
| [6] | Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI: 10.1016/j.ejca.2008.10.026. |
| [7] | Loupakis F, Yang D, Yau L, et al. Primary tumor location as a prognostic factor in metastatic colorectal cancer[J]. J Natl Cancer Inst, 2015, 107(3): dju427. DOI: 10.1093/jnci/dju427. |
| [8] | Li ZM, Huang JJ, Xia Y, et al. Blood lymphocyte-to-monocyte ratio identifies high-risk patients in diffuse large B-cell lymphoma treated with R-CHOP[J]. PLoS One, 2012, 7(7): e41658. DOI: 10.1371/journal.pone.0041658. |
| [9] | Porrata LF, Ristow K, Colgan JP, et al. Peripheral blood lymphocyte/monocyte ratio at diagnosis and survival in classical Hodgkin's lymphoma[J]. Haematologica, 2012, 97(2): 262-269. DOI: 10.3324/haematol.2011.050138. |
| [10] | Porrata LF, Ristow K, Habermann TM, et al. Peripheral blood lymphocyte/monocyte ratio at diagnosis and survival in nodular lymphocyte-predominant Hodgkin lymphoma[J]. Br J Haematol, 2012, 157(3): 321-330. DOI: 10.1111/bjh.2012.157.issue-3. |
| [11] | Szkandera J, Gerger A, Liegl-Atzwanger B, et al. The lymphocyte/monocyte ratio predicts poor clinical outcome and improves the predictive accuracy in patients with soft tissue sarcomas[J]. Int J Cancer, 2014, 135(2): 362-370. DOI: 10.1002/ijc.v135.2. |
| [12] | Kang MH, Go SI, Song HN, et al. The prognostic impact of the neutrophil-to-lymphocyte ratio in patients with small-cell lung cancer[J]. Br J Cancer, 2014, 111(3): 452-460. DOI: 10.1038/bjc.2014.317. |
| [13] | Gao F, Li X, Geng M, et al. Pretreatment neutrophil-lymphocyte ratio: an independent predictor of survival in patients with hepatocellular carcinoma[J]. Medicine, 2015, 94(11): e639. DOI: 10.1097/MD.0000000000000639. |
| [14] | Stotz M, Gerger A, Eisner F, et al. Increased neutrophil-lymphocyte ratio is a poor prognostic factor in patients with primary operable and inoperable pancreatic cancer[J]. Br J Cancer, 2013, 109(2): 416-421. DOI: 10.1038/bjc.2013.332. |
| [15] | Pillay J, Kamp VM, van Hoffen E, et al. A subset of neutrophils in human systemic inflammation inhibits T cell responses through Mac-1[J]. J Clin Invest, 2012, 122(1): 327-336. DOI: 10.1172/JCI57990. |
| [16] | Gungor N, Knaapen AM, Munnia A, et al. Genotoxic effects of neutrophils and hypochlorous acid[J]. Mutagenesis, 2010, 25(2): 149-154. DOI: 10.1093/mutage/gep053. |
| [17] | Kuang DM, Zhao Q, Wu Y, et al. Peritumoral neutrophils link inflammatory response to disease progression by fostering angiogenesis in hepatocellular carcinoma[J]. J Hepatol, 2011, 54(5): 948-955. DOI: 10.1016/j.jhep.2010.08.041. |
| [18] | Condeelis J, Pollard JW. Macrophages: obligate partners for tumor cell migration, invasion, and metastasis[J]. Cell, 2006, 124(2): 263-266. DOI: 10.1016/j.cell.2006.01.007. |
| [19] | Sangaletti S, Di Carlo E, Gariboldi S, et al. Macrophage-derived SPARC bridges tumor cell-extracellular matrix interactions toward metastasis[J]. Cancer research, 2008, 68(21): 9050-9059. DOI: 10.1158/0008-5472.CAN-08-1327. |
 2016, Vol. 37
2016, Vol. 37

 ,
,