2. McMaster大学 加拿大 安大略 汉密尔顿 L8N325
2. Farncombe Family Digestive Health Research Institute, Dept. of Medicine, McMaster University, Halimtin, L8S4L, Ontario, Canada
结肠作为下消化道的一部分,主要负责吸收水分及电解质,形成、储存及排泄粪便,这都与结肠动力有着不可或缺的关系,结肠的运动模式参与着各种生理及病理情况的发生,对人体的健康起着十分重要的作用。通过前期研究发现,大鼠结肠运动模式主要有长距离收缩(long distance contraction, LDC)、节律性运动复合波(rhythmic propulsive motor contraction, RPMC)、分节运动(segmentation)、微小波(ripple)及逆向收缩(retrograde contraction)[1],而LDC则是大鼠生理情况下最主要的运动模式,与结肠传输相关,理论上各种生理及病理因素均可使LDC发生变化,特别是胃肠营养物和药物,目前尚无此类研究报道。本实验通过观察酵母抽提物(YE)和肌源性药物氯贝胆碱(bethanechol)对LDC的影响,探讨LDC潜在发生机制,为阐述LDC的临床意义提供实验依据。
1 材料与方法 1.1 研究对象健康雄性Sprague Dawley大鼠40只,体重(200±30) g,由武汉大学实验动物中心提供,适应性喂养标准饲料3 d后,随机分3组,1组:酵母抽提物(yeast extract, YE)灌胃组(实验组)10只,用生理盐水同样灌胃处理(对照组)10只; 2组:基础状态+TTX+氯贝胆碱干预组10只(给药前后对比); 3组:从结肠中部将头尾端一分为二并排置入恒温槽中观察10只(头端尾端对比)。
1.1.1 酵母抽提物(YE)灌胃组实验组:0.1 mg YE溶入10 ml蒸馏水中,对照组:用0.9%生理盐水,两组均按1 ml/100 g体重的比例连续灌胃3 d,造模期间常规饲养。
1.1.2 TTX+氯贝胆碱组10只大鼠结肠均迅速离体后基础状态下观察30 min后,先后加入TTX 0.2 μmol/L及氯贝胆碱2 μmol/L,分别观察30 min,与给药前基础状态进行对比。
1.1.3 头尾端分段组将结肠离体后从中部一分为二,将头端结肠和尾端结肠同时并排置入同一恒温浴槽中,在相同的Krebs液体环境下,将两段结肠的头尾端分别接入灌注管和流出管,观察其基础状态下运动模式,未给予其他药物干预,观察头尾两段结肠运动变化。
1.2 主要试剂酵母提取物购自英国Oxoid公司,TTX购自上海宝曼生物科技有限公司,氯贝胆碱购自美国3B公司,配置PBS及Krebs所用的试剂均来自上海国药集团化学试剂有限公司。
1.3 方法 1.3.1 离体全结肠恒温浴槽实验所用大鼠均在禁食12 h后处死,分离全结肠,尽量去除黏膜,以防影响制图,头尾两端分别连接液体灌注管和流出管,固定在充氧(5%CO2加95%O2) Krebs液恒温37 ℃浴槽中,给予PBS腔内灌注一次,使其充盈于肠腔内,流出管液面距浴槽底部5 cm,可通过改变液面高度调整结肠腔内压,实验全程由摄像头记录,并通过软件转化为时空图。
1.3.2 时空图时空图由加拿大Farncombe Family Digestive Health Research Institute提供,它可将录像中全结肠各点直径y轴随时间x轴的变化编码成不同灰度影像[2]图像,越白结肠内径越大,越黑内径越小; 浴槽正上方摄像头记录实验全程。分析结肠主要运动模式LDC的特征,包括频率(次/min)、传播距离(cm)、传播时间(s)、传播速度(cm/s)和收缩强度(即gray value,由时空图Plot Profile读出)等。
1.3.3 实验方案1组即将YE灌胃组和生理盐水灌胃组的大鼠离体后分别置入恒温浴槽中,PBS灌注充盈,稳定10 min后,观察大鼠结肠的LDC模式; 2组即直接将大鼠结肠置于浴槽中观察,先观察基础状态LDC的发生,30 min后给予药物TTX 0.2 μmol/L,观察30 min后再给予药物氯贝胆碱2 μmol/L,继续观察,并与基础状态进行对比; 3组即将头尾端一分为二后分别置入浴槽中观察,不予任何干预措施。
1.3.4 统计学处理实验数据用SPSS 21.0软件及时空图相关软件分析,以均数±标准差(x±s)表示,LDC的参数间比较采用成组t检验,P < 0.05为差异有统计学意义。
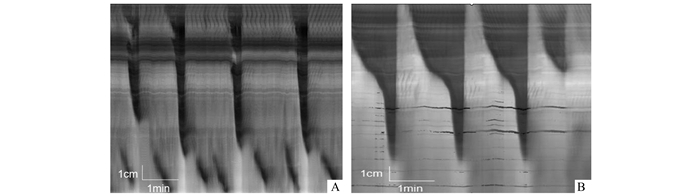
2 结果 2.1 LDC的基本特征LDC起自结肠头端,向下推进至少超过结肠全长的2/3,遂能将肠内容物迅速地推向结肠远端,促进排出; 其包括两部分:收缩时相(大约持续30 s)及随后而来的舒张时相(大约持续10 s)。本实验基础状态发现LDC的基本特征为:发生频率为(0.34±0.13)次/min,传播长度为(10.01±1.65) cm, 收缩持续时间为(32.14±8.48) s, 传播速度为(0.37±0.07) cm/s (见图 1A)。
|
图 1 YE灌胃组基础状态下LDC的特征性变化 A.对照组:显示正常状态下长距离收缩(LDC)的基本形态; B.YE灌胃组:YE灌胃3 d后,基础状态LDC收缩时间延长,收缩速度减慢,收缩强度增加 |
用酵母抽提物(YE)灌胃3 d急性造模后,与用生理盐水灌胃对照组相比,YE灌胃组LDC发生频率[(0.45±0.18)vs(0.32±0.13)次/min,P>0.05]和传播距离[(8.85±1.35)vs(9.92±1.56) cm,P>0.05]均无统计学差异; 但结肠收缩持续时间延长[(66.1±23.63)vs(34.1±10.44) s,P< 0.05],收缩速度下降[(0.18±0.08)vs(0.35±0.09) cm/s,P< 0.05],同时收缩强度增加[(11.43±17.28)vs(0.35±0.01),P< 0.05]。提示YE可减慢肠道推进性收缩运动(图 1)。
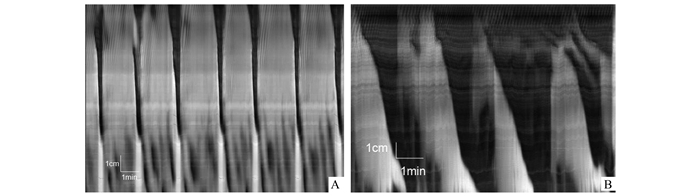
2.3 TTX+氯贝胆碱组基础状态下观察30 min后,加入神经阻断剂TTX,LDC完全消失,代之以高频的头端微小波; 再加入胆碱能M受体激活剂氯贝胆碱,可诱发结肠出现巨大的LDC样收缩运动,与基础状态LDC相比,加入TTX+氯贝胆碱后重新出现的LDC样运动收缩持续时间延长[(120.26±25.67)vs(30.18±6.51) s,P< 0.001],收缩速度减慢[(0.11±0.01)vs(0.39±0.04) cm/s,P< 0.001],发生频率减少[(0.22±0.09)vs(0.35±0.13)次/min,P>0.05]以及传播距离增加[(12.42±2.07)vs(10.09±1.74) cm,P>0.05], 但与基础状态相比无显著差异(图 2)。
|
图 2 加入TTX和氯贝胆碱后LDC的特征性变化 A.基础状态下LDC的基本形态; B.TTX+氯贝胆碱在加入神经阻断剂TTX后,阻断了结肠的收缩活动,LDC消失,代之以头端高频微小波(ripple); 在此基础上加入胆碱能M1受体激动剂氯贝胆碱后,结肠再次出现类LDC样的巨大收缩运动(如图所示),与基础状态相比,其收缩时间延长,收缩速度减慢,但频率和传播距离未有显著改变 |
近、尾端结肠均可以自发产生节律性LDCs,远端结肠与近端结肠相比,收缩频率和收缩长度无明显差异,分别为[(0.72±0.25)vs(0.54±0.18)次/min,P>0.05]和[(6.56±0.76)vs(6.86±0.72) cm,P>0.05],但收缩持续时间减短[(17.35±6.63)vs(37.6±13.68) s,P< 0.05], 收缩速度加快[(0.41±0.12)vs(0.21±0.1) cm/s, P < 0.05](图 3)。

|
图 3 近、远端结肠节律性LDCs的特征 A.近端结肠自发产生的节律性LDCs; B.远端结肠独立于近端结肠自发产生的节律性LDCs,传播速度增快,收缩持续时间缩短 |
本实验研究发现,大鼠结肠主要运动模式--节律性长距离收缩(LDC)可发生在不同药物干预状态和不同结肠节段。与正常大鼠结肠体外恒温浴槽内观察到的基础状态LDCs相比,酵母抽提物(YE)灌胃引发的LDC收缩持续时间延长,收缩速度下降,收缩强度增加,但发生频率和传播距离变化不大; 氯贝胆碱(Bethanechol)可恢复神经阻断剂TTX对LDC的完全抑制,代之以LDC样收缩运动,收缩持续时间延长,收缩速度减慢,但频率和传播距离无显著差异。将结肠均分为二,近远端均可产生节律性LDCs,远端结肠LDCs收缩持续时间减短, 收缩速度加快。
LDC作为大鼠结肠主要的推进性运动,可将肠内容物迅速向肛侧推进,促进结肠传输和排便。结肠运动主要由内在外在神经和肠肌层共同完成; 结肠离体实验证明,在没有中枢神经系统调控的情况下,结肠仍可自发产生节律性收缩,说明肠内在神经可独立控制结肠的运动模式,确保结肠在中枢失控等病理情况下仍能保持正常的功能[3]。近期实验表明[4],神经系统不是直接控制结肠平滑肌引发收缩,而是通过Cajal间质细胞(ICC)介导完成。因ICC分布与神经分布伴行[5],而又有结构与肠平滑肌细胞连接,推测ICC是平滑肌和神经组织的中介,通过自身起搏活性,介导了结肠平滑肌的收缩运动。ICC在肠平滑肌的各层均有分布,依LDCs发生的节律性和发生频率,本实验推测LDC是由ICC-肠肌层神经丛(ICC-MP)起搏介导产生[6],Plujà和Yoneda等实验证明ICC-MP是结肠推进性运动的起搏细胞[7, 8]。本实验利用Bethanechol恢复受TTX抑制的LDCs产生LDC样运动,揭示肌源性活性成分在没有神经介导状态下仍可产生长距离推进运动。提示恢复神经源性损伤结肠(如假性肠梗阻、Hirschsprung病)的传输功能是可行的。
酵母抽提物(YE)是以蛋白质含量丰富、核酸含量高的食用酵母(一般是啤酒酵母和面包酵母)为原料,采用生物技术,将酵母细胞内的蛋白质核酸等进行降解后精制而成的天然调味料。酵母抽提物营养丰富,含有18种以上氨基酸(其中富含谷物中含量不足的赖氨酸)、功能性多肽谷胱甘肽、抗衰老活性因子、膳食纤维葡聚糖和甘露糖,还含有人体不可缺少的核酸(RNA)、核苷酸和钙,富含B族维生素及磷、镁、锰、锌、硒等多种微量元素[9],是重要的营养物质,已被运用于食品调味品行业多年并深受消费者喜爱。本实验通过灌胃这一生理方式给予大鼠YE,观察其对结肠动力的影响,实验表明,YE灌胃引发的LDC收缩持续时间延长,收缩速度下降,收缩强度增加,但发生频率和传播距离变化不大; 提示YE可减慢结肠传输,增加营养物质在结肠的停留时间,促进吸收,这与YE的实际应用和临床观察一致。有趣的是,YE引发的LDCs与TTX和氯贝胆碱相互作用后的LDCs很相似,说明存在共同机制可能:可能二者抑制了神经源性活性,同时增强了与ICC-MP有关的肌源性活性。
氯贝胆碱是胆碱能M1受体激动剂,乙酰胆碱M受体在结肠平滑肌和ICC细胞中均有分布[10, 11],近年实验又在ICC-MP中发现胆碱能神经[2],故胆碱能神经参与结肠运动的调控,本课题组前期实验显示阿托品可以阻断LDC的产生[1]。本实验发现,在神经阻断剂TTX完全抑制了LDCs后,氯贝胆碱可恢复结肠推进性运动产生LDC样运动模式,传播速度稍慢,收缩持续时间延长,说明氯贝胆碱增强结肠肌源性收缩是独立于内外在神经控制的,依据频率特征推测ICC-MP介导该运动模式。
为进一步探讨LDCs发生的部位特征,本实验将结肠均分为二,同时并排置于同一恒温浴槽中,在相同的Krebs液环境中观察近远端结肠的运动模式,发现远侧端结肠也可自发产生节律性LDCs,收缩速度较快,收缩持续时间缩短,推测正常状态下近端结肠的起搏活性控制着远端结肠的自主性,维持结肠功能的一体性和协调性。远侧端自发节律性LDCs的特征在我课题组TNBS造模结肠炎实验中也得到确认[12]。这对炎症性肠病患者结肠动力紊乱的识别和处理有重要意义。
总之,本实验探究了不同状态下大鼠结肠体外主要运动模式LDC的特征,营养物质使LDCs推进缓慢、利于吸收、神经阻断TTX药物可完全抑制LDCs,但肌源性药物可在此基础上恢复LDC样运动,使结肠发挥正常传输功能。不仅近端结肠,远端结肠也可独立产生节律性LDCs,为临床诊治提供了新的思路和证据。
| [1] | Chen JH, Zhang Q, Yu YJ, et al. Neurogenic and myogenic properties of pan-colonic motor patterns and their spatiotemporal organization in rats[J]. PLoS One, 2013, 8(4): e60474. DOI: 10.1371/journal.pone.0060474. |
| [2] | Huizinga JD, Martz S, Gil V, et al. Two independent networks of interstitial cells of cajal work cooperatively with the enteric nervous system to create colonic motor patterns[J]. Front Neurosci, 2011, 5: 93-107. |
| [3] | 张倩, 陈继红, 李孔玲, 等. 大鼠远段结肠体外运动模式的实验研究[J]. 武汉大学学报:医学版, 2013, 34(5): 670-673. |
| [4] | Sanders KM, Koh SD, Ro S, et al. Regulation of gastrointestinal motility--insights from smooth muscle biology[J]. Nat Rev Gastroenterol Hepatol, 2012, 9(11): 633-645. DOI: 10.1038/nrgastro.2012.168. |
| [5] | Huizinga JD, Zarate N, Farrugia G. Physiology, Injury, and Recovery of Interstitial Cells of Cajal: Basic and Clinical Science[J]. Gastroenterology, 2009, 137(5): 1548-1556. DOI: 10.1053/j.gastro.2009.09.023. |
| [6] | Huizinga JD, Chen J. Interstitial Cells of Cajal: Update on Basic and Clinical Science[J]. Current Gastroenterology Reports, 2014, 16(1): 1-11. |
| [7] | Plujà L, Albertí E, Fernández E, et al. Evidence supporting presence of two pacemakers in rat colon[J]. Am J Physiol Gastrointest Liver Physiol, 2001, 281: G255-G266. |
| [8] | Yoneda S, Fukui H, Takaki M. Pacemaker activity from submucosal in terstitial cells of Cajal drives high-frequency and low-amplitude circular muscle contractions in the mouse proximal colon[J]. Neurogastroenterol Motil, 2004, 16: 621-627. DOI: 10.1111/nmo.2004.16.issue-5. |
| [9] | 钱敏, 白卫东, 蔡培钿, 等. 酵母抽提物的研究概况[J]. 肉类研究, 2009(2): 84-88. |
| [10] | Epperson A, Hatton WJ, Callaghan B, et al. Molecular markers expressed in cultured and freshly isolated interstitial cells of Cajal[J]. Am J Physiol Cell Physiol, 2000, 279: 529-539. |
| [11] | McKay CM, Huizinga JD. Muscarinic regulation of ether-a-go-go-related gene K+ currents in interstitial cells of Cajal[J]. J Pharmacol Exp Ther, 2006, 319: 1112-1123. DOI: 10.1124/jpet.106.109322. |
| [12] | 杨自仙, 王鹏宇, 陈继红, 等. 三硝基苯磺酸所致狭窄对大鼠结肠运动模式的影响[J]. 武汉大学学报:医学版, 2014, 35(6): 835-838. |
 2016, Vol. 37
2016, Vol. 37

 ,
,