血流感染是临床上常见的严重感染性疾病。当血流感染进展为脓毒性休克或多器官功能衰竭时病死率可达40%-50%[1]。若感染早期未能正确识别致病菌类型并针对性给予抗感染治疗,可导致血流感染病死率升高[2]。因此,能早期提示血流感染致病菌类型的炎症指标可为临床医师准确选择抗感染治疗方案提供参考依据,从而改善疾病预后。本研究回顾性分析武汉大学中南医院收治的409例血培养阳性且为单一致病菌的血流感染患者,探讨降钙素原等炎症指标鉴别血流感染致病菌类型的临床价值,现将结果报道如下。
1 资料与方法 1.1 一般资料本研究采用回顾性研究方法,选取2013年1月至2014年9月武汉大学中南医院收治的血培养阳性且为单一致病菌的血流感染患者。收集患者临床资料并记录确诊血流感染24 h内降钙索原(PCT)、C反应蛋白(CRP)等炎症指标的结果。经正规抗生素治疗后,若同一患者1周内有2次及以上血培养及血液检查结果,仅记录第一次血培养及该次血培养送检24 h内血液检测结果。排除标准:年龄 < 18岁; 1周内有重大手术史; 甲状腺肿瘤或肿瘤伴副癌综合征者。
1.2 检查方法 1.2.1 血培养血培养标本置于BD BACTE9240全自动血培养仪进行培养,如有阳性警报,将血培养标本转至培养基(肺炎链球菌培养基加用5%脱纤维羊血)继续培养,VITEK 2 Compact全自动微生物分析仪及配套鉴定卡鉴定菌株。
1.2.2 PCT采用法国bioMerieux公司VIDAS PC OPERATION全自动免疫分析仪及配套试剂,免疫荧光分析法检测,正常参考值0-0.05 ng/ml。
1.2.3 CRP采用日本OLYMPUS公司AU5400全自动生化仪及配套试剂,胶乳免疫比浊法检测,正常参考值0-10 mg/L。
1.2.4 ESR采用意大利Vital Diagnostics公司Monitor-20全自动血沉仪,红外线障碍法检测,正常参考值0-20 mm/h。
1.2.5 血常规采用美国Beckman公司LH750血细胞分析仪检测,白细胞(WBC)计数正常参考值(4-10)×109/L,中性粒细胞百分比(NEU%)正常参考值40%-70%。
1.3 统计学方法Excel 2010软件整理资料,SPSS 17.0统计软件处理数据。符合正态分布的计量资料用均数±标准差(x±s)描述,组间比较采用单因素方差分析检验; 非正态分布的计量资料以中位数(四分位间距)[M (Q25%-Q75%)]表示,组间比较采用Mann-Whitney检验。计数资料比较采用卡方(χ2)检验。绘制炎症指标鉴别血流感染致病菌类型的受试者工作特征(ROC)曲线,根据曲线下面积(AUC)值评价各指标鉴别血流感染致病菌类型的诊断价值。根据Youden指数计算最佳诊断临界值(cut-off值)、灵敏度和特异度。以P<0.05为差异有统计学意义。
2 结果 2.1 一般情况本研究共纳入409例血流感染患者,男性247例,女性162例。年龄(63.5±19.4)岁。各组间性别与年龄无统计学差异(P>0.05)。共分离G-菌187株,G+菌181株,真菌41株,分别占总菌株数的45.7%、44.3%和10.0%。细菌中以凝固酶阴性葡萄球菌、大肠杆菌及金黄色葡萄球菌最为常见。真菌组中近平滑假丝酵母菌最常见。各种致病菌所致的血流感染中,大肠杆菌与肺炎克雷伯菌可致患者血清PCT水平明显升高,分别为8.84(1.20-52.23) ng/ml和15.29(4.48-123.88) ng/ml,见表 1。
| 表 1 血流感染主要致病菌分布 |
血清PCT水平在G-菌组、G+菌组及真菌组分别为5.01(0.59-29.84), 0.50(0.13-2.94)和0.91(0.17-2.18) ng/ml; 血清CRP水平在3组中分别为(69.2±33.6), (46.0±32.5)和(30.0±26.8) mg/L。统计结果显示G-菌组血清PCT与CRP水平均明显高于G+菌组及真菌组(均P<0.001)。ESR水平及WBC计数在3组间无统计学差异,见表 2。
| 表 2 G-菌组、G+菌组与真菌组各项炎症指标比较 |
ROC曲线结果显示,血清PCT水平鉴别G-菌与G+菌所致血流感染的AUC值为0.724(95%CI:0.619-0.830)。当PCT水平大于cut-off值2.59 ng/ml,其诊断G-菌性血流感染的灵敏度与特异度分别为51.0%和85.7%(P<0.001)。CRP鉴别G-菌所致血流感染的诊断价值相对较低,其AUC值为0.680(95%CI 0.565-0.796)。当血清CRP水平大于cut-off值59.25 mg/L,诊断血流感染致病菌类型为G-菌的灵敏度与特异度分别为67.7%和68.6%(P<0.01)。血清PCT和CRP水平亦可用于鉴别G-菌与真菌所致血流感染。当血清PCT水平>3.11 ng/ml,鉴别G-菌与真菌所致血流感染的灵敏度与特异度分别为65.4%和87.2%(P<0.001)。当血清CRP水平>52.25 mg/L,鉴别G-菌与真菌所致血流感染的灵敏度与特异度分别为72.5%和85.7%。见表 3。血清PCT及CRP均不能有效鉴别G+菌与真菌所致的血流感染(P>0.05)。
| 表 3 炎症指标鉴别血流感染致病菌类型 |
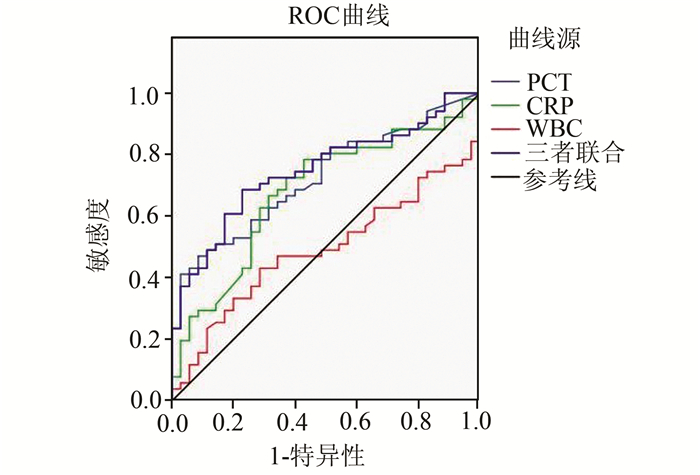
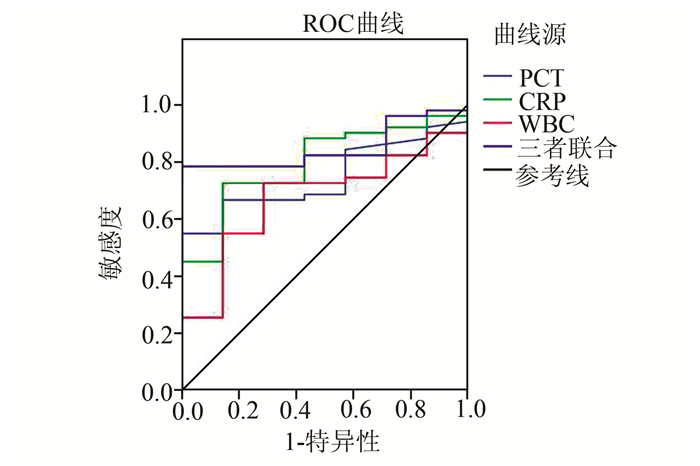
血清PCT、CRP与WBC计数三项联合鉴别G-菌与G+菌所致血流感染具有较高的准确性,其AUC值为0.749(95%CI:0.647-0.851)。当PCT、CRP与WBC计数分别取2.59 ng/ml、59.25 mg/L与12.41×109/L为cut-off值,诊断的灵敏度与特异度分别为70.8%和82.9%(P<0.001),见图 1。当PCT、CRP与WBC计数分别取3.11 ng/ml、52.25 mg/L与11.20×109/L为cut-off值,三项联合鉴别G-菌与真菌所致血流感染AUC值为0.849(0.747-0.951),诊断的灵敏度与特异度分别为78.4%和100%(P<0.005),见图 2。
|
图 1 PCT、CRP、WBC计数和三项指标联合鉴别G-菌与G+菌的ROC曲线 |
|
图 2 PCT、CRP、WBC计数和三项指标联合鉴别G-菌与真菌的ROC曲线 |
血流感染是临床上常见的危重症。不同致病菌类型所致的血流感染病死率有所差异。与革兰阳性菌相比,革兰阴性菌所致血流感染病情进展更加迅速,病死率更高[3]。因此,早期识别血流感染致病菌类型并针对性给予抗感染治疗对改善预后极其重要。血培养虽为确诊血流感染及鉴定致病菌类型的“金标准”,但培养周期长、阳性率低,并不能在疾病早期为抗感染治疗提供准确信息。PCT、CRP等炎症指标在临床被广泛应用,本研究旨在探讨上述指标鉴别血流感染致病菌类型的临床价值。
PCT是降钙素的前体物质,主要由甲状腺C细胞分泌。肝脏、肾脏等器官的实质细胞在炎症刺激下也可以合成并释放PCT[4]。正常情况下,体内血清PCT水平极低,通常 < 0.05 ng/ml。当机体受炎症刺激,血清PCT水平可在炎性细胞因子的刺激下明显升高[5]。已有研究表明,血流感染患者PCT水平可因致病菌类型不同而各有差异[6, 7]。本研究对不同致病菌所致血流感染患者的血清PCT水平进行分析,结果显示G-菌感染患者血清PCT水平较G+菌与真菌感染患者明显升高。进一步研究发现,PCT在鉴别血流感染致病菌革兰染色类型时具有中等准确性。以2.59 ng/ml作为PCT判断G-菌性血流感染的最佳诊断截断值,其灵敏度及特异度分别为51.0%和85.7%(P<0.001)。
G-菌与G+菌感染导致患者血清PCT水平不同程度升高,原因可能与G-菌和G+菌分别激活不同的炎症信号通路有关[8]。G-菌感染机体后释放大量内毒素,其主要成分为脂多糖(LPS)。LPS与Toll样受体-4(TLR-4)结合,激活炎症信号转导通路,诱导机体大量合成并释放PCT和IL-6、TNF-α等炎症介质,使机体出现不同程度的炎症反应[9]。G+菌细胞壁主要由肽聚糖构成,G+菌感染机体时肽聚糖与TLR-2结合,激活不同的信号通路,诱导PCT合成和释放的程度不如LPS强烈[10]。
本研究同时探讨了PCT鉴别G-菌和真菌感染所致血流感染的灵敏度与特异度。根据ROC曲线,当血清PCT水平>3.11 ng/ml,诊断G-菌所致血流感染的灵敏度与特异度分别为65.4%和87.2%(P<0.001)。对于PCT能否鉴别G+菌与真菌所致的血流感染本研究也进行了探讨,结果显示PCT不能有效地区分出G+菌与真菌所致的血流感染。分析导致上述结果的原因可能有两点:首先,G+菌与真菌细胞壁均无LPS成分,感染机体后均诱导血清PCT水平轻度升高[7, 11]。其次,真菌对血清PCT水平的影响尚不完全确定。本研究结果显示,真菌感染可导致血清PCT水平升高。而Martini[12]等人研究发现PCT在真菌感染期间呈持续低水平。Marková[13]等人研究发现,免疫缺陷患者感染真菌后血清PCT水平基本不升高。因此PCT鉴别诊断真菌感染的临床价值有待进一步探讨。但需要注意的是,长期使用抗生素可增加真菌感染的风险,若经长期抗感染治疗后血清PCT仍维持在较高水平,需考虑合并真菌感染的可能。
CRP是肝脏合成的急性炎症反应期的非特异性标志之一,常用于感染性疾病的早期诊断。本研究中,细菌感染可使血清CRP水平明显升高,且G-菌性血流感染患者血清CRP水平升高更明显。CRP鉴别血流感染致病菌类型诊断价值偏低。CRP用于鉴别G-菌与G+菌所致血流感染,取CRP水平>59.25 mg/L,诊断致病菌类型为G-菌的灵敏度与特异度分别为66.7%和68.6%(P<0.01)。CRP用于鉴别G-菌与真菌所致血流感染,取CRP水平>52.25 mg/L,诊断G-菌所致血流感染的灵敏度与特异度分别为72.5%和85.7%。研究也显示,心血管疾病与自身免疫性疾病等亦可导致血清CRP水平升高[14],使CRP鉴别血流感染致病菌类型的临床价值受到局限。
血清PCT、CRP及WBC计数水平在细菌感染时均明显升高,为了研究三者联合在鉴别血流感染致病菌类型中的临床价值,建立了三者联合鉴别血流感染致病菌类型的ROC曲线。结果显示三项指标联合测定可提高鉴别血流感染致病菌类型的准确性。通过选定PCT等炎症指标的cut-off值,三项炎症指标联合测定较单一指标测定具有更准确的诊断灵敏度与特异度。
综上所述,血清PCT水平对于鉴别血流感染致病菌类型具有一定的临床价值。虽然血培养等微生物检查仍为确诊血流感染致病菌类型的金标准,但血清PCT等炎症指标联合检测能在感染早期为临床医师经验性抗感染治疗提供较为准确的指导。通过选定特定的PCT、CRP与WBC计数cut-off值,三项指标联合可更准确的鉴别血流感染致病菌类型。
| [1] | Cohen J, Vincent JL, Adhikari NK, et al. Sepsis: a roadmap for future research[J]. Lancet Infect Dis, 2015, 15(5): 581-614. DOI: 10.1016/S1473-3099(15)70112-X. |
| [2] | Timsit JF, Soubirou JF, Voiriot G, et al. Treatment of bloodstream infections in ICUs[J]. BMC Infect Dis, 2014, 14: 489. DOI: 10.1186/1471-2334-14-489. |
| [3] | Olsen MA, Krauss M, Agniel D, et al. Mortality associated with bloodstream infection after coronary artery bypass surgery[J]. Clin Infect Dis, 2008, 46(10): 1537-1546. DOI: 10.1086/589465. |
| [4] | Henriquez-Camacho C, Losa J. Biomarkers for sepsis[J]. Biomed Res Int, 2014, 2014: 547 818. |
| [5] | Soreng K, Levy HR. Procalcitonin: an Emerging Biomarker of Bacterial Sepsis[J]. Clinical Microbiology Newsletter, 2011, 33: 171-178. DOI: 10.1016/j.clinmicnews.2011.10.004. |
| [6] | Brodská H, Malí ková K, Adámková V, et al. Significantly higher procalcitonin levels could differentiate Gram-negative sepsis from Gram-positive and fungal sepsis[J]. Clin Exp Med, 2013, 13(3): 165-170. DOI: 10.1007/s10238-012-0191-8. |
| [7] | Leli C, Ferranti M, Moretti A, et al. Procalcitonin levels in gram-positive, gram-negative, and fungal bloodstream infections[J]. Dis Markers, 2015, 2015: 701 480. |
| [8] | Beran O, Potměšil R, Holub M, et al. Differences in Toll-like receptor expression and cytokine production after stimulation with heat-killed Gram-positive and Gram-negative bacteria[J]. Folia Microbiol (Praha), 2011, 56(3): 283-287. DOI: 10.1007/s12223-011-0025-1. |
| [9] | Kumar S, Ingle H, Prasad DV, et al. Recognition of bacterial infection by innate immune sensors[J]. Crit Rev Microbiol, 2013, 39(3): 229-246. DOI: 10.3109/1040841X.2012.706249. |
| [10] | Tavares E, Maldonado R, Ojeda ML, et al. Circulating inflammatory mediators during start of fever in differential diagnosis of gram-negative and gram-positive infections in leukopenic rats[J]. Clin Diagn Lab Immunol, 2005, 12(9): 1085-1093. |
| [11] | Guo SY, Zhou Y, Hu QF, et al. Procalcitonin is a marker of gram-negative bacteremia in patients with sepsis[J]. Am J Med Sci, 2015, 349(6): 499-504. DOI: 10.1097/MAJ.0000000000000477. |
| [12] | Martini A, Gottin L, Menestrina N, et al. Procalcitonin levels in surgical patients at risk of candidemia[J]. J Infect, 2010, 60(6): 425-430. DOI: 10.1016/j.jinf.2010.03.003. |
| [13] | Marková M, Brodská H, Malíčková K, et al. Substantially elevated C-reactive protein (CRP), together with low levels of procalcitonin (PCT), contributes to diagnosis of fungal infection in immunocompromised patients[J]. Support Care Cancer, 2013, 21(10): 2733-2742. DOI: 10.1007/s00520-013-1844-1. |
| [14] | Limper M, de Kruif MD, Duits AJ, et al. The diagnostic role of procalcitonin and other biomarkers in discriminating infectious from non-infectious fever[J]. J Infect, 2010, 60(6): 409-416. DOI: 10.1016/j.jinf.2010.03.016. |
 2016, Vol. 37
2016, Vol. 37
