2. 武汉大学人民医院麻醉科 湖北 武汉 430060
2. Dept. of Anesthesiology, Renmin Hospital of Wuhan University, Wuhan 430060, China
糖尿病患者极易合并心肌缺血再灌注损伤ischemia/reperfusion, I/R,尽管目前有许多药物治疗手段可以选择,但糖尿病患者心肌梗死的发病率仍是非糖尿病患者的两倍[1]。诸多研究证实,糖尿病病程弱化了心肌内源性抗凋亡的信号通路的作用。PI3K/Akt信号通路是重要的促生存信号通路,而PI3K/Akt通路失活是糖尿病患者心肌缺血性损伤加重的重要因素[2, 3]。新近研究发现组蛋白去乙酰化酶(histones deacetylases, HDAC)可以影响Akt的磷酸化程度,即Akt的活化程度。Akt下游有许多磷酸化靶点,其中包括Gsk3β,Bcl-2等。Gsk3β能起到线粒体稳定作用,如GSK-3β磷酸化失活,将导致线粒体内膜上通透性转化孔开放,从而引起线粒体毁灭性的损伤[4]。
1 材料与方法 1.1 主要试剂链脲佐菌素粉剂(STZ), 戊巴比妥钠粉剂,伊文斯蓝,2, 3, 5-三苯基氯化四氮唑(TTC),均购置于美国Sigma公司。HDAC抑制剂Trichostatin A (TSA)和Akt抑制剂MK-2206购置于美国Selleck试剂公司。蛋白抗体Akt, p-Akt (ser473), Gsk3β, p-Gsk3β (Ser9)购置于美国Cell Signaling Technology (CST)公司。Bax,Bcl-2抗体购置于美国Sigma公司。Tunel试剂盒购置于美国罗氏(Roche)公司。血清乳酸脱氢酶(LDH),肌酸激酶同工酶(CKMB)检测试剂盒购置于南京建成试剂有限公司。
1.2 模型制备及实验方法 1.2.1 糖尿病大鼠模型42只健康雄性SD大鼠(SPF级),体重200-220 g,腹腔注射链脲佐菌素,剂量为60 mg/kg,3 d后尾静脉采血检测大鼠血糖水平,若血糖≥16.7 mmol/L认为糖尿病大鼠模型建立成功,每周监测记录大鼠血糖和体重,饲养周期为8周。
实验分组:动物实验:①糖尿病大鼠假手术组(DS组,n=6):糖尿病大鼠麻醉开胸后只穿线不结扎左前降支(LAD);②糖尿病大鼠心肌缺血再灌注组(DIR组,n=12):糖尿病大鼠麻醉开胸后,穿线并结扎LAD;③糖尿病大鼠心肌缺血再灌注+HDAC抑制剂组(DIR+TSA, n=12);④糖尿病大鼠心肌缺血再灌注+HDAC抑制剂+Akt抑制剂组(DIR+TSA+ MK-2206, n=12)。缺血/再灌注时间为30 min/120 min,糖尿病大鼠在手术前48 h,24 h,1 h三次腹腔注射TSA (1 mg/kg),手术前20 min股静脉给予MK-2206(300 μg/kg)。
1.2.2 大鼠心肌缺血再灌注模型腹腔注射1%戊巴比妥钠(40 mg/kg),固定后连接心电导联,行呼吸机通气,分离股静脉并置管。开胸结扎LAD,心电图见到明显的ST短下移则认为造模成功。结扎时间为30 min,松开线结再灌注120 min建立心肌缺血再灌注脑损伤模型。
1.2.3 心肌梗死面积的确定随机取各缺血再灌注组大鼠6只,缺血再灌注结束后,原位结扎冠脉左前降支,股静脉快速推注5%伊文斯蓝0.8-1.0 ml,待肉眼观能明显区分心肌蓝染和非蓝染区后,止血钳夹闭主动脉弓,快速取心,用4 ℃PBS溶液冲洗干净,垂直放置于-20 ℃冰箱30 min;取出冰冻心脏,置于特制心脏切片槽中,将心脏沿横断面切成5-6片约1 mm厚的薄片,放入1%TTC溶液中37 ℃温箱避光孵育15 min;甲醛固定,Image-Pro Plus 6.0计算心肌各区域面积。
1.2.4 蛋白检测采用Western blot法检测p-Akt,Akt,Gsk3β,p-Gsk3β,凋亡相关蛋白Bax、Bcl-2的表达量。裂解液冰浴提取新鲜心肌组织蛋白,测定蛋白浓度。采用聚丙烯酞胺凝胶电泳分离目的蛋白。冰浴恒流转膜,5%脱脂奶粉室温封闭1-2 h。一抗4 ℃孵育过夜,抗体均按照说明书推荐比例稀释。次日取出TBST清洗3 min×5次,荧光二抗孵育1 h后,TBST清洗3 min×5次,红外成像系统扫膜,读取灰度值,用Odessay软件进行数据分析。
1.2.5 TUNEL法检测组织凋亡指数4%多聚甲醛固定过夜,制备石蜡切片,按照TUNEL试剂盒说明书检测凋亡指数,滴加新鲜稀释蛋白酶K,37 ℃孵育10 min,加入反应混合液,37 ℃孵育60 min,加入转化剂,37 ℃孵育30 min,DAB显色。
1.3 数据统计与分析所有数据以均数±标准误(x±s)表示,数据分析均采用GraphPad Prism 6.0软件进行,组间比较采用方差分析。P<0.05则认为差异具有统计学意义。
2 结果 2.1 心肌梗死面积(IS)及心肌坏死标记物的释放的测定缺血再灌注后用TTC法测定心肌的梗死面积,结果显示,TSA预处理能够降低大鼠心肌梗死面积(DIR vs DIR+TSA,P<0.05,表 1),而这一保护作用能够被Akt抑制剂MK-2206拮抗(DIR+TSA vs DIR+TSA+MK,P<0.05)。MI/R损伤造成糖尿病大鼠心肌坏死标记物的释放显著增加(DS vs DIR,P<0.05,表 1),而给予TSA能够降低心肌酶的释放(DIR vs DIR+TSA,P<0.05),但这一保护性的措施被MK-2206预处理所拮抗(DIR+TSA vs DIR+TSA+MK,P<0.05)。
| 表 1 心肌梗死面积(IS)及心肌坏死标记物的释放 |
手术结束后取各组心肌组织进行TUNEL染色,免疫印迹定量抗凋亡蛋白Bcl-2及促凋亡蛋白Bax的表达水平。结果显示与DS组相比,MI/R损伤导致DIR组TUNEL染色阳性细胞显著增多(DS vs DIR,P<0.05,图 1,表 2),Bcl-2/Bax的比例降低(DS vs DIR,P<0.05,表 2)。腹腔注射HDAC抑制剂能够减少糖尿病心肌I/R损伤所导致的心肌细胞凋亡,TUNEL染色结果显示TSA减少TUNEL阳性的心肌细胞(DIR vs DIR+TSA,P<0.05),Bcl-2/Bax的比例升高(DIR vs DIR+TSA,P<0.05)。TSA的保护作用被Akt抑制剂所拮抗,TUNEL染色结果显示,与DIR+TSA组相比,DIR+TSA+MK组的TUNEL阳性细胞显著增多,而Bcl-2/Bax的比例降低(DIR+TSA+MK vs DIR+TSA,均为P<0.05)。
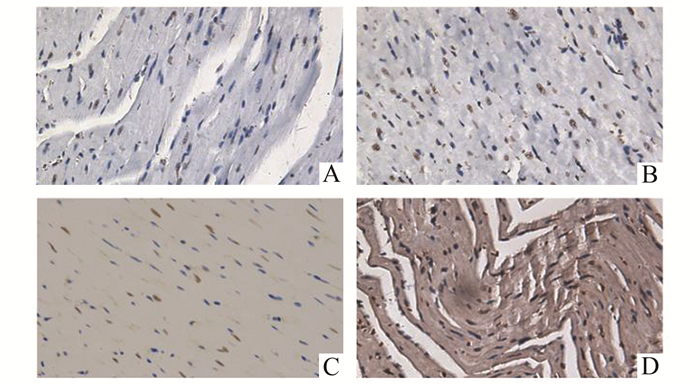
|
图 1 各组心肌组织TUNEL染色结果 A:DS;B:DIR;C:DIR+TSA;D:DIR+TSA+MK |
| 表 2 各组TUNEL阳性细胞百分比及Bcl-2/Bax比值 |
研究发现,与DS组相比,DIR组的Akt磷酸化水平无显著差异(DS vs DIR,P>0.05),这说明保护性的Akt通路在糖尿病MI/R模型中并未激活。预先给予TSA能够显著增加大鼠心肌Akt的磷酸化水平(DIR vs DIR+TSA,P<0.05,图 2)。作为Akt的直接下游靶点,MI/R损伤前腹腔注射HDAC抑制剂能显著提高Gsk3β的磷酸化水平(DS vs DIR,P<0.05,图 2)。在IR组中合并使用TSA和特异性Akt磷酸化抑制剂MK-2206,Akt的活化水平和p-Gsk3β的表达量显著降低,但并不影响t-Akt和t-Gsk3β的表达量(DIR+TSA+MK vs DIR+TSA,均P<0.05)。
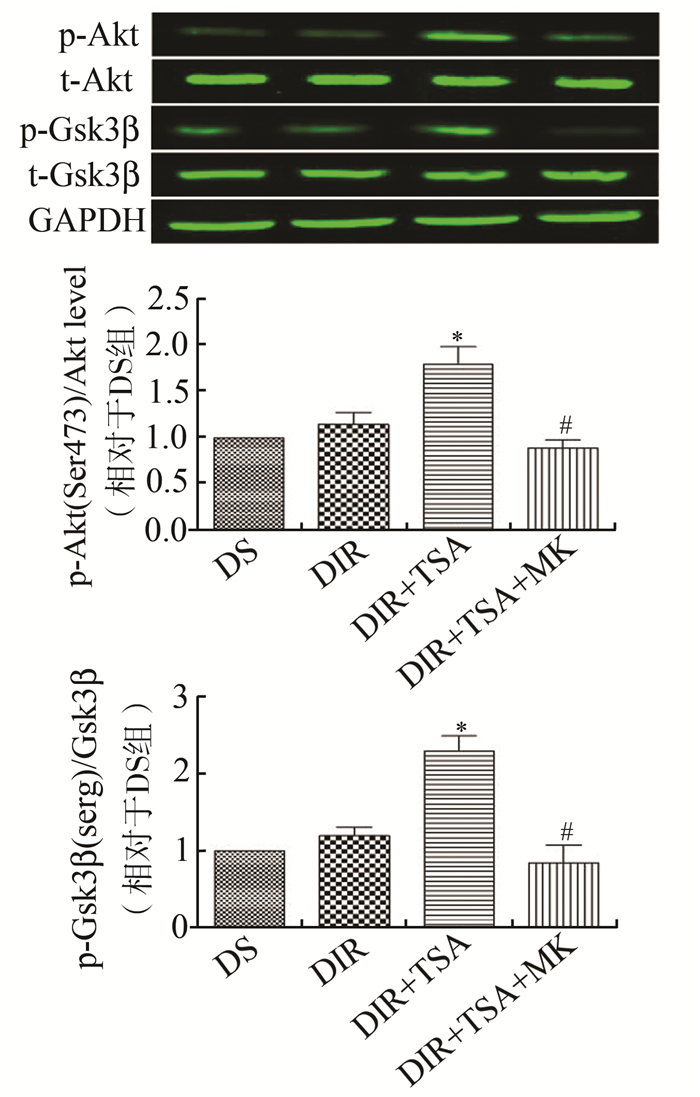
|
图 2 各组心肌Akt和Gsk3β的磷酸化水平表达 |
本研究证实了HDAC抑制剂TSA在糖尿病MI/R损伤过程中发挥抗凋亡及减少组织细胞损伤的作用,由HDAC抑制剂所介导的心肌细胞Akt活化伴随着Akt下游信号分子Gsk-3β的磷酸化。
新近研究表明HAT与HDAC随组蛋白或非组蛋白赖氨酸残基的可逆性乙酰化修饰是参与心血管疾病发生发展过程中信号通路分子的改变和精确基因转录调节机制密切相关[5, 6]。一系列心肌缺血再灌注损伤的研究证实HDAC和Akt之间存在密切联系。Zhao等人的研究指出HDAC抑制剂对Akt-1敲除的小鼠失去心肌保护作用[7],Shi等人在胎鼠心肌元代细胞上证实ERK1/2和Akt的激活需要低氧和TSA的协同刺激[8]。在本研究中,无论是糖尿病还是高糖状态下,MI/R损伤均不能引起Akt的活化,而这可能是糖尿病心肌缺血再灌注损伤更加严重的原因之一。而HDAC抑制剂多次腹腔注射能够恢复Akt通路的反应性激活,这表明Akt的激活参与了TSA介导的糖尿病MI/R保护作用。我们的研究亦证实HDAC抑制剂能够显著减少心肌梗死面积,降低心肌细胞凋亡水平。
另外,本研究在证实了糖尿病MI/R前给予HDAC抑制剂预处理能够增加Akt下游Gsk-3β的磷酸化水平。Gsk-3β在缺血再灌注损伤中的重要作用已得到广泛的共识。Gsk-3β通过与腺嘌呤核苷酸移位酶(ANT)和电压依赖性阴离子通道(VDAC)结合[9],够抑制线粒体的ATP合成,导致心肌线粒体通透性转换孔(mPTP)对伤害性刺激的开放阈值降低[10, 11]。心肌细胞Gsk-3β的表达量和线粒体内膜的通透性密切相关,缺血再灌注损伤时,p-Gsk-3β的表达量低将会导致线粒体内膜mPTP的开放增多,使线粒体产生ATP所必需的质子浓度梯度被破坏[4],同时细胞毒性因子通过mPTP进入线粒体基质中,最终导致细胞死亡。在糖尿病心肌中Akt/Gsk-3β通路失活,TSA预处理增加了GSK-3β在Ser9位点的磷酸化水平,故TSA预处理在MI/R和HR损伤时增高Gsk-3β的磷酸化水平可能是其心肌保护作用的关键步骤。
因此,心肌中Akt/Gsk-3β的激活在HDAC抑制剂对糖尿病MI/R损伤的保护中起到关键作用。给予HDAC抑制剂有望成为糖尿病患者临床围术期心肌缺血再灌注损伤的治疗措施。
| [1] | Li H, Liu Z, Wang J, et al. Susceptibility to myocardial ischemia reperfusion injury at early stage of type 1 diabetes in rats[J]. Cardiovasc Diabetol, 2013, 12: 133. DOI: 10.1186/1475-2840-12-133. |
| [2] | Wu Y, Xia ZY, Dou J, et al. Protective effect of ginsenoside Rb1 against myocardial ischemia/reperfusion injury in streptozotocin-induced diabetic rats[J]. Mol Biol Rep, 2011, 38(7): 4 327-4 335. DOI: 10.1007/s11033-010-0558-4. |
| [3] | Liu M, Zhou B, Xia ZY, et al. Hyperglycemia-induced inhibition of DJ-1 expression compromised the effectiveness of ischemic postconditioning cardioprotection in rats[J]. Oxid Med Cell Longev, 2013, 2013: 564902. |
| [4] | Kubli DA, Gustafsson AB. Mitochondria and mitophagy:the yin and yang of cell death control[J]. Circ Res, 2012, 111(9): 1 208-1 221. DOI: 10.1161/CIRCRESAHA.112.265819. |
| [5] | Williams SM, Golden-Mason L, Ferguson BS, et al. Class I HDACs regulate angiotensin Ⅱ-dependent cardiac fibrosis via fibroblasts and circulating fibrocytes[J]. J Mol Cell Cardiol, 2014, 67: 112-125. DOI: 10.1016/j.yjmcc.2013.12.013. |
| [6] | Witt O, Deubzer HE, Milde T, et al. HDAC family:What are the cancer relevant targets?[J]. Cancer Lett, 2009, 277(1): 8-21. DOI: 10.1016/j.canlet.2008.08.016. |
| [7] | Zhao TC, Cheng G, Zhang LX, et al. Inhibition of histone deacetylases triggers pharmacologic preconditioning effects against myocardial ischemic injury[J]. Cardiovasc Res, 2007, 76(3): 473-481. DOI: 10.1016/j.cardiores.2007.08.010. |
| [8] | Shi H, Chen L, Wang H, et al. Synergistic induction of miR-126 by hypoxia and HDAC inhibitors in cardiac myocytes[J]. Biochem Biophys Res Commun, 2013, 430(2): 827-832. DOI: 10.1016/j.bbrc.2012.11.061. |
| [9] | Zhai P, Sciarretta S, Galeotti J, et al. Differential roles of GSK-3beta during myocardial ischemia and ischemia/reperfusion[J]. Circ Res, 2011, 109(5): 502-511. DOI: 10.1161/CIRCRESAHA.111.249532. |
| [10] | Juhaszova M, Zorov DB, Kim SH, et al. Glycogen synthase kinase-3beta mediates convergence of protection signaling to inhibit the mitochondrial permeability transition pore[J]. J Clin Invest, 2004, 113(11): 1 535-1 549. DOI: 10.1172/JCI19906. |
| [11] | Das S, Wong R, Rajapakse N, et al. Glycogen synthase kinase 3 inhibition slows mitochondrial adenine nucleotide transport and regulates voltage-dependent anion channel phosphorylation[J]. Circ Res, 2008, 103(9): 983-991. DOI: 10.1161/CIRCRESAHA.108.178970. |
 2016, Vol. 37
2016, Vol. 37

