慢性脑低灌注(chronic cerebral hypoperfusion, CCH)是指由于各种血管因素或者其他原因所导致管腔狭窄,造成脑血流量降低, 长期供血供氧不足的状态。慢性脑低灌注状态在老年人群中普遍存在,是导致老年人群认知下降的一个重要危险因素,也是痴呆发生的重要原因[1]。大鼠双侧颈总动脉永久结扎(permanent bilateral comman carotid artery occlusion或two-vessel occlusion, 以下简称2VO)是典型的慢性脑低灌注模型, 有研究证实了由2VO所形成的大鼠慢性脑低灌注模型,它所产生的神经病理改变,能成功模拟人类阿尔兹海默病(Alzheimer’s disease,AD)和血管性痴呆(vascular dementia,VD)病理变化过程[2]。
脑源性神经营养因子(brain derived neurotrophic factor BDNF)是神经营养因子(NT)家族的重要成员,在脑内合成并且分布于脑内多个部位的一种碱性蛋白质,其中以海马的水平最高[3]。BDNF参与了中枢神经内众多过程,有促进神经细胞存活、增殖、分化的作用,并能提高认知功能以及改善突触功能[4]。有研究证实BDNF与脑缺血后的认知损害密切相关[5]。细胞外调节蛋白激酶,包括ERK1和ERK2 (extracellular signal-regulated protein kinase 1/2, ERK1/2),是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)家族的一员, 参与维持神经可塑性、联想学习、记忆等过程[6], 是将信号从表面受体传导至细胞核的关键[7]。ERK1/2被激活后(磷酸化ERK1/2,p-ERK1/2),可迅速转移至胞核,将转录因子-环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化激活(p-CREB), CREB激活后可促使下游相关神经发生和记忆的转录基因的表达,促使下游蛋白BDNF对新生海马神经干细胞产生增殖促进作用, 并且促进对神经前体细胞的分化、成熟[8, 9]。
阿魏酸钠(Sodium ferulate, SF), 是阿魏酸(4-羟基-3-甲氧基肉桂酸)的钠盐。阿魏酸主要存在于当归、川芎等中药材中, 属酚酸类化合物, 具有抑制血小板聚集、抗血栓形成、抗炎、抗动脉粥样硬化等药理作用[10]。因此我们观察,阿魏酸钠是否对慢性脑低灌注大鼠的海马神经发生具有保护性的作用,从而进一步改善认知损害。本实验拟通过2VO术建立大鼠慢性脑低灌注模型,采用阿魏酸钠进行干预,观察阿魏酸钠对大鼠学习记忆能力及海马区p-ERK1/2, p-CREB和BDNF的表达,以探讨阿魏酸钠对慢性脑低灌注大鼠学习记忆功能的影响及可能的机制。
1 材料与方法 1.1 材料 1.1.1 实验动物成年雄性SD大鼠41只(清洁级,购自湖南省斯莱克景达实验动物有限公司,动物合格证号:43004700027235),体质量200-250 g。所有动物均自由饮水进食,早上7:00至晚上7:00明亮环境,维持光线明暗交替环境(12 h/12 h),所有动物饲养和动物实验过程均参照《中国实验动物管理条例》。所有动物在试验前进行适应性饲养1周,并予以安抚以适应动物操作。
1.1.2 主要试剂、药物和仪器注射用阿魏酸钠注射剂[冻干粉针剂,规格:0.1 g(以阿魏酸钠二水合物计)]购自武汉长联来福制药股份有限公司。Morris水迷宫行为学检测系统(中国医学科学院药物研究所),新奇物体识别实验装置。兔抗大鼠p-ERK1/2单克隆抗体, 兔抗大鼠p-CREB单克隆抗体, 兔抗大鼠BDNF单克隆抗体均购自Abcam公司、小鼠抗大鼠β-actin单克隆抗体:Sigma公司。总蛋白提取试剂盒:ASPEN公司。脱脂奶粉:ASPEN公司。Tween-20:ASPEN公司。
1.2 方法 1.2.1 慢性脑缺血模型的制备以及动物处理所有动物按照完全随机原则分为3组,假手术组(SHAM+NS, n=11)、慢性脑低灌注组(2VO+NS, n=15) 和阿魏酸钠治疗组(2VO+SF, n=15)。制作慢性脑低灌注大鼠模型,可参照之前已做过的实验[11],采用2VO术:大鼠手术前禁食12 h,用10%水合氯醛(每100 g体质量0.35 ml)麻醉后仰卧固定,颈前皮肤切开沿颈正中切开分离出双侧颈总动脉,用4-0号丝线行双侧颈总动脉永久性结扎后缝皮。假手术组除不结扎颈总动脉外,其他操作与2VO术相同。将阿魏酸钠注射液用生理盐水(NS)稀释成20 mg/ml的浓度以备用。在造模成功后,于每天定时给予各组大鼠药物处理:阿魏酸钠治疗组在慢性脑低灌注模型的基础上腹腔注射50 mg/kg的阿魏酸钠注射液; 假手术组和慢性脑低灌注组每天给予等量生理盐水腹腔注射。手术后1周,假手术组死亡率为20%,慢性低灌注组死亡率为33%,阿魏酸钠治疗组死亡率为26.6%。大鼠完成造模后第7天开始腹腔注射阿魏酸钠注射液或生理盐水,第6周进行行为学检测。
1.2.2 行为学测试 1.2.2.1 新奇物体识别实验利用大鼠对新旧两物体的记忆和识别能力,在50 cm×30 cm×40 cm白色不透明箱子中进行实验,整个实验分为两个阶段:训练阶段、测试阶段,时间间隔为24 h。训练阶段:开始前在敞箱一面的两个固定位置各放置一个供大鼠识别的物体c1和c2(两个完全相同物体——有柄白色印花瓷杯), 然后动物背对物体放人敞箱内,自由活动10 min,之后将大鼠放回原笼饲养。测试阶段:将物体c1或c2:换成另一个识别物体d (新物体,为圆柱形红色玻璃瓶),大鼠背对识别物体放入敞箱内,自由活动10 min。为了避免嗅觉气味的干扰,每训练或检测完一个大鼠,物体和检测箱都被70%乙醇擦洗。在测试阶段探索物体c、d的时间,记录为c、d,探索新物体时间辨别指数id=d/(c+d)表示。
1.2.2.2 Morris水迷宫标识别测验完成后, 根据之前实验Morris水迷宫步骤[12],对所有大鼠进行Morris水迷宫行为测试,分为定位航行试验和空间探索试验, 计算机记录大鼠运动轨迹。定位航行试验, 在连续5 d的训练中, 每天训练4次, 观察并记录大鼠爬上平台的轨迹图及所需时间(潜伏期, escape latency)。如果大鼠在60 s内未找到平台, 则将其引导至平台并在平台上停留15 s, 潜伏期记为60 s,每只大鼠的训练间隔为1 h。空间探索试验考察大鼠对原平台的记忆能力,在训练期第5天结束后,第6天去除平台, 选择平台对侧作为入水点, 观察记录每只大鼠的游泳速度以及30 s内在第一象限的游泳时间, 计算大鼠在目标象限的游泳时间占全部游泳时间的百分比。
1.3 Western Blot新奇物体识别实验及水迷宫行为学实验完毕后,大鼠麻醉后断头取材。迅速从颅腔取出海马,组织匀浆后获得样品总蛋白浓度,使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度。样品蛋白用聚丙烯酰胺凝胶(SDS-PAGE)分离,之后电转移到PVDF膜上。5%脱脂奶粉室温封闭1 h,加入一抗:兔抗大鼠p-ERK1/2单克隆抗体(1:1 500), 兔抗大鼠p-CREB单克隆抗体(1:1 000), 兔抗大鼠BDNF单克隆抗体(1:1 000),4 ℃过夜后,TBST漂洗,加入二抗(1:10 000) 室温孵育30 min,TBST漂洗,采用ECL增强发光试剂显色后曝光于胶片上。采用AlphaEase FC软件检测目标条带灰度值与β-actin条带的灰度值,两者的比值表示蛋白的表达水平。
1.4 统计学分析所有获得数据均表示为均数±标准误(x±sx),原始数据用SPSS 20.0进行数据分析,目标识别和迷宫结果组间比较采用两因素方差分析或单因素方差分析,两两比较采用Bonferroni检验。Western Blot结果的实验结果采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果 2.1 阿魏酸钠对慢性脑低灌注大鼠空间学习记忆能力的影响 2.1.1 新奇物体识别试验检测大鼠新物体目标识别测验的测试期(见图 1A), 结果显示。对比起慢性低灌注模型组(2VO+NS),假手术组(SHAM+NS)和阿魏酸钠治疗组(2VO+SF)探索新奇物体的时间显著多于探索熟悉物体的时间,差异均有统计学意义(P<0.01,P<0.05)。而模型组大鼠对新旧物体的探索时间几乎相同。关于各组大鼠探索新奇物体的辨别指数结果(如图 1B):模型组大鼠新奇物体的辨别指数分别低于假手术组(P<0.01) 和阿魏酸钠治疗组(P<0.05),而假手术组和阿魏酸钠治疗组的目标识别辨别指数之间无明显差别(P>0.05)。
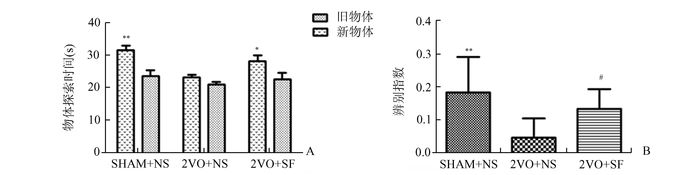
|
图 1 新奇物体识别试验结果
A:新奇物体识别试验-新旧物体探索时间,与探索旧物体时间比较, *P<0.05;**P<0.01, n=10-12;
B:新奇物体识别试验-物体辨别指数结果比较,与假手术组比较,**P<0.01;与模型组(2VO+NS)比较,#P<0.05, n=10-12 |
目标识别测验完成之后, 对所有大鼠进行了Motris水迷宫试验,包括定位航行试验(1-5 d)和空间探索实验(第6天)。在连续5 d航行试验中,模型组大鼠自第3天起逃避潜伏期长于假手术组(P<0.05),阿魏酸钠治疗组大鼠从第4天起逃避潜伏期明显短于模型组(P<0.05), 如图 2A所示; 空间探索试验中,假手术组大鼠在目标象限的游泳时间百分比显著多于模型组,差异有显著性意义(P<0.001),此外, 模型组在目标象限的游泳时间百分比显著少于阿魏酸钠组,有统计学差异(P<0.05),如图 2B。
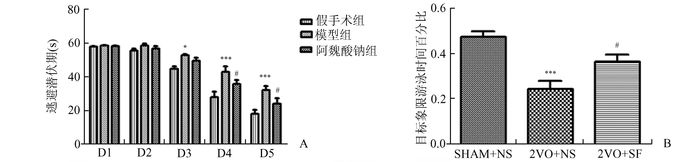
|
图 2 Morris水迷宫检测结果
A:水迷宫-定位航试验,与假手术组(SHAM+NS)比较,*P<0.05,***P<0.001;与模型组(2VO+NS)比较,#P<0.05, n=10-12 B:水迷宫-空间探索试验,与假手术组(SHAM+NS)比较,***P<0.001;与模型组(2VO+NS)比较,#P<0.05, n=10-12 |
免疫印迹结果各组大鼠海马组织p-ERK 1/2蛋白,p-CREB蛋白,BDNF蛋白表达水平如图 3A所示,单因素方差分析提示,各组间p-ERK、p-CREB蛋白表达有统计学差异(P<0.01), 各组间BDNF蛋白表达有显著差异(P<0.001)。Bonferroni检验提示, 与假手术组相比, 模型组大鼠海马p-ERK蛋白的表达水平明显下降(P<0.05);与模型组相比, 阿魏酸钠组大鼠海马p-ERK蛋白的表达水平上升,呈现明显增加趋势(P<0.01),如图 3A。与假手术组相比, 模型组大鼠海马p-CREB蛋白的表达水平明显下降(P<0.01),阿魏酸钠组与模型组相比,大鼠海马p-CREB蛋白的表达水平增加,但并无统计学的意义(P>0.05),如图 3B。与假手术组比较, 模型组大鼠BDNF表达水平明显下降(P<0.001),而与模型组比较, 阿魏酸钠治疗组大鼠海马BDNF定量表达水平增加, 并有显著差异(P<0.05),如图 3C。
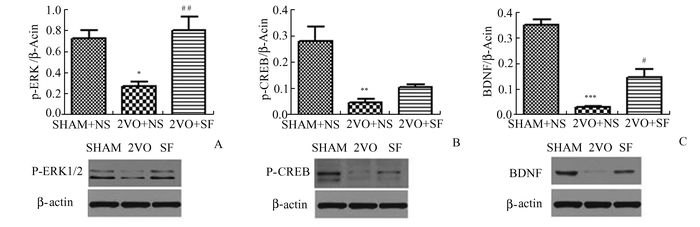
|
图 3 大鼠在慢性脑低灌注及阿魏酸钠干预后海马区p-ERK1/2、p-CREB、BDNF的表达 A:p-ERK1/2的表达;与假手术组比较,*P<0.05;与模型组比较,##P<0.01,n=4;B:p-CREB的表达;与假手术组比较,**P<0.01,n=4;C:BDNF的表达; 与假手术组比较,***P<0.001;与模型组比较,#P<0.05,n=4 |
临床研究显示, 慢性脑低灌注(CCH)与阿尔茨海默病和血管性痴呆的认知功能障碍的严重程度密切相关,国内外的基础实验研究结果也支持CCH可引起认知功能障碍。本实验研究发现在物体识别试验中,模型组大鼠对新物体分辨指数较假手术组下降,表明慢性脑低灌注大鼠的非空间识别记忆受损, 进一步证实了慢性脑低灌注可以导致目标识别记忆能力下降。采用Morris水迷宫实验来检测大鼠的空间学习记忆能力, 与假手术组相比,模型组大鼠的平均逃避潜伏期均延长, 而且在目标象限的停留时间也明显减少,这表明慢性脑低灌注大鼠空间学习及记忆能力均明显受损。而近年来有许多研究显示阿魏酸钠对脑缺血所导致的神经损伤具有保护作用,基础研究显示阿魏酸钠可通过多种途径发挥其脑保护作用,包括通过抗炎机制、抗氧化及清除氧自由基等途径[13]。本实验在给予阿魏酸钠治疗后, 在新物体识别实验中显示出对新奇物体探索水平的显著不同;同时水迷宫实验也显示大鼠的平均逃避潜伏期明显缩短,在目标象限的停留时间也有所增加。从行为学上说明了阿魏酸钠具有脑保护作用, 改善了慢性脑低灌注大鼠的物体识别记忆损害,同时使其空间学习记忆能力得到了提高。
有研究发现BDNF表达增加能够促进海马神经发生, 而敲除BDNF基因后, 会减少海马的神经发生[14]。CREB是一种核转录因子, 其133位的丝氨酸可被ERK1/2信号通路磷酸化而激活,CREB被磷酸化激活的过程是被认为海马产生新的神经元和促进神经元存活的机制之一。BDNF是CREB下游基因之一, 可以被激活的CREB转录, 同时BDNF又可以进一步促进CREB的激活促进其下游基因转录,ERK、CREB和BDNF的表达与神经可塑性、联想学习和记忆相关[15]。此外,越来越多研究报道ERK1/2-CREB-BDNF信号通路能在学习记忆的形成过程中具有的重要作用[16]。研究发现在获取空间学习记忆能力的过程中海马ERK磷酸化的表达增加,而阻断海马ERK信号通路会严重损害空间学习记忆功能[17]。既往有报道指出阿魏酸可以增加抑郁模型中脑源性神经营养因子(BDNF), 突触后蛋白,PSD95, 突触素1的表达,这说明的阿魏酸通过增加神经营养因子改善突触调节功能[18]。在脑缺血再灌注损伤模型中,阿魏酸通过p38MAPK/p90RSK/CREB/Bcl-2信号通路,抑制凋亡并且改善认知损害,这说明阿魏酸在脑缺血损伤与修复的病理生理过程中可通过不同的信号通路发挥了的保护性的作用[19]。我们的实验结果显示,模型组大鼠海马p-ERK1/2、p-CREB、BDNF蛋白表达量都有明显减少,说明了慢性低灌注可以刺激激活ERK1/2相关信号通路, 下调下游p-CREB、BDNF蛋白的表达,引起了神经功能的改变,损害认知功能。同时阿魏酸钠使大鼠海马p-ERK1/2及其下游p-CREB、BDNF蛋白表达量都有所增加,其中p-ERK1/2、BDNF増加趋势更为明显。根据我们的实验结果及已有的研究结果分析,脑缺血后,ERK信号通路的磷酸化的激活会有所下降的,从而引起认知的损害;但是给予阿魏酸钠干预后,p-ERK1/2、p-CREB、BDNF表达增高,从而引起认知功能的改善。提示阿魏酸钠可能通过激活ERK1/2-CREB-BDNF信号通路的磷酸化,促进了慢性脑低灌注模型大鼠海马中学习记忆功能的恢复,但其具体机制需要后续实验进一步应用ERK特异性抑制剂干预以及其他检测方法来探讨。
总之,本研究显示阿魏酸钠在改善慢性脑低灌注大鼠的学习记忆功能的同时可促进了ERK-CERB通路的磷酸化, 增加了海马BDNF的蛋白的表达,因此我们认为阿魏酸钠可能通过激活ERK1/2-CERB-BDNF信号通路促进慢性脑低灌注大鼠的认知功能改善, 其具体机制还有待进一步深入的实验研究。
| [1] | Hanyu H, Sato T, Hirao K, et al. The progression of cognitive deterioration and regional cerebral blood flow patterns in Alzheimer's disease: A longitudinal SPECT study[J]. Journal of the Neurological Sciences, 2010, 290(1-2): 96-101. DOI: 10.1016/j.jns.2009.10.022. |
| [2] | Sarti C, Pantoni L, Bartolini L. Cognitive impairment and chronic cerebral hypoperfusion: What can be learned from experimental models[J]. Journal of the Neurological Sciences, 2002, 203-204: 263-266. DOI: 10.1016/S0022-510X(02)00302-7. |
| [3] | Aid T, Kazantseva A, Piirsoo M, et al. Mouse and ratBDNF gene structure and expression revisited[J]. Journal of Neuroscience Research, 2007, 85(3): 525-535. DOI: 10.1002/(ISSN)1097-4547. |
| [4] | Qian Q, Liu Q, Zhou D, et al. Brain-specific ablation of Efr3a promotes adult hippocampal neurogenesis via the brain-derived neurotrophic factor pathway[J]. FASEB J, 2017 Feb 13. pii: fj.201601207R. doi: 10.1096/fj.201601207R. |
| [5] | Harris NM, Ritzel R, Mancini N, et al. Nano-particle delivery of brain derived neurotrophic factor after focal cerebral ischemia reduces tissue injury and enhances behavioral recovery[J]. Pharmacol Biochem Behav, 2016, 150-151: 48-56. DOI: 10.1016/j.pbb.2016.09.003. |
| [6] | Pan B, Zhong P, Sun D, et al. Extracellular signal-regulated kinase signaling in the ventral tegmental area mediates cocaine-induced synaptic plasticity and rewarding effects[J]. J Neurosci, 2011, 31(31): 11244-11255. DOI: 10.1523/JNEUROSCI.1040-11.2011. |
| [7] | Giovannini MG, Lana D, Pepeu G. The integrated role of ACh, ERK and mTOR in the mechanisms of hippocampal inhibitory avoidance memory[J]. Neurobiol Learn Mem, 2015, 119: 18-33. DOI: 10.1016/j.nlm.2014.12.014. |
| [8] | Shindo T, Matsumoto Y, Wang Q, et al. Differences in the neuronal stem cells survival, neuronal differentiation and neurological improvement after transplantation of neural stem cells between mild and severe experimental traumatic brain injury[J]. J Med Invest, 2006, 53(1-2): 42-51. |
| [9] | Shen J, Zhang J, Deng M, et al. The antidepressant effect of angelica sinensis extracts on chronic unpredictable mild stress-induced depression is mediated via the upregulation of the BDNF signaling pathway in rats[J]. Evid Based Complement Alternat Med, 2016, 2016: 7434692. |
| [10] | Wu Z, Yu J, Fang Q, et al. Sodium ferulate protects against daunorubicin-induced cardiotoxicity by inhibition of mitochondrial apoptosis in juvenile rats[J]. J Cardiovasc Pharmacol, 2014, 63(4): 360-368. DOI: 10.1097/FJC.0000000000000056. |
| [11] | Xi Y, Wang M, Zhang W, et al. Neuronal damage, central cholinergic dysfunction and oxidative damage correlate with cognitive deficits in rats with chronic cerebral hypoperfusion[J]. Neurobiol Learn Mem, 2014, 109: 7-19. DOI: 10.1016/j.nlm.2013.11.016. |
| [12] | Anastacio JR, Netto CA, Castro CC, et al. Resveratrol treatment has neuroprotective effects and prevents cognitive impairment after chronic cerebral hypoperfusion[J]. Neurol Res, 2014, 36(7): 627-633. DOI: 10.1179/1743132813Y.0000000293. |
| [13] | Sgarbossa A, Daniela G, di Carlo AM. Ferulic Acid: A hope for Alzheimer's disease therapy from plants[J]. Nutrients, 2014, 7: 5764-5782. |
| [14] | Jeon SJ, Rhee SY, Seo JE, et al. Oroxylin A increases BDNF production by activation of MAPK-CREB pathway in rat primary cortical neuronal culture[J]. Neurosci Res, 2011, 69(3): 214-222. DOI: 10.1016/j.neures.2010.11.008. |
| [15] | Zhang J, Wang N, Chen B, et al. Blockade of Cannabinoid CB1 receptor attenuates the acquisition of morphine-induced conditioned place preference along with a downregulation of ERK, CREB phosphorylation, and BDNF expression in the nucleus accumbens and hippocampus[J]. Neurosci Lett, 2016, 630: 70-76. DOI: 10.1016/j.neulet.2016.07.047. |
| [16] | Zhao L, Wang J, Liu R, et al. Neuroprotective, anti-amyloidogenic and neurotrophic effects of apigenin in an Alzheimer's disease mouse model[J]. Molecules, 2013, 18(8): 9949-9965. DOI: 10.3390/molecules18089949. |
| [17] | Silingardi D, Angelucci A, De Pasquale R, et al. ERK pathway activation bidirectionally affects visual recognition memory and synaptic plasticity in the perirhinal cortex[J]. Front Behav Neurosci, 2011, 5: 84. |
| [18] | Liu Y, Hu C, Shen J, et al. Elevation of synaptic protein is associated with the antidepressant-like effects of ferulic acid in a chronic model of depression[J]. Physiology & Behavior, 2017, 169: 184-188. |
| [19] | Cheng C, Tang N, Kao S, et al. Ferulic acid administered at various time points protects against cerebral infarction by activating p38 MAPK/p90RSK/CREB/Bcl-2 anti-apoptotic signaling in the subacute phase of cerebral ischemia-reperfusion injury in rats[J]. PLoS One, 2016, 11(5): e155748. |
 2017, Vol. 38
2017, Vol. 38

