癌症的发病率及死亡率在我国一直居高不下,并且呈逐年上升趋势,自2010年起,癌症已成为中国主要的公共卫生问题及首要死亡原因[1]。攻克肿瘤,一直以来都是临床医生及科研工作者的重大难题,有关肿瘤发生发展的机制研究也一直都是研究工作中的热点问题。富含亮氨酸重复序列G蛋白偶联受体5(leucine-rich repeat-containing G protein-coupled receptor 5,LGR5)是一种表达于多种正常细胞及肿瘤细胞表面的膜蛋白,其与配体R-脊椎蛋白(R-spodin)结合后,可增强WNT-β-catenin信号通路,导致肿瘤的发生。其也可在干细胞特性的维持中发挥关键作用,同时可作为肿瘤干细胞的标志物。LGR5表达阳性(LGR5+)干细胞具有可塑性,其参与肿瘤的发生发展。针对LGR5的靶向治疗在临床前研究中可显著遏制肿瘤的生长及转移,是抗肿瘤治疗的理想靶点。本文将对近期关于LGR5与肿瘤发生发展关系的研究进行综述。
1 LGR5的生物学特征LGR5是G蛋白偶联受体视紫红质亚家族中的一员,又名HG38,GPR49。其是一个由富含18个亮氨酸的重复单位和7个跨膜区域组成的大分子蛋白,其蛋白结构特征为细胞外区域包含一个信号肽及17个富含亮氨酸的重复序列和高度保守的7次α-螺旋跨膜区[2],其广泛参与生物体内信号转导。
研究表明,LGR5在人多种正常组织中均有表达,主要有眼睛、乳腺、胃肠道、生殖道、毛囊及大脑等,并且对这些器官正常发挥作用有重要影响[3];LGR5在胃、皮肤及直肠等恶性肿瘤中也有表达,二者的主要区别在于其在正常组织中表达较为局限,而在肿瘤组织中弥漫性表达且为过表达[4]。Baker等人通过原位杂交等方法证实LGR5在正常结直肠组织中仅在肠隐窝基底部局限性表达,而在结肠癌患者中,却可以在肿瘤部位及转移部位广泛表达且为高表达,并且这种高表达与肿瘤的恶性潜能存在相关性[5], 其表达位置的特殊性为LGR5特异性的用于恶性肿瘤的治疗提供了基础。
2 LGR5的生理功能及特点 2.1 LGR5参与Wnt信号通路的调节Wnt信号是一个广泛存在的调控生长发育的信号通路。Wnt蛋白与跨膜受体蛋白Fizzled及LRP5/6共受体复合物结合后,活化的Fizzled作用于细胞质的蓬乱蛋白(dishevelled),进而抑制Axin、APC和GSK-3B组成的β-catenin降解复合物的活性,使β-catenin降解障碍,从而导致β-catenin在胞质内积聚,并向细胞核内转移,与转录因子TCF/LEF结合,激活TCF转录活性,继而激发包括c-myc、VEGF、LGR5、Rnf43、Znrf3在内的多种下游靶分子[6]。其中Rnf43、Znrf3是泛素连接酶E3在细胞膜上的受体,它们通过泛素途径将Wnt蛋白的受体Fizzled及LRP5/6共受体复合物从细胞膜上移除。因此Rnf43、Znrf3是Wnt信号的拮抗剂。而LGR5与配体R-spodin结合后,可以中和Rnf43/Znrf3的降解信号,从而增强Wnt信号转导。因此LGR5信号是Wnt信号的抗-拮抗剂。如图 1所示。
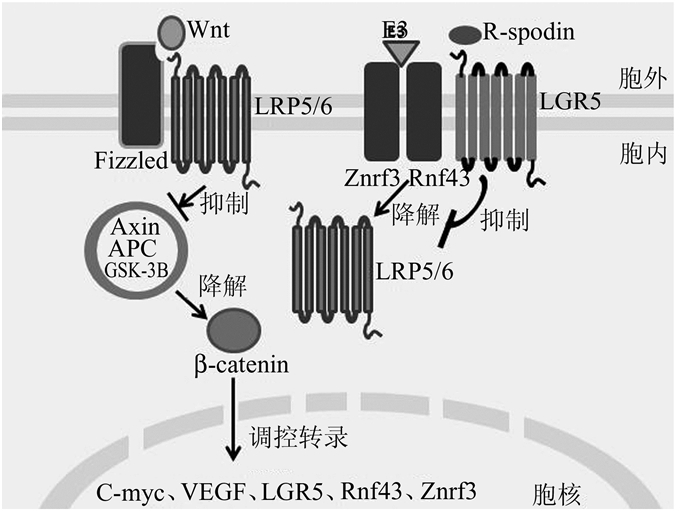
|
图 1 LGR5信号通路模式图 |
利用体内谱系追踪技术,可发现定位于肠隐窝的LGR5+细胞具有多潜能及自我更新等干细胞特性,可以产生多种分化程度不同的肠上皮细胞以维持肠黏膜的自我更新及内稳态平衡[7]。LGR5是R-spodin的受体,R-spodin同时还与ZNRF3及RNF43结合。单独阻断R-spodin与这三个膜受体中的任一膜受体结合均可清除体内LGR5+干细胞,但短期内不会影响肠绒毛的高度及隐窝的增殖能力;但当同时阻断R-spodin与其中两个膜受体结合,如阻断R-spodin-LGR5及R-spodin-ZNRF3结合,或者阻断R-spodin-LGR5及R-spodin-RNF43的结合时,就会导致致死性的干细胞清除和肠绒毛及隐窝丧失。干细胞在缺乏R-spodin信号刺激后,并非发生凋亡或者坏死,而是快速分化为终末细胞而发生耗竭[8]。因此,R-spodin-LGR5信号通路的持续激活可使干细胞通过对称分裂的方式实现自我更新。LGR5是wnt信号通路的靶基因,当wnt信号通路被阻断时,LGR5+干细胞被清除,此时加入R-spodin蛋白也无法挽救LGR5+干细胞。当R-spodin-LGR5信号被阻断导致LGR5+干细胞被清除时,虽然加入wnt蛋白可以逆转LGR5+干细胞的清除,但不会使其增殖超过正常肠隐窝的稳态,再次加入R-spodin蛋白后LGR5+干细胞便会过度增殖。因此,wnt信号通路是LGR5+干细胞生存的基础,而LGR5+干细胞增殖状态却是由R-spodin-LGR5信号决定[8]。
2.3 LGR5+干细胞的解剖学及代谢组学基础小肠的微观结构由隐窝-绒毛单元构成。隐窝位于基底部,LGR5+干细胞与有丝分裂后期细胞(Paneth细胞)混合分布于隐窝,绒毛从隐窝发出,其由终末分化的小肠上皮细胞构成,隐窝中的干细胞持续分裂并分化以不断更新绒毛中的成熟细胞。LGR5+干细胞与Paneth细胞的密切相互作用对于维持LGR5+干细胞的功能至关重要。除了分泌抗菌肽,Paneth细胞还通过分泌生长信号分子来支持干细胞的功能[9]。单个LGR5+干细胞就可以培养形成永生化的具有隐窝和绒毛的类器官结构,但加入Paneth细胞后,类器官结构的形成速度可提升10倍[9]。在代谢方面,LGR5+干细胞相较Paneth细胞具有更多的线粒体,且对氧化磷酸化阻断剂更为敏感,因此LGR5+干细胞主要以氧化磷酸化方式代谢,而Paneth细胞主要以糖酵解方式代谢;其以糖酵解后的产物为原料,可合成一系列信号分子以支持LGR5+干细胞的功能[10];同时,其产生的乳酸也可作为LGR5+干细胞氧化磷酸化的原料。因Paneth细胞主要以葡萄糖为代谢原料,故其对环境的变化更为敏感,可通过感知环境的变化而不断地为LGR5+干细胞提供不同信号以适应环境[11],这也是LGR5+干细胞适应能力较强的原因之一。
2.4 LGR5+干细胞的可塑性LGR5+干细胞库的维持依赖于LGR5+干细胞的可塑性。LGR5+肠干细胞并不是一种特定的细胞,当干细胞受损后,Bmi1+干细胞库由Wnt信号通路驱动开始增殖,接替LGR5+肠干细胞的功能,或者直接分化为LGR5+肠干细胞以补充LGR5+肠干细胞库[8]。正常隐窝肠上皮细胞也可退分化从而形成具有多向分化能力的LGR5+干细胞,继而维持肠隐窝的稳态[12]。LGR5+肿瘤干细胞也具有同样的特性。选择性地消除LGR5+细胞可以限制原发肿瘤的生长,但是不能导致肿瘤消退,原因是当LGR5+细胞被消除后,具有增殖能力的LGR5-细胞会持续补充LGR5+肿瘤干细胞库,导致肿瘤再次增长[13]。LGR5+干细胞的可塑性为临床上癌症的治疗增加了巨大的难度。打破其可塑性及阻断Wnt信号通路,或许可成为新的有效的治疗方向。
3 LGR5与肿瘤 3.1 LGR5可作为肿瘤干细胞标志物肿瘤干细胞(cancer stem cells, CSCs)是与正常干细胞类似的,具有自我更新、多向分化、无限增殖的潜能及不对称分裂、致瘤能力的细胞, 其是肿瘤中极小部分的肿瘤细胞亚群,与正常干细胞不同的是机体失去了对肿瘤干细胞正常严格的调控[14]。研究发现,CSCs可通过多种途径促进血管及淋巴管的生成,从而加快肿瘤的血道及淋巴道转移[15],可通过上皮细胞-间充质转化(epithelial-to-mesenchymal transition, EMT)导致肿瘤干细胞的二次产生,赋予肿瘤细胞转移的能力;其还能通过抵抗相关性蛋白如乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)和ABC转运体(ATP-binding cassette transport)的表达来诱导对化疗药物的抵抗[16]。LGR5是维持干细胞的关键信号,其可过表达于结肠癌、肝癌、卵巢癌、脑胶质瘤、基底细胞癌和胃癌等多种肿瘤中[17]。早在2007年,结肠癌肿瘤干细胞的存在就已经得到证实,很多研究者认为结肠癌肿瘤干细胞(CCSC)起源于肠干细胞(ISC)[18]。将含有LGR5的结肠癌SW480细胞系皮下注射接种到裸鼠中,可发现其可在体外成瘤,具有干细胞特性,且形成的肿瘤大小与LGR5的含量相关[19]。在HT29结肠癌细胞系中,LGR5高表达,下调LGR5的表达可以降低HT29细胞系中CCSC表面标志物CD133及CD44的表达,同时抑制其体外致瘤能力;沉默LGR5基因可以抑制细胞增殖并诱导细胞凋亡;敲除LGR5可提高HT29细胞系的化学敏感性,并降低其侵袭力[20]。由此多种证据均可证实LGR5为CCSC的标志物。以LGR5为靶点,特异性的筛选出LGR5+的细胞以用于肿瘤干细胞的研究,将会为肿瘤的治疗提供新的可能。
3.2 R-spodin-LGR5通路促进肿瘤发生约10%的结肠癌病例存在R-Spodin 2和R-Spodin 3基因的融合表达,且表达丰度增强[21]。过表达的R-Spodin 3导致广泛的小肠增生,这种增生从隐窝延伸至肠腔,与正常的绒毛融合在一起,并增生为小肠息肉。在过表达R-Spodin 3的动物模型中,大部分动物均发展为腺瘤,部分甚至发展为恶性肿瘤。而在这些增生的腺瘤或者恶性肿瘤中,LGR5+干细胞及Paneth细胞均发生广泛扩增,且Paneth细胞的位置从隐窝部位上移至肠腔。R-Spodin3不仅促进Wnt靶基因的表达,同时也促进干细胞相关基因如Ascl2, Hopx, Cdca7, Tnfrsf19,Msi1等的表达,也促进Paneth细胞相关基因Lyz1和Pla2g2a的表达,同时分化相关基因Sis和Muc2被下调[22]。因此,LGR5可通过R-spodin-LGR5通路促进肿瘤的发生。
3.3 LGR5参与肿瘤血管生成血管在肿瘤的生长及营养供应过程中扮演着关键角色,拮抗肿瘤血管生成可明显抑制肿瘤的生长。血管内皮生长因子(vascular endothelial growth factor, VEGF)是Wnt/β-catenin信号通路的靶基因[23],Wnt/β-catenin通路的异常激活可导致VEGF的过表达,进而促进肿瘤血管的生成。Xi等人首次证实了胃癌中LGR5的表达与VEGF及肿瘤微血管密度(microvessel density, MVD)的表达成正相关,沉默LGR5的表达将会抑制VEGF mRNA的转录及其蛋白的表达,抑制血管生成,且其极有可能通过Wnt信号通路发挥作用[24]。沉默结直肠癌SW620细胞系中LGR5的表达,毛细血管管腔样结构数目可显著减少,证明沉默LGR5基因表达可抑制体外血管生成[25];通过构建LGR5过表达质粒并建立稳定细胞株,利用实时荧光定量PCR及小管形成实验,可发现LGR5可以增强内皮细胞小管形成能力;通过AOM/DSS模型,证实肿瘤组织LGR5与VEGF的mRNA表达均明显增高[26]。因此,LGR5在肿瘤血管的生成中具有重要作用。
3.4 LGR5与肿瘤的治疗及预后通过检测192例结直肠癌患者的标本信息发现,结直肠癌组织较正常黏膜组织,LGR5的表达明显增高,且与组织学分级、肿瘤浸润的深度、淋巴结转移情况、远处转移及Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)水平呈正相关。LGR5+组较LGR5-组平均生存时间[(39.5±4.8)月;(95.6±7.0)月]显著缩短, 可作为恶性肿瘤独立的不良预后因素[27]。因此临床上可通过评估LGR5水平来尽早预测肿瘤患者预后及对治疗的敏感性。
研究发现靶向R-spodin-LGR5通路可以遏制肿瘤增长。结肠癌的PDX小鼠模型接受R-Spodin 3(RSPO3)的功能性阻断抗体anti-RSPO3后,肿瘤出现停滞和消退。停滞生长的肿瘤中存在大量的黏液,残存的上皮细胞具有已经分化的表型,且Ki-67阳性率明显降低。RNA测序显示,经anti-RSPO3治疗后的肿瘤细胞Wnt靶基因如LGR5及ASCL2明显下调,而调控分化相关基因明显上调,说明经过anti-RSPO3治疗后肿瘤细胞干性消失,且开始向终末细胞分化[28]。anti-RSPO3同样在其他多种肿瘤中展现出抗肿瘤特性,如非小细胞肺癌、卵巢癌等,当anti-RSPO3与化疗药物连用时,抗肿瘤效果明显强于二者单用。将经过治疗后的肿瘤培养并处理为细胞悬液后,再次将少量细胞悬液(50个/只)接种于小鼠,观察其成瘤情况,以判断经前期治疗后肿瘤中干细胞的增殖能力。与对照组几乎100%的再次成瘤率相比,前期经anti-RSPO3治疗后的肿瘤再次成瘤率明显降低,说明anti-RSPO3可以有效降低肿瘤干细胞的特性[29]。靶向LGR5抗体偶联药物anti-LGR5-vc-MMAE可以有效抑制肿瘤生长而不影响正常组织的生长,可能原因为LGR5+干细胞在肿瘤中富集,当被靶向药物清除后会显著影响肿瘤生长,而在正常组织中,LGR5+干细胞散在分布且数量较少,当被靶向药物清除后,会很快被LGR5-细胞增殖补充[30]。
4 结语LGR5在肿瘤的发生、发展、预后及治疗等过程中扮演重要角色。其在干细胞特性的维持中发挥关键作用,同时参与Wnt/β-catenin及R-spodin-LGR5信号途径,R-spodin-LGR5的过度激活可导致肿瘤的发生。通过对LGR5的研究来探讨肿瘤发生发展的机制,为临床上防治LGR5相关的恶性肿瘤奠定了理论基础。目前已有众多研究者以LGR5为标志物进行肿瘤干细胞的筛选;也已存在靶向LGR5来治疗肿瘤的多种研究,且可显著遏制肿瘤生长。因此,LGR5极有望成为治疗肿瘤的新的有效靶点,具有广泛的临床应用前景。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI: 10.3322/caac.21338. |
| [2] | Kumar KK, Burgess AW, Gulbis JM. Structure and function of LGR5: an enigmatic G-protein coupled receptor marking stem cells[J]. Protein Sci, 2014, 23(6): 551-565. |
| [3] | Plaks V, Brenot A, Lawson DA, et al. Lgr5-expressing cells are sufficient and necessary for postnatal mammary gland organogenesis[J]. Cell Rep, 2013, 3(1): 70-78. DOI: 10.1016/j.celrep.2012.12.017. |
| [4] | He S, Zhou H, Zhu X, et al. Expression of Lgr5, a marker of intestinal stem cells, in colorectal cancer and its clinicopathological significance[J]. Biomed Pharmacother, 2014, 68(5): 507-513. DOI: 10.1016/j.biopha.2014.03.016. |
| [5] | Baker AM, Graham TA, Elia G, et al. Characterization of LGR5 stem cells in colorectal adenomas and carcinomas[J]. Sci Rep, 2015, 5: 8654. DOI: 10.1038/srep08654. |
| [6] | Clevers H, Nusse R. Wnt/beta-catenin signaling and disease[J]. Cell, 2012, 149(6): 1192-1205. DOI: 10.1016/j.cell.2012.05.012. |
| [7] | Snippert HJ, van der Flier LG, Sato T, et al. Intestinal crypt homeostasis results from neutral competition between symmetrically dividing Lgr5 stem cells[J]. Cell, 2010, 143(1): 134-144. |
| [8] | Yan KS, Janda CY, Chang J, et al. Non-equivalence of Wnt and R-spondin ligands during LGR5+ intestinal stem-cell self-renewal[J]. Nature, 2017, 545(7653): 238-242. DOI: 10.1038/nature22313. |
| [9] | Sato T, van Es JH, Snippert HJ, et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts[J]. Nature, 2011, 469(7330): 415-418. DOI: 10.1038/nature09637. |
| [10] | Clevers HC, Bevins CL. Paneth cells: maestros of the small intestinal crypts[J]. Annu Rev Physiol, 2013, 75: 289-311. |
| [11] | Rodriguez-Colman MJ, Schewe M, Meerlo M, et al. Interplay between metabolic identities in the intestinal crypt supports stem cell function[J]. Nature, 2017, 543(7645): 424-427. DOI: 10.1038/nature21673. |
| [12] | Tetteh PW, Basak O, Farin HF, et al. Replacement of lost Lgr5-positive stem cells through plasticity of their enterocyte-lineage daughters[J]. Cell Stem Cell, 2016, 18(2): 203-213. |
| [13] | de Sousa e Melo F, Kurtova AV, Harnoss JM, et al. A distinct role for LGR5+ stem cells in primary and metastatic colon cancer[J]. Nature, 2017, 543(7647): 676-680. DOI: 10.1038/nature21713. |
| [14] | Cabrera MC, Hollingsworth RE, Hurt EM. Cancer stem cell plasticity and tumor hierarchy[J]. World J Stem Cells, 2015, 7(1): 27-36. |
| [15] | Li S, Li Q. Cancer stem cells and tumor metastasis (Review)[J]. Int J Oncol, 2014, 44(6): 1806-1812. DOI: 10.3892/ijo.2014.2362. |
| [16] | Suresh R, Ali S, Ahmad A, et al. The role of cancer stem cells in recurrent and drug-resistant lung cancer[J]. Adv Exp Med Biol, 2016, 890: 57-74. DOI: 10.1007/978-3-319-24932-2. |
| [17] | Liu Z, Dai W, Jiang L, et al. Over-expression of LGR5 correlates with poor survival of colon cancer in mice as well as in patients[J]. Neoplasma, 2014, 61(2): 177-185. |
| [18] | Zhu L, Gibson P, Currle DS, et al. Prominin 1 marks intestinal stem cells that are susceptible to neoplastic transformation[J]. Nature, 2009, 457: 603-607. DOI: 10.1038/nature07589. |
| [19] | Hirsch D, Barker N, McNeil N, et al. LGR5 positivity defines stem-like cells in colorectal cancer[J]. Carcinogenesis, 2014, 35(4): 849-858. DOI: 10.1093/carcin/bgt377. |
| [20] | Chen X, Wei B, Han X, et al. LGR5 is required for the maintenance of spheroid-derived colon cancer stem cells[J]. Int J Mol Med, 2014, 34(1): 35-42. DOI: 10.3892/ijmm.2014.1752. |
| [21] | Seshagiri S, Stawiski EW, Durinck S, et al. Recurrent R-spondin fusions in colon cancer[J]. Nature, 2012, 488(7413): 660-664. DOI: 10.1038/nature11282. |
| [22] | Hilkens J, Timmer NC, Boer M, et al. RSPO3 expands intestinal stem cell and niche compartments and drives tumorigenesis[J]. Gut, 2017, 66(6): 1095-1105. DOI: 10.1136/gutjnl-2016-311606. |
| [23] | Bergers G, Benjamin LE. Tumorigenesis and the angiogenic switch[J]. Nat Rev Cancer, 2003, 3: 401-410. |
| [24] | Xi HQ, Zhang KC, Li JY, et al. RNAi-mediated inhibition of LGR5 leads to decreased angiogenesis in gastric cancer[J]. Oncotarget, 2017, 8(19): 31581-31591. |
| [25] | Casasa S, Schwab DB, Moczek AP. Developmental regulation and evolution of scaling: novel insights through the study of Onthophagus beetles[J]. Curr Opin Insect Sci, 2017, 19: 52-60. |
| [26] | Dunaeva M, Waltenberger J. Hh signaling in regeneration of the ischemic heart[J]. Cell Mol Life Sci, 2017, 74(19): 3481-3490. DOI: 10.1007/s00018-017-2534-9. |
| [27] | Han Y, Xue X, Jiang M, et al. LGR5, a relevant marker of cancer stem cells, indicates a poor prognosis in colorectal cancer patients: a meta-analysis[J]. Clin Res Hepatol Gastroenterol, 2015, 39(2): 267-273. DOI: 10.1016/j.clinre.2014.07.008. |
| [28] | Storm EE, Durinck S, de Sousa e Melo F, et al. Targeting PTPRK-RSPO3 colon tumours promotes differentiation and loss of stem-cell function[J]. Nature, 2016, 529(7584): 97-100. |
| [29] | Chartier C, Raval J, Axelrod F, et al. Therapeutic targeting of tumor-derived R-spondin attenuates beta-catenin signaling and tumorigenesis in multiple cancer types[J]. Cancer Res, 2016, 76(3): 713-723. DOI: 10.1158/0008-5472.CAN-15-0561. |
| [30] | Junttila MR, Mao W, Wang X, et al. Targeting LGR5+ cells with an antibody-drug conjugate for the treatment of colon cancer[J]. Sci Transl Med, 2015, 7(314): 314ra186. DOI: 10.1126/scitranslmed.aac7433. |
 2018, Vol. 39
2018, Vol. 39


