2. 华中科技大学同济医学院附属同济医院急诊科 湖北 武汉 430030
2. Emergency Dept., Tongji Hospital, Tongji Medical College of Huazhong University of Science & Technology, Wuhan 430030, China
脓毒血症是由感染引起的全身炎症反应综合征,其临床发生率和病死率高[1]。患者多数会出现反应性高血糖和胰岛素抵抗,与机体在对抗感染性因素过程中大量的炎性细胞因子失控性释放有关[2, 3]。本研究进一步探讨强化胰岛素治疗对脓毒血症患者的临床疗效,以患者ICU住院时间、低血糖发生率、急性肾衰竭及死亡率等作为评价指标,并重点关注患者血清钙卫蛋白(serum calprotectin,SC)水平在强化胰岛素治疗时的变化及其对预后判断的价值。
1 资料与方法 1.1 研究对象及分组选取2010年7月-2014年2月期间在本院ICU住院治疗的78例创伤性脓毒症患者为研究对象,均合并应激性高血糖(随机空腹血糖≥6.9 mmol/L 2次或2次以上,或随机血糖≥11.1 mmol/L),排除合并有糖尿病、全身免疫系统疾病或长期使用免疫抑制剂的患者。
上述患者随机分为2组,常规治疗组(CG组,n=38例):男21例,女17例,平均年龄为(45.2±11.7)岁;强化胰岛素治疗组(IIG组,n=40例):男23例,女17例,平均年龄为(44.7±10.4)岁。两组患者在性别、年龄方面无显著差异性(P>0.05)。本研究已通过医院伦理委员会批准并经患者知情同意。
1.2 治疗及血糖控制所有患者入院后均给予机械通气(低平台压、小潮气量)、抗感染、肠内营养支持、维持水电解质平衡及保护重要脏器的生理功能等对症支持治疗。采用经静脉微量泵连续输注胰岛素的方式控制血糖水平,常规治疗组餐前血糖水平控制在10.0-11.1 mmol/L范围内,强化胰岛素治疗组餐前血糖水平控制在4.4-6.1 mmol/L范围内,需密切监测手指血糖,并根据监测结果调整胰岛素剂量,具体监测频次及方案调整参照Leuven方案[4]。
1.3 观察指标及检测方法比较两组患者机械通气时间、抗生素使用时间、ICU住院时间、低血糖发生率、急性肾衰竭及死亡率等临床指标,采用酶联免疫吸附法检测两组患者治疗第0、3、6、9及12天时血清SC、TNF-α、IL-6的表达水平。
1.4 统计学分析方法所有数据录入Microsoft Office Excel 2003,统计分析及绘图采用GraphPad Prism 5.00软件完成。计量资料用均数±标准差(x±s)表示,组间比较使用独立样本的t检验,计数资料比较采用卡方检验,以P < 0.05表示差异有统计学意义。
2 结果 2.1 两组患者血糖水平及临床指标比较两组患者入住ICU前的随机血糖水平,常规治疗组为(13.1±1.8) mmol/L,强化胰岛素治疗组为(12.8±2.1) mmol/L,组间比较差异无统计学意义(P>0.05);治疗时低血糖发生率亦无显著性差异(P>0.05)。
两组临床指标比较,结果(如表 1)显示,强化胰岛素治疗组在机械通气时间、抗生素使用时间、ICU住院时间、急性肾衰竭(ARF)发生率及死亡率均较常规治疗组显著下降(P < 0.05),其中ARF发生率与患者的死亡率显著相关(r=0.945,P < 0.05)。
| 表 1 两组临床指标比较(x±s) |
ELISA检测两组患者血清SC水平,结果(如图 1)显示,两组患者入住ICU当天(治疗第0天),血清SC表达水平无显著差异性[(94.21±9.40) vs (93.59±8.08) ng/L,P>0.05)]。治疗后,与常规治疗组比较,治疗第6、9及12天血清SC表达水平均显著下降(P < 0.05);常规治疗组患者血清SC表达水平在9 d内维持在较高水平,与入住ICU治疗当天的水平无显著差异性(P>0.05)。
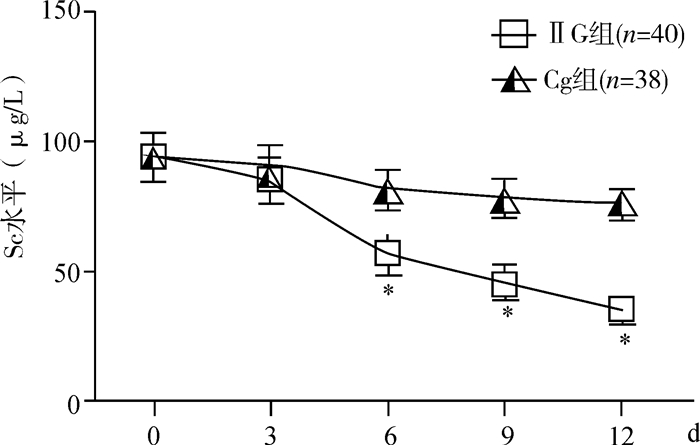
|
图 1 两组患者治疗各时段血清SC水平 与CG组比较,*P < 0.05 |
此外,发生ARF的患者,在治疗各时段血清SC水平均显著高于非ARF的患者,差异有统计学意义(P < 0.05)。
2.3 两组患者血清TNF-α、IL-6水平变化ELISA检测两组患者血清TNF-α、IL-6水平,结果(如图 2A、B)显示,两组患者TNF-α、IL-6水平都呈现明显下降趋势,组内各时间点比较,治疗第3、6、9、12天均较治疗第0天的水平显著下降,差异有统计学意义(P < 0.05)。上述细胞因子水平,强化胰岛素治疗组略低于常规治疗组,但相同时间点水平的组间比较,差异无统计学意义(P>0.05)。相关性分析显示,TNF-α、IL-6水平与SC水平均无显著相关性(P>0.05)。
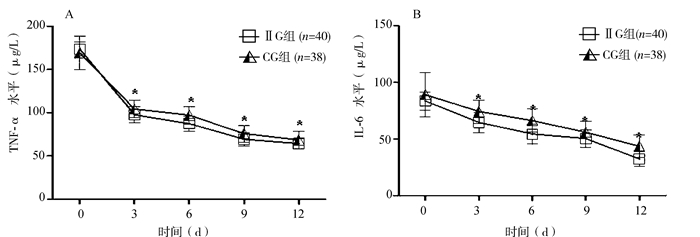
|
图 2 两组患者治疗各时段血清TNF-α、IL-6水平 与0 d比较,*P < 0.05 |
高血糖或血糖的“高-低”变异均为导致脓毒血症患者最终死亡的危险因素[5]。本研究选取的78例创伤性脓毒症患者均合并应激性高血糖,临床研究证实强化胰岛素治疗可以降低此类危重病患者的死亡率,但也有分析提示强化胰岛素治疗并没有明显的优势,反而增加了低血糖事件的发生率。本研究中,强化胰岛素治疗可以缩短患者机械通气、抗生素使用及ICU住院时间,ARF发生率及死亡率均较常规治疗组显著下降,结果表明强化胰岛素治疗脓毒血症有积极的效果;同时,两组患者都有低血糖发生,但组间比较,无显著性差异,表明强化胰岛素治疗时如将血糖水平控制在合理的范围内不会增加低血糖事件的发生率。病变严重的脓毒血症患者往往出现休克和多器官衰竭等严重并发症,并导致患者的最终死亡,本研究结果也表明,两组患者ARF发生率与患者的死亡率正相关。
关于胰岛素治疗脓毒血症的作用机制,目前比较普遍的认识包括:控制血糖水平,防止发生应激性高血糖;减少炎性因子的表达,降低炎症反应导致的损伤程度;此外还可抑制诱导型一氧化氮合酶(iNOS)的产生,抑制血清游离脂肪酸的合成和释放,抑制心肌细胞的凋亡等,发挥对血管内皮细胞及重要脏器的保护作用等[6, 7]。强化胰岛素治疗时血糖水平的控制方案目前公认的是Leuven方案,本研究中采用了此方案,结果证实其安全、有效,操作性强,不但稳定了机体应激状态下的血糖水平,而且降低了患者炎症因子水平,显示出了较强的抗炎作用,但对TNF-α、IL-6水平的影响与常规治疗组比较无显著性差异,表明TNF-α、IL-6对评估强化胰岛素治疗效果评价不具有特异性,故本研究选择了血清SC表达水平作为观察指标,结果表明,与常规治疗组比较,强化胰岛素治疗第6、9及12天血清SC表达水平均显著下降(P < 0.05),而常规治疗组患者血清SC表达水平维持在较高水平,与入住ICU治疗当天的水平无显著差异性(P>0.05);此外,发生ARF的患者,在治疗各时段血清SC水平均显著高于非ARF的患者,差异有统计学意义(P < 0.05),这些结果提示SC水平对评估强化胰岛素治疗效果敏感性和特异性优于TNF-α和IL-6。
钙卫蛋白是一种钙离子结合蛋白,主要存在于中性粒细胞溶酶体外的细胞质中,生物学作用主要包括促进中性粒细胞的聚集和引起血管内皮细胞功能损伤等[8]。研究报道,糖尿病视网膜病变时,高表达的SC对病程进展起着重要的促进作用;钙卫蛋白在溃疡性结肠炎患者结肠黏膜及粪便中高表达,且与炎症导致的组织学损伤程度相关[9, 10]。机体受到创伤和细菌感染等刺激下,处于应激状态,细菌被吞噬细胞吞噬后产生TNF-α、IL-6等关键的前炎性因子,引起T细胞活化,产生更多的炎症因子,进而引发严重的炎症反应。其中,TNF-α可以通过调节胰岛素受体后信号的传导造成肝脏和骨骼肌胰岛素耐受而升高血糖,而释放其他炎症因子引起的级联反应包括中性粒细胞的聚集,可能导致微循环障碍而引起多器官功能的衰竭。SC也有促进中性粒细胞聚集的作用,但SC对血糖的影响未见报道;有研究证实,SC水平与中性粒细胞的数量无显著相关性。本研究结果显示脓毒血症患者血清TNF-α、IL-6水平与SC水平均无显著相关性,结合本结果推测,SC水平可能是一个独立的影响脓毒血症预后的因素,具体有待进一步研究。
综上所述,强化胰岛素治疗脓毒血症能缩短患者机械通气、抗生素使用及ICU住院时间,且可降低血清SC、TNF-α及IL-6表达水平,降低患者死亡率;血清SC水平可能是一个独立的影响脓毒血症预后的因素,可以作为强化胰岛素治疗脓毒血症预后判断的血清学指标。
| [1] | Kempker JA, Martin GS. The Changing Epidemiology and Definitions of Sepsis[J]. Clin Chest Med, 2016, 37(2): 165-179. DOI: 10.1016/j.ccm.2016.01.002. |
| [2] | Guo YW, Wu TE, Chen HS. Prognostic factors of mortality among patients with severe hyperglycemia[J]. Am J Manag Care, 2015, 21(1): e9-e22. |
| [3] | Weiss M, Huber-Lang M, Taenzer M, et al. How many general and inflammatory variables need to be fulfilled when defining sepsis due to the 2003 SCCM/ESICM/ACCP/ATS/SIS definitions in critically ill surgical patients: a retrospective observational study[J]. BMC Anesthesiol, 2010, 10: 22. DOI: 10.1186/1471-2253-10-22. |
| [4] | Van den Berghe G, Wouters P, Weekers F, et al. Intensive insulin therapy in critically ill patients[J]. N Engl J Med, 2001, 345(19): 1359-1367. DOI: 10.1056/NEJMoa011300. |
| [5] |
孙东京.不同血糖变异指标对脓毒血症患者死亡率的影响[D].杭州:浙江大学, 2014.
Sun DJ. Effect of two blood glucose variability measures on the mortality in sepsis[D]. Hangzhou: Zhejiang University, 2014. |
| [6] |
陈阵, 李文强, 刘亚凤, 等. 小剂量类固醇激素治疗脓毒症休克疗效的Meta分析[J].
海南医学院学报, 2011, 17 (10): 1310-1316.
Chen Z, Li WQ, Liu YF, et al. Meta analysis of effect of low-dose steroid therapy on septic shock[J]. Journal of Hainan Medical University, 2011, 17(10): 1310-1316. |
| [7] | 陶国弟. 强化胰岛素治疗脓毒血症的疗效[J]. 实用临床医学, 2012, 13 (8): 39-40. |
| [8] | Rao K, Santhosh K, Mogle JA, et al. Elevated fecal calprotectin associates with adverse outcomes from Clostridium difficile infection in older adults[J]. Infect Dis, 2016, 20(1): 1-7. |
| [9] | Gauss A, Geib T, Hinz U, et al. Quality of life is related to fecal calprotectin concentrations in colonic Crohn disease and ulcerative colitis, but not in ileal Crohn disease[J]. Medicine (Baltimore), 2016, 95(16): e3477. DOI: 10.1097/MD.0000000000003477. |
| [10] | Theede K, Holck S, Ibsen P, et al. Fecal calprotectin predicts relapse and histological mucosal healing in ulcerative colitis[J]. Inflamm Bowel Dis, 2016, 22(5): 1042-1048. DOI: 10.1097/MIB.0000000000000736. |
 2016, Vol. 37
2016, Vol. 37

