心源性猝死是急性心肌梗死后1月内最常见的死因[1]。大约80%猝死原因是由心梗后持续性室性心动过速和心室颤动导致的[2]。之前的研究已经证实,交感神经活性升高是导致急性心梗期室性心律失常发生的重要因素[3-5]。心肌损伤后交感神经密度增高,并促进室性心律失常的发生[6, 7]。研究发现,脊神经刺激或肾去交感神经可通过降低心脏交感神经活性对心室电生理及室性心律失常产生有利影响[8-10]。
正中神经是由部分颈神经和胸神经共同构成的一对神经。我们的近期研究发现,正中神经刺激(median nerve stimulation, MNS)可促进心交感与迷走神经之间的平衡,从而降低星状神经节活性并提高心迷走神经活性[11]。有研究证实,刺激正中神经可通过改善心肌代谢需求以减少心肌缺血范围[12, 13],但MNS对心肌梗死后室性心律失常的影响尚不清楚。对本研究目的是为了证实MNS可抑制急性心梗后室性心律失常的发生并探讨其影响机制。
1 材料与方法 1.1 实验动物成年杂种犬15只(武汉大学人民医院动物实验中心提供),体重15-18 kg。所有犬术前给予戊巴比妥钠30 mg/kg静脉麻醉(根据动物反应每30-60 min静脉追加戊巴比妥钠50 mg), 气管插管,机械通气(MAO01746,美国),采用体表心电图持续监测。
1.2 实验分组和模型建立所有犬麻醉后注射肝素1 000 U,股动脉置管。在X线透视引导下,将5F导管进入左冠状动脉进行造影。保持5F导管固定在左前降支动脉,沿5F导管将导管送至左前降支远端,注射明胶海绵。若ST段无明显变化,则再次注射明胶海绵(图 1)。当胸导联ST段上抬,造影示左前降支远端不显影,急性心梗模型完成(图 2)。观察4周,其中2只犬饲养过程中死亡,将13只随机犬分为MNS1组(n=6)和MNS2组(n=7)。MNS1组单纯刺激正中神经,MNS2组在刺激前离断双侧迷走神经,其余步骤同MNS1组。
|
图 1 冠状动脉栓塞前后造影图 A:栓塞前,左冠状动脉造影;B:栓塞后,左前降支远端明显狭窄 |
|
图 2 冠状动脉栓塞前后心电图 A:栓塞前;B:栓塞后,ST段明显上抬 |
心梗前与心梗后4周分别检查超声心动图(Vivid 7型超声心动仪,GE公司,美国),用二维和彩色多普勒系统,常规采集图像为标准的胸骨旁短轴及长轴切面、心尖2腔、3腔及4腔切面。Simpson双平面法采集左室舒张末期内径(LVDD)和右室舒张末期内径(RVDD)。均由同一位经验丰富的医师完成,所有图像及参数均采集3次,取其平均值。
1.4 电生理指标检测正中开胸,充分暴露心脏。MNS1组暴露左前肢正中神经,将双相电极勾住神经,连接电刺激仪(S88, Grass Instruments, Quincy, MA)以频率5 Hz,脉宽0.5 ms持续刺激30 min。能够引起肌肉抽搐的最低电压强度即为MNS阈值,以此作为刺激电压。MNS2组在刺激前离断双侧迷走神经,其余步骤同MNS1组。
在基线期和MNS后测量电生理指标。依次以周长为300 ms,2倍阈值强度监测右室心尖外膜(RVA)、游离壁(RVFW)、基底部(RVB)和左室心尖外膜(LVA)、游离壁(LVFW)、基底部(LVB)等处有效不应期(ERP)。采用S1S2程序刺激进行测量:设置S1S1为300 ms,S1S2 180 ms、10 ms步长依次递减,当接近ERP时以2 ms步长依次递减至S2不能引起心房应激的最长S1S2值即为ERP。各处测量值的最大差值为ERP离散度。
程控刺激右室游离壁来检测室性心律失常诱发。采用周长为300 ms的连续刺激20次,起始强度为2倍阈值,以1 mV依次递增,若无室颤出现则停顿30 s再进行下一次刺激。能够诱发出室颤的最低刺激电压则为室颤阈值。
1.5 ELISA检测分别在心梗前、MNS前、MNS后采集5 ml静脉血置入EDTA试管,立即低温下离心(3 000 r/min,15 min),取上清液1-2 ml放入冷冻管中,保存于-80 ℃冰箱待检。实验终点以高频率刺激心室诱发室颤处死动物,并迅速离体心脏。取3只正常犬作为对照组,样本选取MNS1组和MNS2组左室梗死周边区及对照组相同区域于-80 ℃保存待检。采用ELISA法检测血浆和组织中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和乙酰胆碱(ACh)水平。
1.6 Western Blot检测Western Blot法检测MNS1组和MNS2组左室梗死周边区及对照组相同区域NF-κB的表达。将组织块用冷TBS洗涤3次,剪成小块置于匀浆器后,加入10倍组织体积试剂(使用前5 min内加入cooktail和磷酸化蛋白酶抑制剂)冰上彻底匀浆。将匀浆液转移至1.5 ml离心管中,冰浴30 min,细胞完全裂解后,低温离心机12 000 g离心5 min,收集上清, 采用Bradford方法测定蛋白含量后,计算出含40 μg蛋白的溶液体积即为上样量。在标本中加入适当体积的5倍蛋白上样缓冲液,沸水浴5 min后上样。SDS-PAGE电泳(30%丙烯酰胺, pH 8.8的1.5 mmol/L TRIS-Hcl,10% SDS,AP,TEMED)浓缩胶电压75 V,分离胶用120 V后,转至PVDF膜(200 mA,1 h)。室温下将转好的膜置于脱色摇床上,用5%的脱脂牛奶(0.5% TBST配)封闭1 h。孵一抗4 ℃过夜后,用TBST洗涤3次,室温下孵二抗60 min,用TBST洗涤3次,DAB化学发光显影,将胶片进行扫描存档,用AlphaEase FC凝胶图像分析软件分析目标带的光密度值。
1.7 统计学处理实验数据以均数±标准差表示,数据用SPSS 22.0软件分析,同一组内比较采用配对t检验,两组间比较采用两样本独立t检验,多组间比较用单因素方差分析(ANOVAs),以P<0.05为差异有统计学意义。
2 结果 2.1 超声心动图与基线期相比,4周后MNS1组和MNS2组左心室前壁厚度显著减少。另外,LVDD明显增加[MNS1:(27.0±2.4)mm vs (36.0±2.9)mm,P<0.01;MNS2:(29.0±2.6)mm vs (35.0±2.8)mm,P<0.01],LVEF明显降低[(54±5)% vs (38±5)%,P<0.01];但是,MNS1和MNS2的RVDD前后无明显变化(表 1)。
| 表 1 基线期和4周后心脏超声指标的变化 |
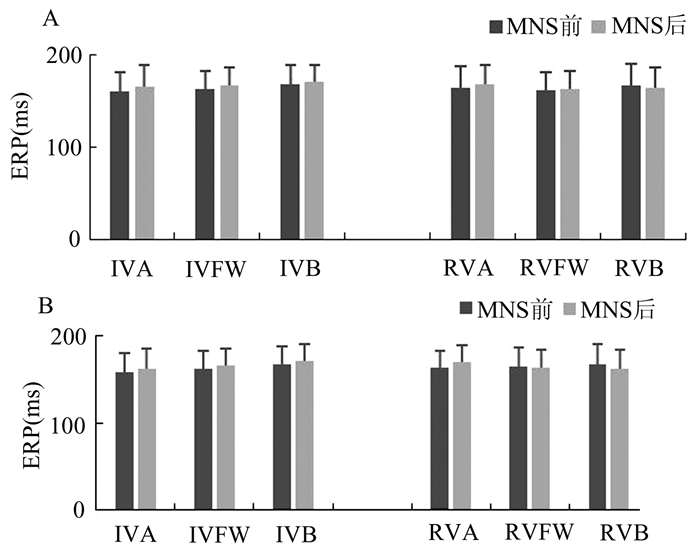
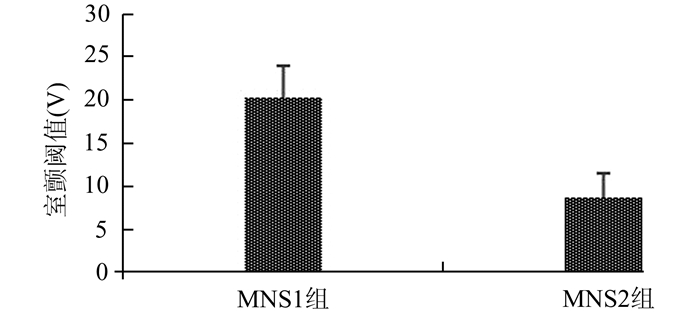
MNS1组和MNS2组之间心室ERP无明显差异。两组各处测得ERP在刺激前后无明显变化(图 3)。MNS1组和MNS2组刺激前后ERP离散度无明显差异。行程控刺激诱发心律失常,刺激前MNS1组1只犬发生1阵室速,MNS2组1只犬发生2次室早。刺激后,两组犬均不能诱发室性心律失常。MNS1组测得室颤阈值明显高于MNS2组[(20.3±3.7)V vs (8.7±2.9)V,P<0.01](图 4)。结果显示与MNS1组的室颤诱发相比,MNS2组犬室颤更易诱发。
|
图 3 MNS前后两组心室ERP比较 A:MNS1组; B:MNS2组; 两组心室ERP在正中神经刺激前后均无明显变化 |
|
图 4 MNS1组和MNS2组室颤阈值的比较 MSN1组室颤阈值明显高于MSN2组,MNS2组犬室颤更易诱发 |
与基线期相比,4周后MNS1组和MNS2组血浆中TNF-α和IL-6浓度均升高,而ACh浓度降低。MNS1组TNF-α、IL-6和ACh浓度在刺激30 min后较基线期无明显变化;而MNS2组TNF-α和IL-6浓度在刺激30 min后较基线期升高,ACh浓度较基线期降低(表 2)。
| 表 2 血浆TNF-α、IL-6和ACh水平 |
如表 3所示,MNS1组左心室梗死周边区测得TNF-α和IL-6浓度明显高于对照组。然而,MNS1组TNF-α浓度较MNS2组低,且ACh水平较对照组和MNS2组高。
| 表 3 左室组织TNF-α、IL-6和ACh水平 |
3组犬的心室组织Western Blot结果如图 5所示。MNS2组心室标本中NF-κB蛋白水平较MNS1组(0.44±0.09 vs 0.25±0.05,P<0.01)和对照组(0.44±0.09 vs 0.09±0.02,P<0.01)升高。与对照组相比,MNS1组NF-κB蛋白表达水平升高(0.25±0.05 vs 0.09±0.02, P<0.01)。
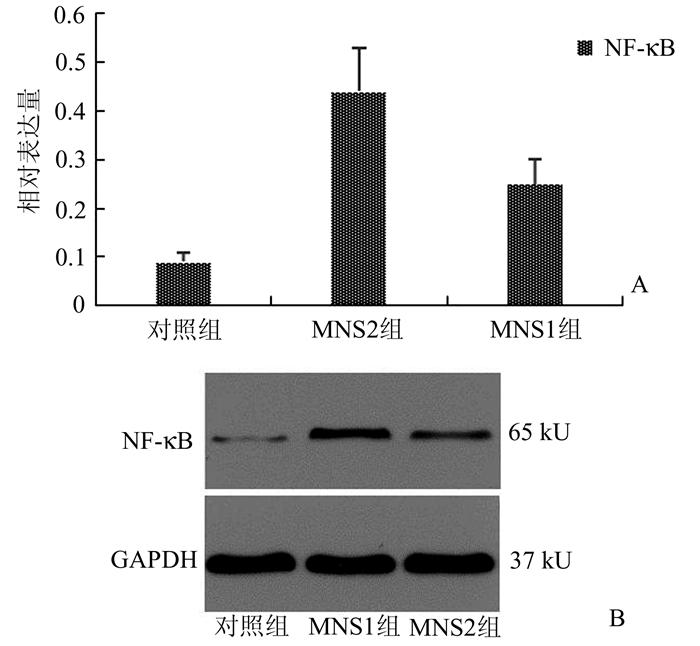
|
图 5 梗死周边区NF-κB的比较 MNS2组心室标本中NF-κB蛋白水平较MNS1组和对照组明显升高 |
本研究通过制备犬的急性心梗模型,探究MNS对心室电重构和室性心律失常诱发的影响。我们发现MNS可降低左室梗死周边区TNF-α和IL-6水平;我们还发现MNS使心梗后室颤阈值升高,但MNS对室颤阈值的影响在双侧迷走神经离断后消失。
研究已经证实心源性猝死在急性心梗后1月内风险最高[1, 14, 15]。急性心梗后梗死灶周围交感神经芽植可能在心源性猝死中发挥重要的作用。近期,诸如肾去交感神经和低强度迷走神经刺激等降低交感神经活性的方法可能有抑制室性心律失常的作用[16, 17]。Li等[12]和Zhu等[18]已经证实MNS可抑制心肌缺血期心交感神经活性;Lujan等[13]也发现MNS可通过降低心脏代谢需求从而降低缺血再灌注所诱发的室速。然而,MNS对长期心梗后室性心律失常诱发的影响尚未阐明。
本研究中,我们通过建立犬的急性心梗模型,观察心梗4周后MNS对室性心律失常诱发的影响。发现心室ERP和室速诱发率并没有明显改变,然而室颤阈值在MNS 30 min后明显上升。而且,我们还发现左室梗死周边区TNF-α、IL-6和NF-κB等炎性因子的水平在MNS后降低,且MNS对室颤阈值和炎性因子的影响在双侧迷走神经离断后被抑制。我们近期研究发现,MNS不仅可减弱左室星状神经活性,而且可增强心迷走神经活性[11]。我们的结果进一步证实,室颤阈值和炎性因子降低与心迷走神经活性有着密切的联系。
前期研究已证实,急性心梗后炎性因子水平升高,而迷走神经刺激可通过激活胆碱能抗炎通路从而抑制炎症反应,减少心脏缺血再灌注损伤[19, 20]。NF-κB信号通路是迷走神经抗炎作用机制之一[21],目前认为NF-κB是一种在信号转导通路中调控促炎因子表达的关键转录因子。我们的研究显示NF-κB蛋白表达降低与室颤阈值升高有关。我们观察了MNS对心室电生理和室性心律失常发生的影响,尽管心室ERP和室早、室速的发生在刺激前后并无明显变化,但室颤阈值在刺激后明显上升。
临床上利用刺激内关穴来治疗急性心梗的方法已经得到认可[22]。内关穴位于前臂手厥阴心包经,掌长肌腱与桡侧腕屈肌腱之间,正处于正中神经主干上方。因此,我们认为内关针灸刺激可模拟MNS对自主神经系统的调控作用。综上,我们推断MNS是通过激活胆碱能抗炎通路从而抑制急性心梗患者心源性猝死的发生。
| [1] | Adabag AS, Therneau TM, Gersh BJ, et al. Sudden death after myocardial infarction[J]. JAMA, 2008, 300(17): 2022-2029. DOI: 10.1001/jama.2008.553. |
| [2] | Rubart M, Zipes DP. Mechanisms of sudden cardiac death[J]. J Clin Invest, 2005, 115(9): 2305-2315. DOI: 10.1172/JCI26381. |
| [3] | Jardine DL, Charles CJ, Ashton RK, et al. Increased cardiac sympathetic nerve activity following acute myocardial infarction in a sheep model[J]. J Physiol, 2004, 565(Pt1): 325-333. |
| [4] | Ng GA, Mantravadi R, Walker WH, et al. Sympathetic nerve stimulation produces spatial heterogeneities of action potential restitution[J]. Heart Rhythm, 2009, 6(5): 696-706. DOI: 10.1016/j.hrthm.2009.01.035. |
| [5] | Vaseghi M, Lux RL, Mahajan A, et al. Sympathetic stimulation increases dispersion of repolarization in humans with myocardial infarction[J]. Am J Physiol Heart Circ Physiol, 2012, 302(9): H1 838-H1 846. DOI: 10.1152/ajpheart.01106.2011. |
| [6] | Zhou S, Chen LS, Miyauchi Y, et al. Mechanisms of cardiac nerve sprouting after myocardial infarction in dogs[J]. Circ Res, 2004, 95(1): 76-83. DOI: 10.1161/01.RES.0000133678.22968.e3. |
| [7] | Cao JM, Fishbein MC, Han JB, et al. Relationship between regional cardiac hyperinnervation and ventricular arrhythmia[J]. Circulation, 2000, 101(16): 1960-1969. DOI: 10.1161/01.CIR.101.16.1960. |
| [8] | Wang S, Zhou X, Huang B, et al. Spinal cord stimulation protects against ventricular arrhythmias by suppressing left stellate ganglion neural activity in an acute myocardial infarction canine model[J]. Heart Rhythm, 2015, 12(7): 1628-1635. DOI: 10.1016/j.hrthm.2015.03.023. |
| [9] | Huang B, Yu L, He B, et al. Renal sympathetic denervation modulates ventricular electrophysiology and has a protective effect on ischaemia-induced ventricular arrhythmia[J]. Exp Physiol, 2014, 99(11): 1467-1677. DOI: 10.1113/expphysiol.2014.082057. |
| [10] | Guo Z, Zhao Q, Deng H, et al. Renal sympathetic denervation attenuates the ventricular substrate and electrophysiological remodeling in dogs with pacing-induced heart failure[J]. Int J Cardiol, 2014, 175(1): 185-186. DOI: 10.1016/j.ijcard.2014.04.189. |
| [11] | Zhao Q, Zhang S, Zhao H, et al. Median nerve stimulation prevents atrial electrical remodelling and inflammation in a canine model with rapid atrial pacing[J]. Europace, 2018, 20(4): 712-718. DOI: 10.1093/europace/eux003. |
| [12] | Li P, Pitsillides KF, Rendig SV, et al. Reversal of reflex-induced myocardial ischemia by median nerve stimulation: a feline model of electroacupuncture[J]. Circulation, 1998, 97(12): 1186-1194. DOI: 10.1161/01.CIR.97.12.1186. |
| [13] | Lujan HL, Kramer VJ, DiCarlo SE. Electroacupuncture decreases the susceptibility to ventricular tachycardia in conscious rats by reducing cardiac metabolic demand[J]. Am J Physiol Heart Circ Physiol, 2007, 292(5): H2 550-H2 555. DOI: 10.1152/ajpheart.00979.2006. |
| [14] | Solomon SD, Zelenkofske S, McMurray JJ, et al. Sudden death in patients with myocardial infarction and left ventricular dysfunction, heart failure, or both[J]. N Engl J Med, 2005, 352(25): 2581-2588. DOI: 10.1056/NEJMoa043938. |
| [15] | Bardy GH, Lee KL, Mark DB, et al. Home use of automated external defibrillators for sudden cardiac arrest[J]. N Engl J Med, 2008, 358(17): 1793-1804. DOI: 10.1056/NEJMoa0801651. |
| [16] | Jiang H, Lu ZB, Yu Y, et al. Relationship between sympathetic nerve sprouting and repolarization dispersion at peri-infarct zone after myocardial infarction[J]. Autonomic Neuroscience: Basic and Clinical, 2007, 134(1-2): 18-25. DOI: 10.1016/j.autneu.2007.01.014. |
| [17] | Remo BF, Preminger M, Bradfield J, et al. Safety and efficacy of renal denervation as a novel treatment of ventricular rtachycardia storm in patients with cardiomyopathy[J]. Heart Rhythm, 2014, 11(4): 541-546. DOI: 10.1016/j.hrthm.2013.12.038. |
| [18] |
朱伟建, 张荣宝. 躯体传入冲动抑制中枢性心肌缺血的脊髓机制[J].
生理学报, 1991, 43(2): 141-148.
Zhu WJ, Zhang RB. Spinal mechanism of the inhibitory effect of somatic input on the cardiac ischemia induced by hypothalamus stimulation[J]. Acta Physiological Sinica, 1991, 43(2): 141-148. |
| [19] | Neumann FJ, Ott I, Gawaz M, et al. Cardiac release of cytokines and inflammatory responses in acute myocardial infarction[J]. Circulation, 1995, 92(4): 748-755. DOI: 10.1161/01.CIR.92.4.748. |
| [20] | Zhao M, He X, Bi XY, et al. Vagal stimulation triggers peripheral vascular protection through the cholinergic anti-inflammatory pathway in a rat model of myocardial ischemia/reperfusion[J]. Basic Res Cardiol, 2013, 108(3): 345. DOI: 10.1007/s00395-013-0345-1. |
| [21] | Tracey KJ. Physiology and immunology of the cholinergic antiinflammatory pathway[J]. J Clin Invest, 2007, 117(2): 289-296. DOI: 10.1172/JCI30555. |
| [22] | Meng J. The effects of acupuncture in treatment of coronary heart diseases[J]. J Tradit Chin Med, 2004, 24(1): 16-19. |
 2018, Vol. 39
2018, Vol. 39


