IgA肾病是我国最常见的原发性肾小球疾病,也是临床上导致终末期肾病的病因之一。其主要病理特征是免疫复合物沉积于肾小球系膜区[1]。研究表明,IgA肾病患者血清、肾组织及腭扁桃体均能检测到高于健康人水平的半乳糖基化缺陷的IgA1(galactose-deficient IgA1,Gd-IgA1),后者可诱导机体产生特异性识别Gd-IgA1 分子的免疫球蛋白IgG(glycan-IgG),二者结合形成的稳定免疫复合物可沉积于肾小球系膜区,并通过募集补体、细胞因子等途径介导肾脏损伤[2]。目前临床上主要使用血管紧张素转化酶抑制剂(ACEI)、血管紧张素Ⅱ受体拮抗剂(ARB)及免疫抑制剂等药物治疗IgA肾病,但上述药物并未针对IgA肾病的特有发病机制进行靶向干预,而且不良反应明显、疗效欠佳[3]。因此研究开发特异性针对IgA肾病发病机制的靶向性药物,成为当前IgA肾病治疗方面的热点。
Suzuki等[4]成功分离出IgA肾病患者外周血单个核细胞并对其进行EB病毒永生化,进而亚克隆出产Glycan-IgG的B细胞系,通过对该细胞分泌的IgG分子抗原结合区重链及轻链测序,他们发现了一段存在于IgG重链CDR3区的氨基酸片YCSR是IgA肾病患者所共有,而健康人对应的序列则为YCAR。进一步研究发现CDR3区的氨基酸序列(YCSR/K),该序列是Glycan-IgG能够特异性识别Gd-IgA1的核心序列。其中片段为“YCSRDRYGLFDYW”的肽段长度最短,并且与Gd-IgA1分子结合能力强。本课题组前期以病毒样颗粒为平台的分子载体设计研究显示,通过PCR定点突变技术插入PH肽段,该序列可作为VLPs特异性识别IgA肾病患者Gd-B细胞表面膜型IgA1分子的模拟肽[5]。基于该理论,本实验设计并表达含有该特殊模拟肽的HPV16 L1-PH重组质粒,将上述质粒电转转入毕赤酵母菌内,表达HPV16 L1-PH嵌合蛋白,鉴定并纯化获得的目的蛋白。后者可在组装缓冲液中自我组装成VLPs,并且将PH肽暴露于VLPs表面,表面肽段引导VLPs识别Gd-B细胞,引起细胞内化VLPs,从而达到递送外源基因进入细胞内的目的。VLPs解聚和重组装可通过透射电镜观察。此外,VLPs目前作为宫颈癌疫苗已用于临床,显示了它作为基因载体的安全性。而且经改造后VLPs可降低机体对其产生的免疫排斥反应,是一种比较理想的基因递送载体[6]。制备获得的HPV16 L1-PH嵌合蛋白可用于IgA肾病下一步实验研究。
1 材料与方法 1.1 质粒及菌株毕赤酵母宿主菌GS115由武汉华美生物工程有限公司提供;HPV16 L1-PD质粒委托上海生工构建;增强型绿色荧光蛋白(EGFP)表达型质粒由美国Putterman教授惠赠。
1.2 主要试剂及仪器限制性内切酶Sac Ⅰ、凝胶回收试剂盒及Taq DNA Polymerase均购自Fermentas公司;T4 DNA Ligase购自天根生化科技有限公司;G418购自Invitrogene公司;电转化仪购自Ependorf公司;Hitachi公司H-7000FA透射电镜由中科院武汉病毒所提供使用。
1.3 重组表达质粒HPV-L1-PH的构建根据本研究所保存测序正确HPV16 L1-PD质粒设计引物,采用PCR定点突变技术,将HPV16 L1-PD基因中PD序列替换成PH序列。提前进行引物设计(表 1)。首先以基础质粒HPV16 L1-PD模板,用正向侧引物F1和反向引物R2进行PCR扩增,然后以此模板用正向侧引物F1和反向侧引物R1进行第二轮PCR扩增,回收得到片段S1。再次以质粒HPV16 L1-PD为模板,用正向引物F2和反向引物R3进行PCR扩增,然后以此为模板用正向侧引物F3和反向侧引物R3扩增,产物回收获得片段S2。最后通过重叠延伸PCR法连接片段S1及S2。获得的目的片段再连接pPIC9K表达载体,获得的HPV16-9K重组质粒经转化涂板筛选阳性克隆,鉴定出的正确克隆送公司测序。
| 表 1 PCR定点突变所需引物 |
将重组表达载体用Sac Ⅰ线性化后电转化GS115感受态细胞。电转化后转化子涂布在RDB+G418平板(G418浓度为1 mg/ml),4 d后长出300个左右单菌落。从RDB+G418平板上随机选取20个菌落,并编上1-20序号,挑取适量编有序号的菌落于对应编号的PCR管反应体系中,同时往阴性对照PCR体系中加入0.1 μl去离子水,阳性对照PCR体系中加入0.1 μl质粒模板,PCR管置于PCR扩增仪扩增,取5 μl PCR产物1%琼脂糖胶电泳检测后扩大培养。然后用1 mol/L Tris pH 9.0将浓缩后的上清调pH至8.0。多次冲洗柱床后以1 ml/min的流速将处理好的样品过柱。上样结束后用溶液NTA-0冲洗柱床到G250检测基本不显色。用250 mmol/L咪唑冲洗柱床。G250检测有蓝色开始收集洗脱峰,G250检测基本无色停止收集洗脱峰。再次冲洗柱床,用10 kU超滤管超滤洗脱液至1-2 ml。然后进行SDS-PAGE分析,然后从SDS-PAGE胶上45-66 kU处切下1个胶点,加入终浓度10 mmol/L二硫苏糖醇(DTT)还原蛋白质,接着加入终浓度55 mmol/L碘乙酸铵(IAM),最后加入1 μg的Trypsin酶,过夜酶解8-16 h。酶解产生的多肽用C18柱子除盐,已经除盐的多肽抽干后用15 μl Loading Buffer(0.1%甲酸,3%乙腈)溶解多肽。多肽上LC-MS/MS仪器进行分析,然后对结果进行评估。
1.5 病毒样颗粒电镜下观察嵌合蛋白形态将新鲜制备的疫苗取20 μl滴于200目铜网上,吸附3 min。吸水纸吸干,晾干30 s。以1%质量体积分数的水溶性醋酸铀负染30 s,吸水纸吸干,晾干30 s。75 kV透射电镜H-7000FA观察。
1.6 病毒样颗粒组装及解组装首先,将5 μg纯化的HPV病毒样颗粒在含150 mmol/L NaCl,1 mmol/L EGTA和20 mmol/L DTT终体积为50 μl解组装缓冲液中,室温孵育30 min。将2 μg表达质粒溶解在10 μl含有50 mmol/L Tris-HCl buffer(pH 7.5)和150 mmol/L NaCl的溶液中,然后加入解组装缓冲液,然后以每小时1 mmol/L逐渐梯度增加CaCl2浓度至终浓度5 mmol/L,送电镜观察。
2 结果 2.1 HPV-L1-PH嵌合蛋白表达质粒的构建及鉴定结果PCR定点突变技术构建的S1和S2产物,经0.8%琼脂糖凝胶电泳检测鉴定,均在800 bp左右有特异性条带。通过重叠延伸PCR法连接片段S1及S2,产物通过琼脂糖凝胶检测有特异的大小约1 600 bp的正确条带。将该嵌合质粒送公司测序,测序结果表明,所构建的表达质粒目的片段HPV-L1-PH序列正确无突变序列。获得的HPV16-9K重组质粒用Sac Ⅰ线性化,酶切效率为100%(图 1)。
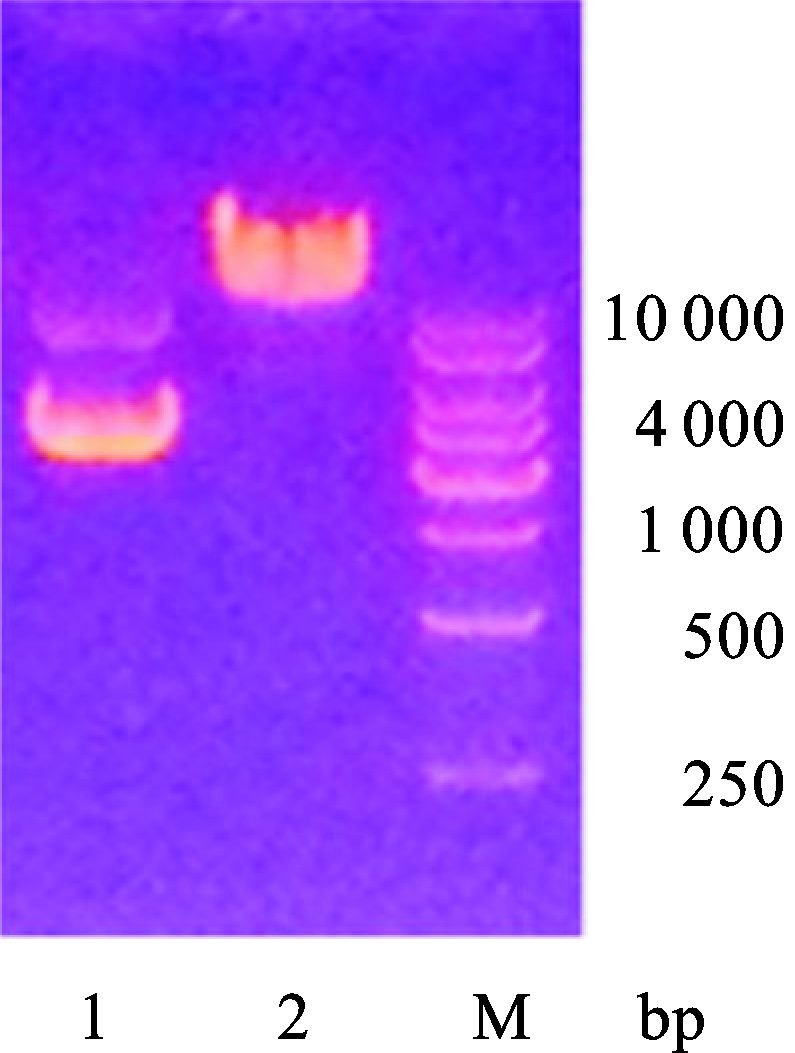
|
图 1 人 HPV16-9K重组质粒及线性化 产物琼脂糖凝胶电泳鉴定 1:人HPV16-9K重组质粒; 2:人HPV16-9K重组质粒 Sac Ⅰ酶切线性化回收产物;M:DL 10 000 DNA Marker |
分别从RDB+G418平板上随机选取20个菌落、0.1 μl去离子水阴性对照、0.1 μl质粒模板阳性对照,产物经琼脂糖凝胶电泳分析,可见约1 600 bp的基因片段,与理论预测值相符。见图 2。
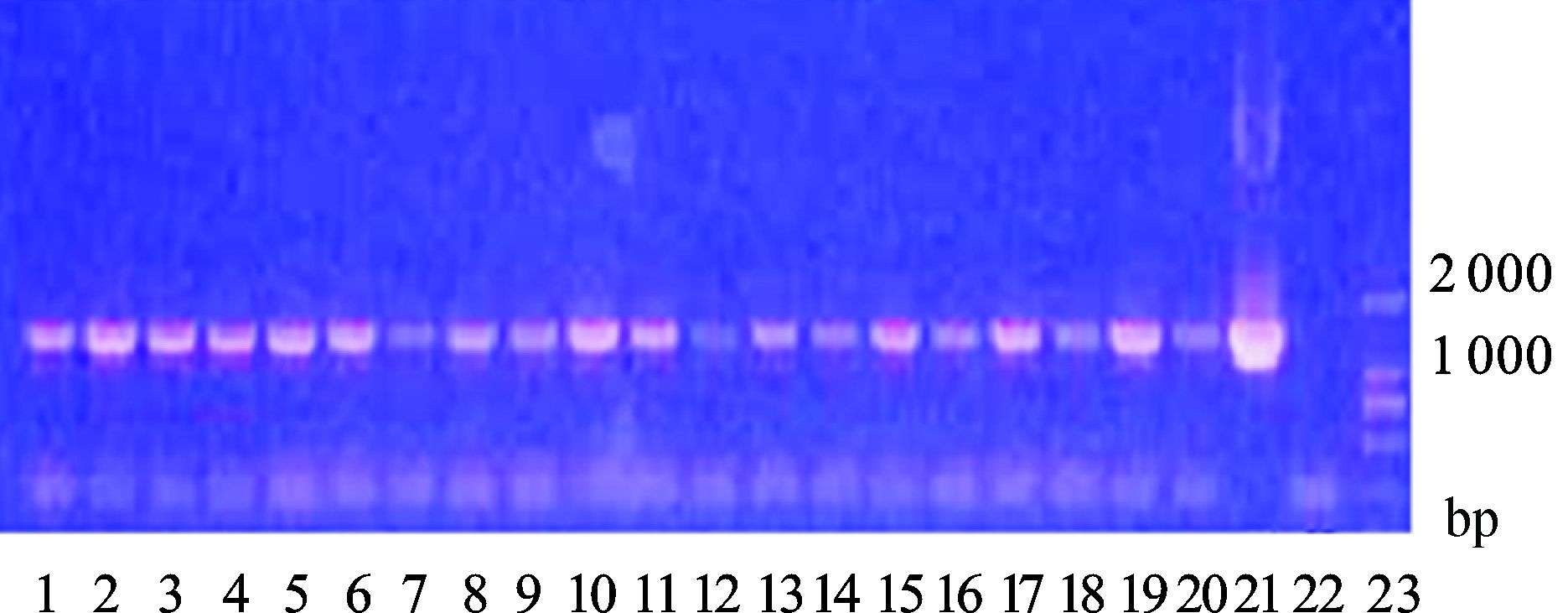
|
图 2 HPV16-9K线性化产物转化 GS115菌落PCR鉴定琼脂糖凝胶电泳图 1-20:平板随机挑取的20个菌落;21:阳性对照;22:阴性对照;23:marker |
将甲醇诱导表达的每天取样进行TCA浓缩电泳,以第一次加甲醇的时刻为零时刻,大约48 h后,将培养液倒入两个500 ml离心管,6 000 r/min,4 ℃离心10 min。收集上清。然后用1 mmol/L Tris将浓缩后的上清调pH至8.0,然后用Ni柱层析,最后超滤管超滤。分别将收集上清浓缩液、上清浓缩液过柱穿透液、NTA-250洗脱收集液经SDS-PAGE分析,显示在45-66.2 kU之间有明显的特异性条带,这与HPV-L1-PH嵌合蛋白理论大小60 kU一致(图 3)。从SDS-PAGE胶上45-66 kU处切下1个胶点,送公司做质谱分析,鉴定结果显示有很高的多肽覆盖度和多肽总数,可以确定所检测胶点中的蛋白质为目标蛋白质。
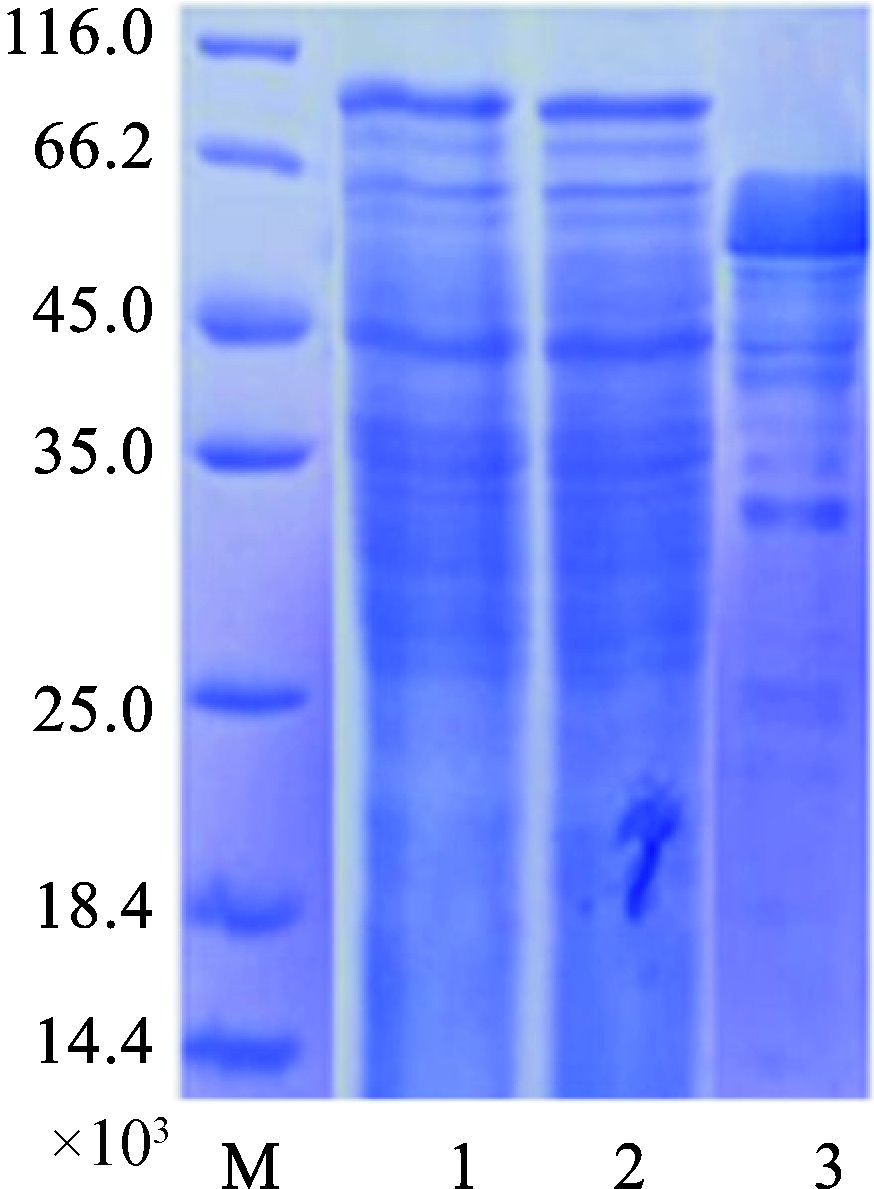
|
图 3 HPV-L1-PH嵌合蛋白SDS-PAGE分析 M:Marker;1:上清浓缩液;2:上清浓缩液过柱穿透液;3:NTA-250洗脱收集液 |
纯化后的蛋白浓度测定为1 mg/ml,取2 μg蛋白用PBS稀释到20 μl,通过扫描电镜观察,可见直径约55 nm的球形颗粒,与预测值一致(图 4)。
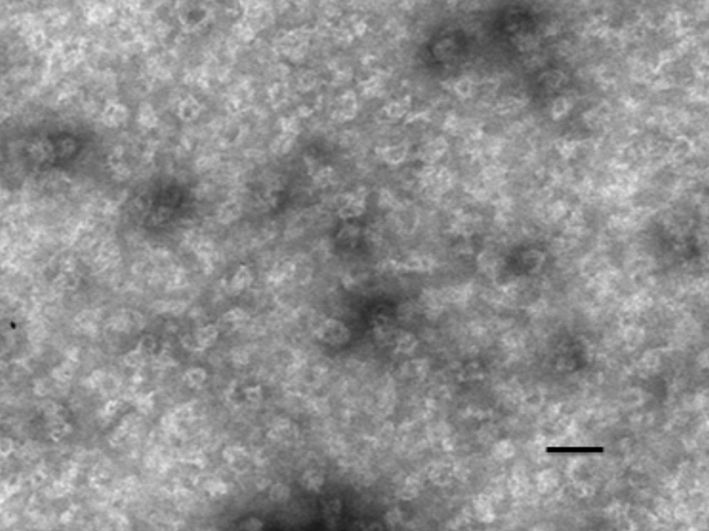
|
图 4 纯化后的HPV-L1-PH病毒样颗粒 (放大倍数100 000,Bar代表 100 nm) |
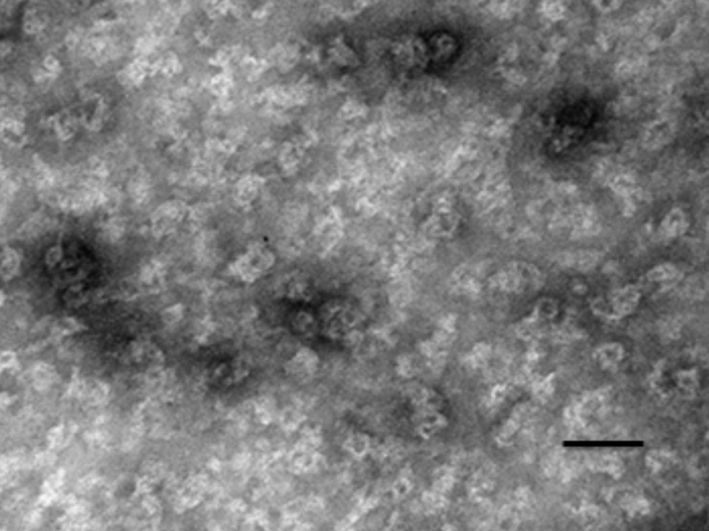
收集的病毒样颗粒加入解组装缓冲液,6 h后透射电镜观察,观察到大量颗粒物,直径约9.5-11 nm之间,其大小与天然HPV16病毒样颗粒五聚体大小相近(图 5)。然后再向解聚成功后的病毒样颗粒加入EGFP表达型质粒50 μg,梯度增加缓冲液中氯化钙浓度过夜后电镜观察,组装后病毒样颗粒恢复到原来的病毒样颗粒结构(图 6)。

|
图 5 HPV-L1-PH病毒样颗粒解聚后形成的颗粒 (放大倍数150 000,Bar代表 100 nm) |
|
图 6 HPV-L1-PH病毒样颗粒重组装电镜下观察 (放大倍数100 000,Bar代表 100 nm) |
IgA肾病预后欠佳,既往研究显示大约20%-30% IgA肾病患者10到20年内即可进展至终末期肾病[7]。IgA肾病病理特征主要表现为肾小球系膜区IgA1和补体C3的沉积,少数伴有IgG或IgM沉积[8]。目前普遍认为Gd-IgA1分子是IgA肾病发病的始动因素[9]。近年来,国内外多项GWAS研究发现多个与IgA肾病发病有关的异常基因[10]。Serino等[11]研究利用miRNA微阵列芯片技术发现IgA肾病患者外周血单个核细胞异常升高的miR-148b与患者循环中Gd-IgA1分子水平升高密切相关。以上研究提示,遗传信息异常与IgA肾病发生发展密切相关。
基因治疗是指将外源基因导入靶细胞,纠正或补偿因基因缺陷和异常引起的疾病,以达到治疗目的。基因载体是基因治疗的递送工具,主要分为病毒载体和非病毒载体:病毒载体就是病毒的外壳或外膜;非病毒载体主要是人工的转导材料,如脂质体、多价阳离子高分子材料。目前应用于临床试验的基因治疗载体比较少,主要受限于其靶向性及安全性,这是基因治疗当前研究热点。基于IgA肾病患者基因异常及Gd-IgA1分子的产生与IgA肾病的发生发展的密切关系,IgA肾病的基因治疗有望成为治疗IgA肾病新方向。人工构造的VLPs具有免疫原性弱,仅诱导机体产生低滴度的中和抗体等优点,现相似构造的疫苗已大范围应用于临床[12]。因此基于上述IgA肾病机制及本课题组既往研究成果,本研究利用暴露在VLPs表面的模拟肽特异性识别Gd-B细胞表面的糖基化缺陷的膜型IgA1分子,采取PCR定点突变技术设计并构建了HPV16 L1PH嵌合质粒,在毕赤酵母中表达并纯化了含有模拟肽PH的VLPs,经过SDS-PAGE及质谱分析获得了HPV-L1-PH嵌合蛋白,电镜下观察到VLPs的解聚和重组装的形态变化。但是需要指出的是,目前我们采用的毕赤酵母表达系统,还存在表达的嵌合蛋白产量低、蛋白纯度有待进一步提高、存在包涵体等问题。相较毕赤酵母表达系统,近年来经发展较快的昆虫表达系统具有较高克隆容量、高效表达、表达产物后加工完善等优点。下一步拟利用杆状病毒表达系统表达VLPs,并可以采用斑点杂交的方法提高筛选效率,还可通过体外位点特异性重组策略提高病毒的重组效率。用两种表达系统产生的VLPs同时感染Gd-B细胞,比较两者优缺点,建立筛选稳定高效的蛋白表达系统。
综上所述,本研究设计构建了HPV-L1-PH表达质粒,并成功表达了HPV-L1-PH嵌合蛋白,验证了VLPs的体外可控解聚和重组装能力。由于目前尚无从IgA肾病病人外周血B细胞中提取的产Gd-IgA1分子的商品化细胞系,我们下一步拟建立IgA肾病Gd-B稳定细胞系,进一步研究该病毒样颗粒对Gd-B细胞特异性的感染作用及效率。通过IgA肾病动物模型研究其靶向递送能力及评估其安全性。
| [1] | Wyatt RJ, Julian BA. IgA nephropathy[J]. N Engl J Med, 2013, 368(25): 2402-2414. DOI: 10.1056/NEJMra1206793. |
| [2] | Novak J, Rizk D, Takahashi K, et al. New insights into the pathogenesis of IgA nephropathy[J]. Kidney Diseases, 2015, 1(1): 8-18. DOI: 10.1159/000382134. |
| [3] | Rauen T, Eitner F, Fitzner C, et al. Intensive supportive care plus immunosuppression in IgA nephropathy[J]. N Engl J Med, 2015, 373(23): 2225-2236. DOI: 10.1056/NEJMoa1415463. |
| [4] | Suzuki H, Fan R, Zhang Z, et al. Aberrantly glycosylated IgA1 in IgA nephropathy patients is recognized by IgG antibodies with restricted heterogeneity[J]. J Clin Invest, 2009, 119(6): 1668-1677. |
| [5] | Wang H, Yang Z, Li F, et al. Insertion of a targeting peptide on capsid surface loops of human papillomavirus type-16 virus-like particles mediate elimination of anti-dsDNA Abs-producing B cells with high efficiency[J]. J Immunother, 2009, 32(1): 36-41. DOI: 10.1097/CJI.0b013e31818dbb8f. |
| [6] | Fleury MJJ, Touze A, Coursaget P. Human papillomavirus type 16 pseudovirions with few point mutations in L1 major capsid protein FG loop could escape actual or future vaccination for potential use in gene therapy[J]. Molecular Biotechnology, 2014, 56(5): 479-486. DOI: 10.1007/s12033-014-9745-1. |
| [7] | Pozzi C, Sarcina C, Ferrario F. Treatment of IgA nephropathy with renal insufficiency[J]. Journal of Nephrology, 2016, 29(4): 1-8. |
| [8] | Maillard N, Wyatt RJ, Julian BA, et al. Current understanding of the role of complement in IgA nephropathy[J]. J Am Soc Nephrol, 2015, 26(7): 1503-1512. DOI: 10.1681/ASN.2014101000. |
| [9] | Reily C, Ueda H, Huang Z, et al. Cellular signaling and production of galactose-deficient IgA1 in IgA nephropathy, an autoimmune disease[J]. Journal of Immunology Research, 2014, 2014: 197548. |
| [10] | Li M, Foo J, Wang J, et al. Identification of new susceptibility loci for IgA nephropathy in Han Chinese[J]. Nature communications, 2015, 6: 7270. DOI: 10.1038/ncomms8270. |
| [11] | Serino G, Sallustio F, Cox SN, et al. Abnormal miR-148b expression promotes aberrant glycosylation of IgA1 in IgA nephropathy[J]. J Am Soc Nephrol, 2012, 23(5): 814-824. |
| [12] | Handler NS, Handler MZ, Majewski S, et al. Human papillomavirus vaccine trials and tribulations: Vaccine efficacy[J]. Journal of the American Academy of Dermatology, 2015, 73(5): 759-767. DOI: 10.1016/j.jaad.2015.05.041. |
 2017, Vol. 38
2017, Vol. 38

