Hypoxia Reoxygenation
肾脏缺血再灌注损伤和细胞凋亡之间的关系是当前的研究热点。肾缺血再灌注损伤 (ischemia-reperfusion injury, IRI) 是引起缺血性急性肾损伤的重要原因之一,在临床上常常发生在肾移植、肾挫伤、休克再复苏后。肾缺血再灌注损伤是指肾脏缺血重获血流灌注或氧供后,组织细胞的功能和结构出现异常,导致肾小管缺血损伤、坏死,损伤肾小球的功能和结构的病理过程,它是一个由多因素参与的病理生理过程,涉及到氧自由基增多、钙超载、中性粒细胞、细胞凋亡、补体系统活化和能量代谢障碍等。胡黄连苷Ⅱ(picroside Ⅱ) 是胡黄连根茎的提取物,可以降低缺血再灌注过程中的氧化应激水平,抑制肾小管上皮细胞的凋亡[1]。胡黄连苷Ⅱ对脑缺血再灌注损伤具有抗细胞凋亡作用[2]。目前关于胡黄连苷Ⅱ对大鼠肾小管上皮细胞缺氧/复氧损伤的保护作用的研究大都集中在动物体内模型,因此本研究拟在细胞水平进一步研究胡黄连苷Ⅱ提取物对缺氧/复氧后肾小管上皮细胞产生细胞氧化应激的保护作用。
1 材料与方法 1.1 材料①胡黄连苷Ⅱ(购于天津奎青医药公司),纯度为98%,溶于1 mol/L的PBS溶液。②仪器:细胞培养箱 (购于长沙华曦电子科技有限公司)。③试剂:胎牛血清 (购于赛默飞世尔生物化学制品有限公司)、DMEM高糖培养基 (购于杭州吉诺生物医药技术有限公司)、Hoechst试剂盒、BCA蛋白质分析试剂盒、SABC法试剂盒 (均购于碧云天生物科技有限公司)。④实验细胞:大鼠肾小管上皮细胞株 (NRK-52E) 购于中国科学院上海生命科学研究院细胞资源中心。⑤对照缓冲液、缺血缓冲液按照Sauvant等[3]的文献配制。
1.2 方法 1.2.1 制备缺氧/复氧细胞模型①细胞培养:将NRK-52E置于含10%胎牛血清的DMEM培养液的培养瓶中培养,细胞铺满瓶壁时胰蛋白酶用消化传代。待细胞培养至足够数量后,将其平均接种于培养皿中。②实验分组及缺氧/复氧模型建立:将培养液换为无血清培养液培养24 h,使其同步化,然后将细胞培养皿随机分组:正常组,缺氧/复氧组,胡黄连苷Ⅱ+正常组、胡黄连苷Ⅱ+缺氧/复氧组。A.正常组:同步化24 h后,替换为对照缓冲液1 ml,3 h后再用含10%胎牛血清的DMEM培养液2 ml常规培养肾小管上皮细胞24 h。B.缺氧/复氧组:同步化24 h后,用无血清、无糖的缺血培养液1 ml在37 ℃、0.5%O2、5%CO2、94.5%N2、饱和湿度的环境中培养肾小管上皮细胞3 h,再灌注时换用含10%胎牛血清的DMEM培养液2 ml,在37 ℃、5%CO2、95%空气的环境中培养24 h。C.胡黄连苷Ⅱ+正常组:同步化24 h后,先于肾小管上皮细胞中加入胡黄连苷Ⅱ(剂量分别为1,10,100,1 000 μg/ml) 预处理,我们加入不同浓度的胡黄连苷Ⅱ与细胞充分作用48 h,余同正常组。D.胡黄连苷Ⅱ+缺氧/复氧组:同步化24 h后,模拟缺血之前,我们加入不同浓度的胡黄连苷Ⅱ(1,10,100,1 000 μg/ml) 与培养液充分作用48 h,余同缺氧/复氧组。
1.2.2 细胞凋亡的检测 1.2.2.1 细胞增殖活性检测将肾小管上皮细胞接种于96孔板培养板中,每个孔加入浓度为5 mg/ml的MTT溶液20 μl,在37 ℃恒温箱中孵育4 h,弃上清液,加DMSO 150 μl,然后置入摇床中低速振荡15 min,最后在酶联免疫检测仪上测定各孔的吸光度 (D) 值。
1.2.2.2 Hoechst染色法检测首先取一试管制备单细胞悬液,然后加入浓度为1 μg/ml的Hoechst33258溶液,在37 ℃水浴7 min。再置于冰上冷却,离心弃染液,加入PBS重悬。后加入浓度为5 μg/ml Hoechst染液,冰浴避光染色30 min,离心弃染液,PBS洗一次。荧光显微镜检测各组细胞,随机采集5个不重复视野,输入计算机图像采集与分析系统,进行图像分析处理,检测阳性细胞数目。
1.2.2.3 丙二醛 (MDA) 含量和超氧化物歧化酶 (SOD) 活性检测取96孔培养板吸去上清液后弃去,加入RIPA细胞裂解液使细胞裂解,4 ℃条件下10 000 r/min离心10 min后取上清,用BCA蛋白质分析试剂盒测定总蛋白浓度后,分别测定培养液中MDA含量和总SOD活性。
1.2.2.4 免疫细胞化学检测用SABC法进行免疫细胞化学染色,严格按说明书操作,检测肾小管上皮细胞 (NRK-52E) Bax蛋白的表达,每次染色都以PBS缓冲液代替一抗作为阴性对照。每个样本随机采集10个无重叠视野 (×400),阳性产物为棕黄色,计数蛋白阳性表达率。
1.2.2.5 Western Blot检测裂解肾小管上皮细胞,收集蛋白样品。取40 μg蛋白行SDS-PAGE电泳,常规条件转膜,4 ℃条件下以1:1 000浓度孵育一抗,1:2 000浓度孵育二抗,然后ECL显色系统显影,用凝胶图像分析系统进行半定量分析。
1.2.2.6 Realtime PCR检测Bax和Bcl-2Trizol试剂提取各组细胞总RNA,核酸蛋白分析仪测定RNA浓度后,取2 μg总RNA按逆转录试剂盒步骤合成cDNA。Bax上游引物:5′-TGAACTGGACAACAACATGGAG-3′,下游引物:5′-AGCAAAGTAGAAAAGGGCAACC-3′;Bcl-2上游引物:5′-TTTGATTTCTCCTGGCTGTCT-3′,下游引物:5′-CTGATTTGACCATTTGCCTG-3′;内参β-actin上游引物5′-TGCTATGTTGCCCTAGACTTCG-3′,下游引物5′-GTTGGCATAGAGGTCTTTACGG-3′。PCR反应条件均为:94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,扩增35个循环,最后一次为72 ℃延伸7 min。最后作熔解曲线,检测PCR产物的特异性,对样品的mRNA含量进行定量分析。
1.3 统计学处理本研究的统计学处理采用SPSS 13.0统计软件,计量资料用x±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 胡黄连苷Ⅱ对各组细胞增殖活性的影响与单纯应用胡黄连苷Ⅱ相比较,胡黄连苷Ⅱ+缺氧/复氧组随着胡黄连苷Ⅱ浓度 (1,10,100,1 000 μg/ml) 增加,其细胞活性不断增加,其中100 μg/ml的胡黄连苷Ⅱ+缺氧/复氧组效果最好,细胞存活率明显高于其余各组 (图 1),故余下实验中胡黄连苷Ⅱ浓度均采用100 μg/ml。
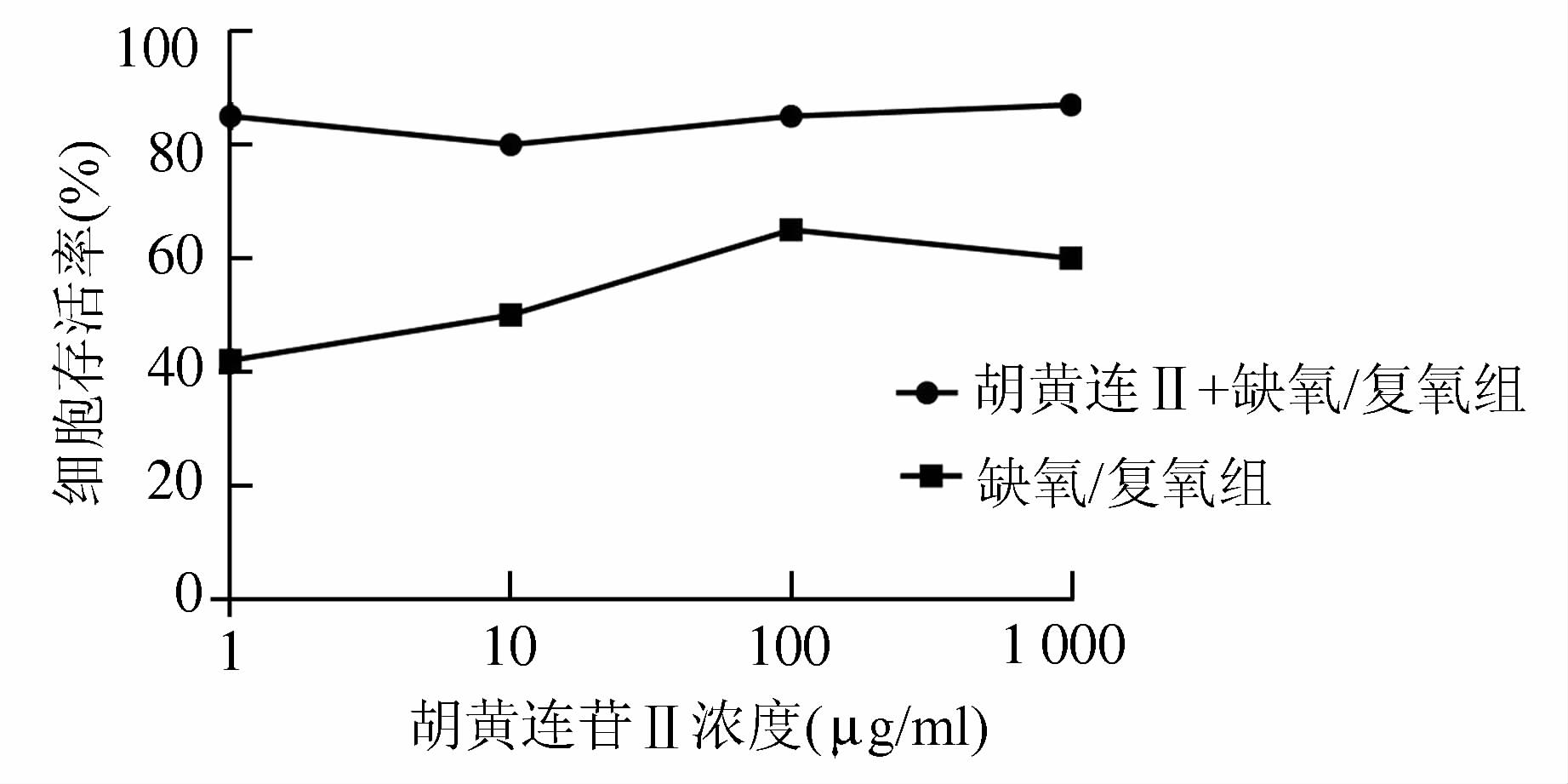
|
图 1 各组细胞MTT检测结果 |
Hoechst染色结果显示 (见图 2),正常组细胞基本未见明显的细胞凋亡或细胞死亡。而缺氧/复氧组较正常组凋亡细胞数量明显增多,差异有统计学意义 (P<0.05)。然而胡黄连苷Ⅱ+缺氧/复氧组较缺氧/复氧组凋亡或死亡细胞显著减少,差异有统计学意义 (P<0.05)。
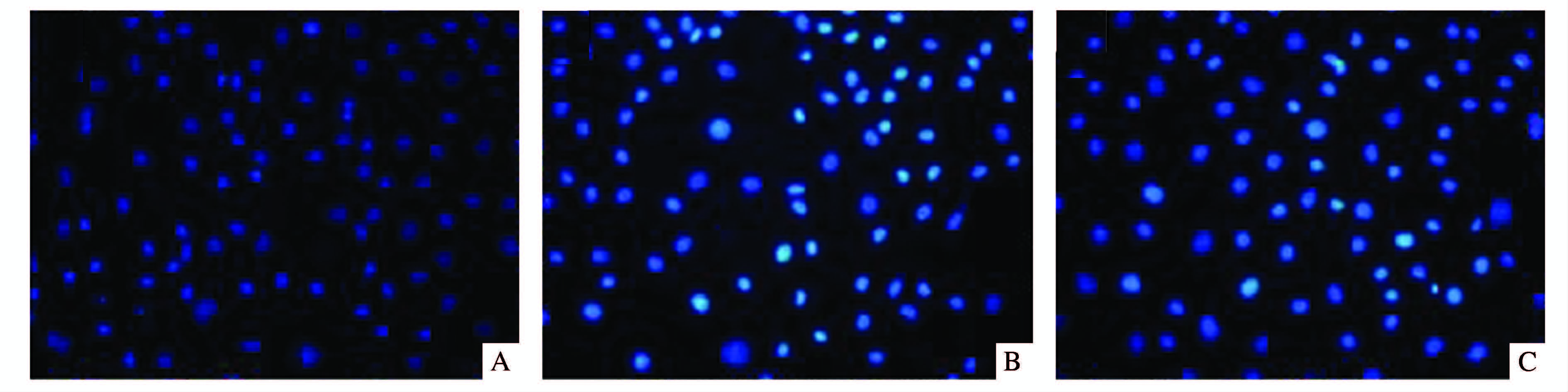
|
图 2 各组细胞Hoechst染色结果 (×200) A.正常组;B.缺氧/复氧组;C.胡黄连苷Ⅱ+缺氧/复氧组 |
(图 3) 与正常组对比,缺氧/复氧组细胞培养液中MDA含量明显升高,SOD活性明显下降,差异有统计学意义 (P<0.05)。而胡黄连苷Ⅱ+缺氧/复氧组培养液中MDA的含量较缺氧/复氧组明显降低,SOD活性表现为明显增高,差异有统计学意义 (P<0.05)。
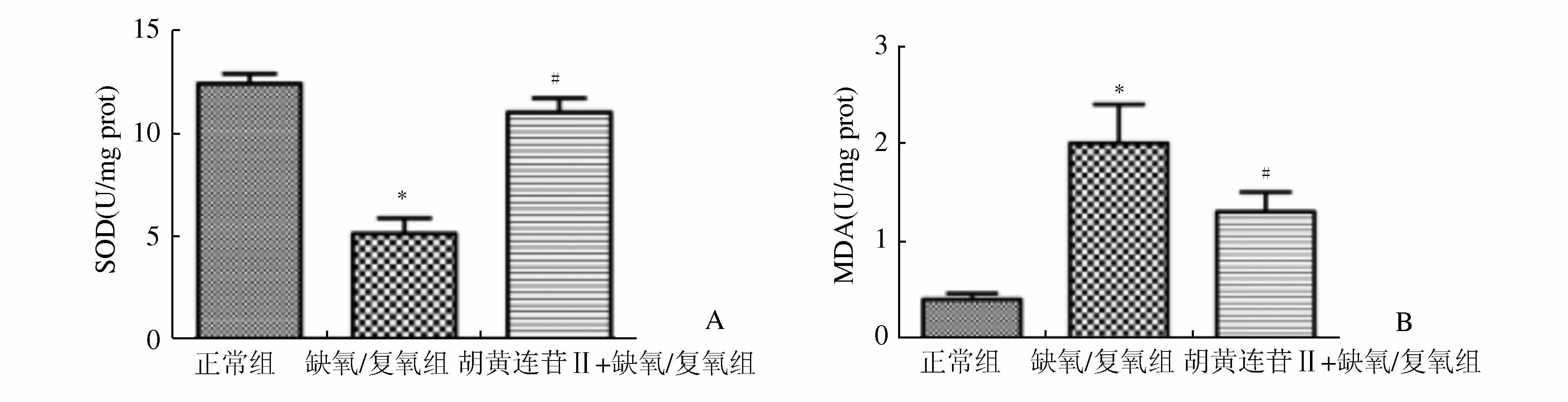
|
图 3 各组细胞SOD、MDA检测结果 A.胡黄连苷Ⅱ对大鼠血清SOD的影响;B.胡黄连苷Ⅱ对大鼠血清MDA的影响与正常组相比,*P<0.05;与缺氧/复氧组相比,#P<0.05 |
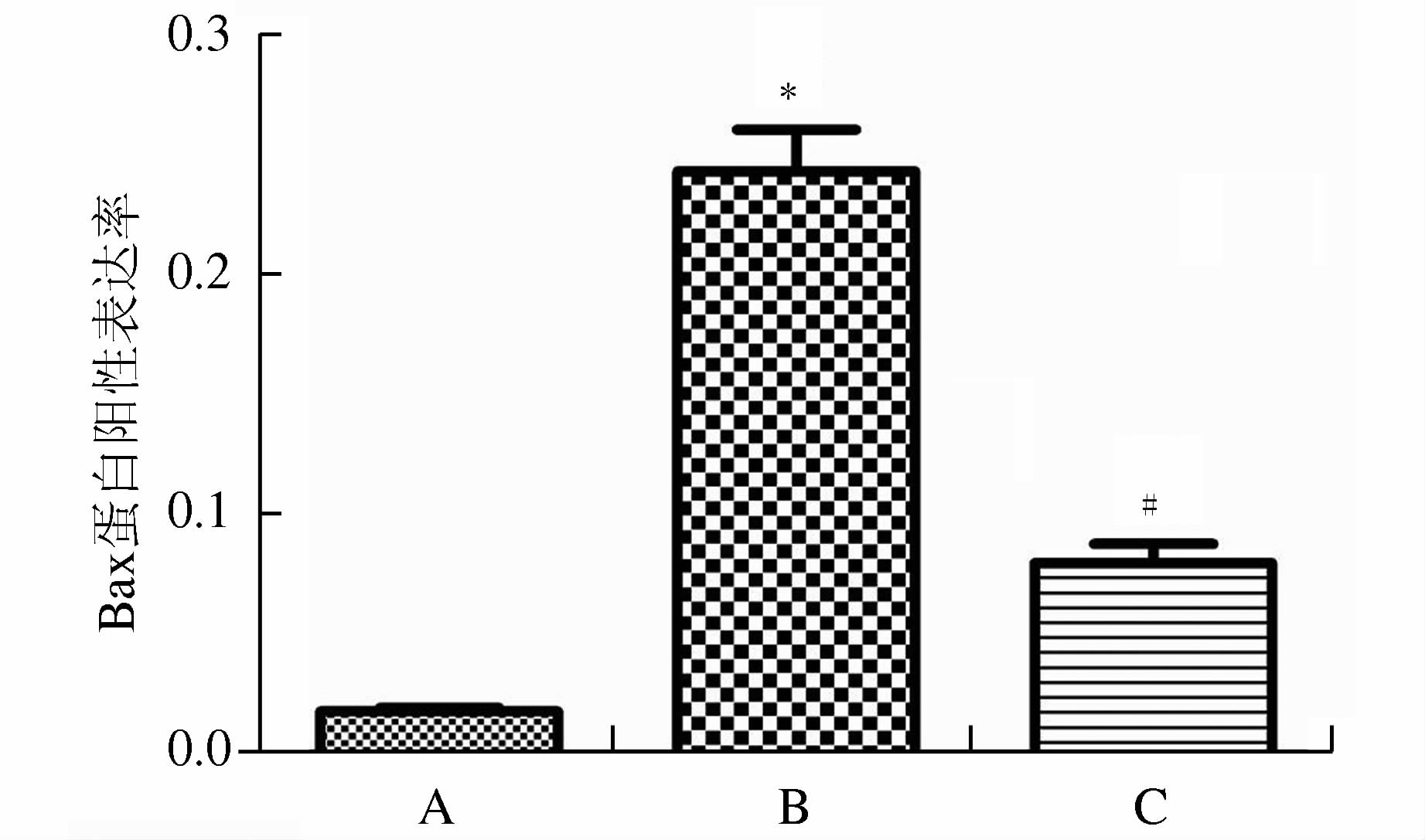
(图 4、图 5) Bax阳性细胞细胞质为棕黄色,细胞核未着色。正常组细胞Bax蛋白表达较低,然而缺氧/复氧组Bax蛋白表达较之有明显增高。缺氧/复氧组Bax蛋白总阳性表达率均明显高于正常组 (P<0.01)。与缺氧/复氧组相比,胡黄连苷Ⅱ+缺氧/复氧组使肾小管上皮细胞Bax蛋白表达下调,Bax蛋白总阳性表达率低于缺氧/复氧组,差异有统计学意义 (P<0.05)。
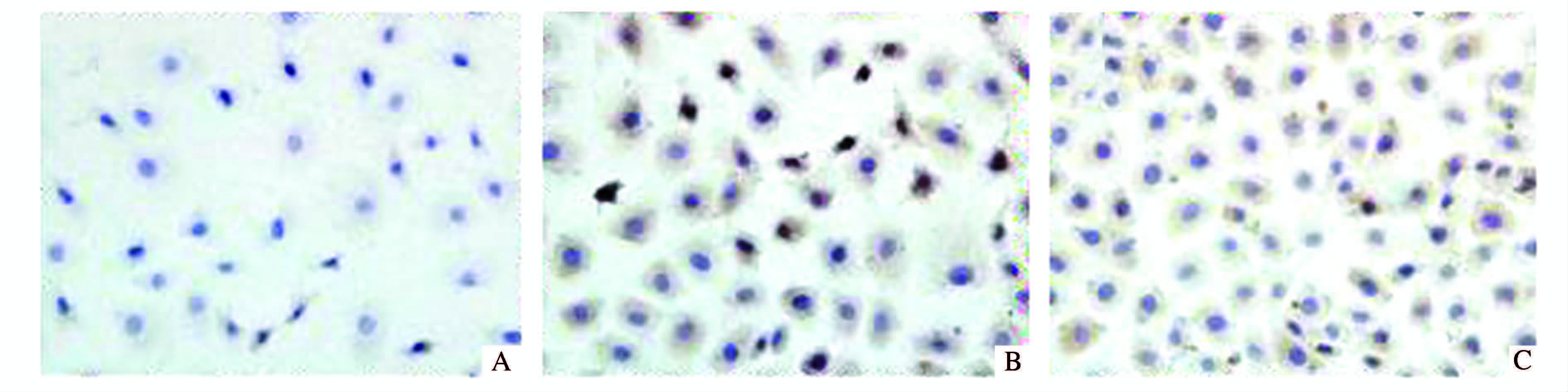
|
图 4 各组细胞Bax蛋白免疫细胞化学染色结果 (×400) A.正常组;B.缺氧/复氧组;C.胡黄连苷Ⅱ+缺氧/复氧组 |
|
图 5 各组细胞Bax蛋白免疫细胞化学染色阳性表达率 A.正常组;B.缺氧/复氧组;C.胡黄连苷Ⅱ+缺氧/复氧组。与正常组相比,*P<0.05;与缺氧/复氧组相比,#P<0.05 |
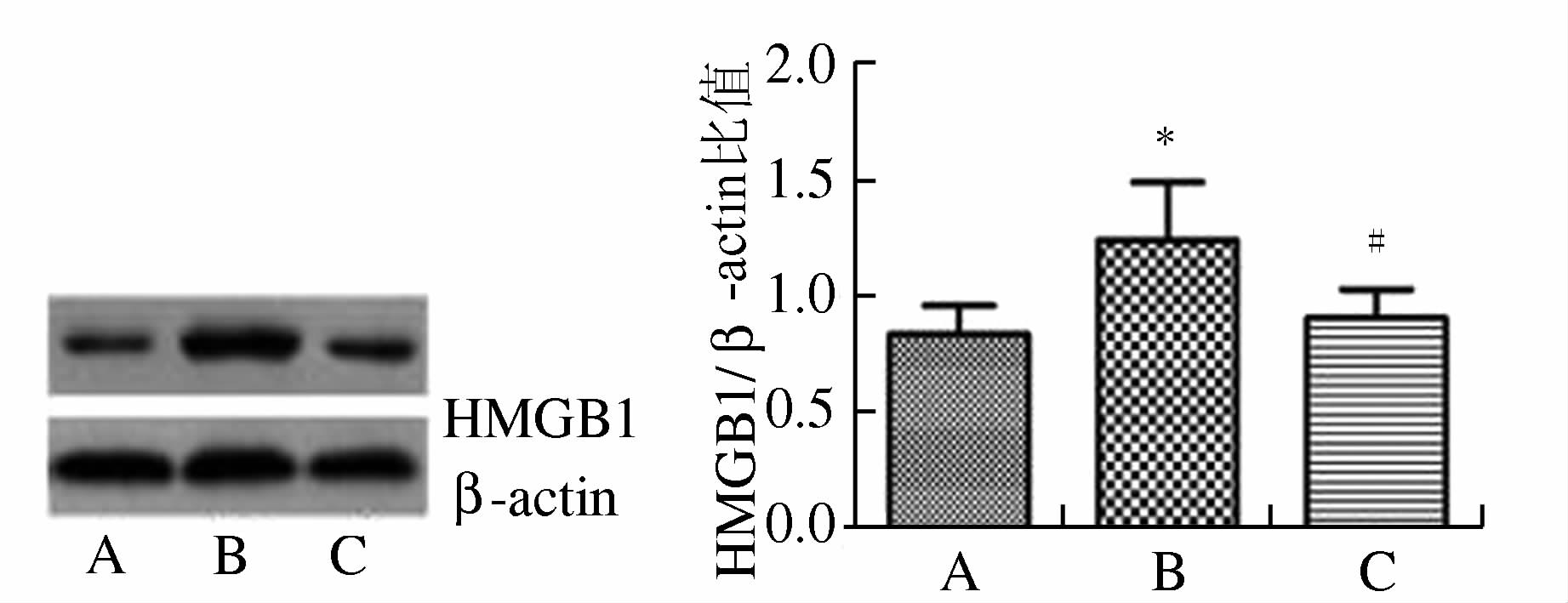
(见图 6) 与正常组相比,缺氧/复氧组的HMGB1蛋白表达水平显著增高,差异有统计学意义 (P<0.05)。而与缺氧/复氧组比较,经胡黄连苷Ⅱ处理的缺氧/复氧组,HMGB1蛋白的表达水平明显下降,差异有统计学意义 (P<0.05)。
|
图 6 各组细胞HMGB1表达的Western blot结果 A.正常组;B.缺氧/复氧组;C.胡黄连苷Ⅱ+缺氧/复氧组与正常组相比,*P<0.05;与缺氧/复氧组相比,#P<0.05 |
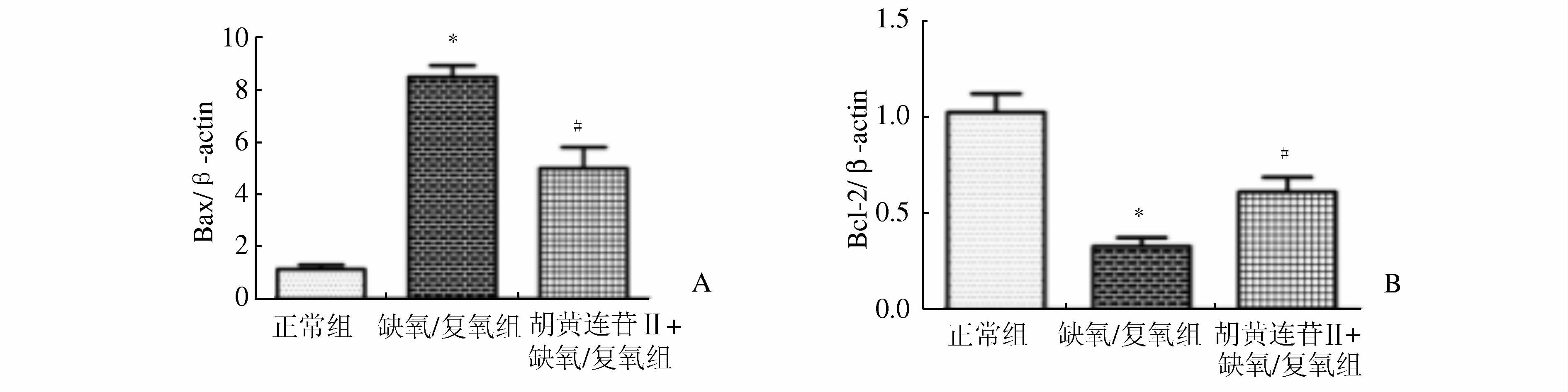
(图 7) 缺氧/复氧组的Bax mRNA水平明显高于正常组,Bcl-2 mRNA水平明显低于正常组,差异有统计学意义 (P<0.05)。与缺氧/复氧组相比,胡黄连苷Ⅱ+缺氧/复氧组的Bax mRNA水平明显减低,Bcl-2水平显著升高,差异有统计学意义 (P<0.05)。
|
图 7 各组细胞Realtime PCR结果 A. Bax mRNA表达结果;B. Bcl-2 mRNA表达结果; 与正常组相比,*P<0.05;与缺氧/复氧组相比,#P<0.05 |
缺血再灌注损伤 (IRI) 是指组织或器官缺血和重新获得血流灌注或氧供应后,机体组织或器官所产生的损伤和功能障碍[4]。肾移植、肾挫伤等易造成肾脏的缺血再灌注损伤,这也是急性肾衰竭的常见原因。多项研究表明,组织或器官的缺血再灌注损伤与氧化应激反应密不可分。组织细胞的缺血再灌注生成大量氧自由基,可导致细胞膜脂质过氧化,从而影响膜结构的稳定和基本功能,甚至引起DNA变性,从而导致细胞凋亡和死亡[5]。而某些抗氧化药物能够对各器官缺血再灌注损伤的氧化应激反应起到显著的缓解作用。
胡黄连苷Ⅱ是胡黄连根茎中有效成分提取物。胡黄连苷Ⅱ中主要的化学活性成分为环烯醚萜苷化合物,因此具有多种生物特性,如抗病毒、抗氧化、抗肿瘤、抗炎等。此外,胡黄连苷Ⅱ在人体心脑血管系统、神经系统和消化系统等都具有较理想的治疗作用。胡黄连苷Ⅱ的长期摄入能提高正常大鼠血浆胆固醇酰基转化酶活性[6]。有研究表明胡黄连苷Ⅱ能提高脑缺血再灌注损伤的神经功能,它可明显改善脑梗死体积和脑细胞凋亡,并下调半胱天冬酶-3和多聚腺苷二磷酸核糖聚合酶的表达[7]。胡黄连苷Ⅱ也具有明显的保肝功能,它可以对抗由四氯化碳或者补体介导引起引起的肝细胞毒性[8]。肝细胞在氧化应激的作用下,其膜性结构遭到自由基的破坏,从而引起一系列的氧化应激损伤。有研究表明胡黄连苷Ⅱ的抗氧化作用能够保护线粒体膜的完整性以及增强线粒体ATP酶的活性[9]。胡黄连苷Ⅱ能有效地减少氧自由基的产生与释放,并减少肿瘤坏死因子相关受体6(ARTF6) 的表达,减少细胞的凋亡和死亡,减轻肾脏缺血再灌注损伤。许瑞瑞等研究表明胡黄连苷Ⅱ对肾脏缺血再灌注损伤具有明显的抗氧化应激保护作用,该作用与实验中胡黄连苷Ⅱ剂量大小有一定关系[10]。
Bcl-2基因是早年在滤泡性非霍杰金淋巴瘤细胞中分离出来一种癌基因。Bcl-2主要存在于所有上皮细胞、淋巴细胞和神经元细胞的线粒体膜、内质网和细胞核膜上。Bcl-2能够直接调节线粒体膜的通透性, 减少促凋亡因子的释放。此外,Bcl-2可通过减少自由基的生成、抑制内质网内Ca2+的释放、抑制细胞色素C的释放和Caspase的激活等机制来阻断细胞的凋亡过程[11]。Bax基因属于Bcl-2基因家族成员之一,但Bax是促凋亡基因, 其功能与Bcl-2大相径庭,它能促进细胞因子缺失而诱导细胞凋亡。Bax能与Bcl-2蛋白结合形成异二聚体,使Bcl-2基因的抗凋亡功能失活从而促进细胞的凋亡[12]。
HMGB1是一种重要的炎性细胞因子,参与了各种炎症的进展过程[13]。Chung等[14]研究表明,采用已烷基丙酮酸盐预处理肾缺血再灌注损伤大鼠模型能抑制HMGB1的分泌和释放,从而达到保护保护肾脏大缺血再灌注损伤的目的。晚期糖基化终末产物受体 (Receptor of advanced glycation end products,RAGE) 是HMGB1的主要受体之一,HMGB1通过与RAGE的结合激活ERK激酶、P38MAPK激酶和c-Jun激酶,并促使NF-κB出现核转位[15]。被HMGB1激活的NF-κB进一步增加TNF-α、ICAM-1和IL-1等炎性介质的释放,引起白细胞的过度聚集,从而加重炎症反应的损伤[16]。
本研究拟在前期建立小鼠肾小管上皮细胞缺血再灌注损伤模型的基础上设置不同梯度浓度胡黄连苷Ⅱ实验组进行药物干预。实验结果发现,其中100 μg/ml的胡黄连苷Ⅱ+缺氧/复氧组效果最好,细胞存活率明显高于其余各组。胡黄连苷Ⅱ的干预可以显著减轻缺氧/复氧处理所造成的组织细胞损伤趋势,降低缺氧所造成的细胞凋亡率。此外胡黄连苷Ⅱ能够降低细胞培养液中MOD的含量和增强SOD的活性,表明胡黄连苷Ⅱ具有显著的抗氧化能力;此外,胡黄连苷Ⅱ能够下调由于缺氧诱导的Bax蛋白表达,上调Bcl-2的表达,升高Bcl-2/Bax的比值,并显著减少了HMGB1的释放,减轻了缺氧/复氧对肾小管上皮细胞造成的损伤。
综上所述,胡黄连苷Ⅱ在体外细胞水平具有显著的抗氧化和抗凋亡作用,能够减轻肾小管上皮细胞的缺氧/复氧损伤,其机制可能与升高Bcl-2/Bax的比值和下调HMGB1的表达有关,这或许可以为临床上治疗肾脏缺血再灌注损伤提供新的思路。
| [1] |
杨永红, 张文博, 袁鹏英, 等. 缺氧复氧后肾小管上皮细胞黏附分子1的表达及胡黄连提取物对其的作用[J].
中国中西医结合肾病杂志, 2013, 14(3): 239-241.
Yang YH, Zhang WB, Yuan PY, et al. Effect of picroside on the expression of ICAM-1 in renal tubular epithelial cells after hypoxia-reoxygenation[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2013, 14(3): 239-241. |
| [2] | Wang T, Zhai L, Zhang H, et al. Picroside Ⅱ Inhibits the MEK-ERK1/2-COX2 Signal Pathway to Prevent Cerebral Ischemic Injury in Rats[J]. J Mol Neurosci, 2015, 57(3): 335-351. DOI: 10.1007/s12031-015-0623-5. |
| [3] | Sauvant C, Schneider R, Holzinger H, et al. Implementation of an in vitro model system for investigation of reperfusion damage after renal ischemia[J]. Cell Physiol Biochem, 2009, 24(5-6): 567-576. DOI: 10.1159/000257513. |
| [4] | Ergin B, Heger M, Kandil A, et al. Mycophenolate mofetil improves renal hemodynamics, microvascular oxygenation, and inflammation in a rat model of supra-renal aortic clamping-mediated renal ischemia reperfusion injury[J]. Clin Exp Pharmacol Physiol, 2016, 42(2): 294-304. |
| [5] | Gupta AK, Jadhav SH, Tripathy NK, et al. Fetal kidney cells can ameliorate ischemic acute renal failure in rats through their anti-inflammatory, anti-apoptotic and anti-oxidative effects[J]. PLoS One, 2015, 10(6): e131057. |
| [6] | Comu FM, Kilic Y, Ozer A, et al. Effect of picroside Ⅱ on erythrocyte deformability and lipid peroxidation in rats subjected to hind limb ischemia reperfusion injury[J]. Drug Des Devel Ther, 2016, 10: 927-931. |
| [7] | Deibert CP, Engh JA. Picroside Ⅱ as a novel inhibitor of apoptosis after cerebral ischemia in rats[J]. Neurosurgery, 2015, 77(2): N17. DOI: 10.1227/01.neu.0000467295.18386.90. |
| [8] | Girish C, Pradhan SC. Hepatoprotective activities of picroliv, curcumin, and ellagic acid compared to silymarin on carbon-tetrachloride-induced liver toxicity in mice[J]. J Pharmacol Pharmacother, 2012, 3(2): 149-155. |
| [9] | Comu FM, Kilic Y, Ozer A, et al. Effect of picroside Ⅱ on erythrocyte deformability and lipid peroxidation in rats subjected to hind limb ischemia reperfusion injury[J]. Drug Des Devel Ther, 2016, 10: 927-931. |
| [10] |
许瑞瑞, 张月月, 徐岩. 胡黄连苷Ⅱ对大鼠肾缺血再灌注损伤的保护作用[J].
山东医药, 2013, 53(36): 7-10.
Xu RR, Zhang YY, Xu Y. The effects of apigenin on renal ischemia/reperfusion injury in rats[J]. Shandong Medical Journal, 2013, 53(36): 7-10. DOI: 10.3969/j.issn.1002-266X.2013.36.003. |
| [11] | Zhang N, Cheng GY, Liu XZ, et al. Expression of Bcl-2 and NF-kappaB in brain tissue after acute renal ischemia-reperfusion in rats[J]. Asian Pac J Trop Med, 2014, 7(5): 386-389. DOI: 10.1016/S1995-7645(14)60061-4. |
| [12] | Ma N, Bai J, Zhang W, et al. Trimetazidine protects against cardiac ischemia/reperfusion injury via effects on cardiac miRNA21 expression, Akt and the Bcl2/Bax pathway[J]. Mol Med Rep, 2016, 14(5): 4216-4222. |
| [13] | Zhou JQ, Qiu T, Zhang L, et al. Allopurinol preconditioning attenuates renal ischemia/reperfusion injury by inhibiting HMGB1 expression in a rat model[J]. Acta Cir Bras, 2016, 31(3): 176-182. DOI: 10.1590/S0102-865020160030000005. |
| [14] | Chung KY, Park JJ, Kim YS. The role of high-mobility group box-1 in renal ischemia and reperfusion injury and the effect of ethyl pyruvate[J]. Transplant Proc, 2008, 40(7): 2136-2138. DOI: 10.1016/j.transproceed.2008.06.040. |
| [15] | Thankam FG, Dilisio MF, Dietz NE, et al. TREM-1, HMGB1 and RAGE in the shoulder tendon: dual mechanisms for inflammation based on the coincidence of glenohumeral arthritis[J]. PLoS One, 2016, 11(10): e165492. |
| [16] | Jin XQ, Ye F, Zhang JJ, et al. Triptolide attenuates cerebral ischemia and reperfusion injury in rats through the inhibition the nuclear factor kappa B signaling pathway[J]. Neuropsychiatr Dis Treat, 2015, 11: 1395-1403. |
 2017, Vol. 38
2017, Vol. 38

 ,
,