鲍曼不动杆菌存在于正常人体的皮肤、呼吸道和泌尿道,也广泛分布于自然界的水及土壤中。该菌是引起医院感染的常见致病菌,常从感染患者的血液、尿、脓液及呼吸道分泌物、脑脊液等标本中分离出来。其为条件致病菌,是医院内感染的重要病原菌,其感染近年呈上升趋势[1],在不发酵革兰阴性菌的感染率仅次于假单胞菌。鲍曼不动杆菌可引起肺炎、伤口感染、尿路感染、菌血症及脑膜炎。
碳青霉烯类药物如亚胺培南和美罗培南等被认为是最后的治疗多重耐药的鲍曼不动杆菌(extensively drug-resistant Acinetobacter baumannii complex, XDRABC)的抗生素[2]。然而,随着碳青霉烯类抗生素在临床的普及,其在临床上越来越多地出现耐药株。XDRABC已经成为临床的困扰。
本文将武汉大学中南医院2015年住院病人作为研究对象,分离菌筛选出检出鲍曼不动杆菌感染的病例,将其分为碳青霉烯类耐药组(carbopenems-resistant Acinetobacter baumannii complex, CRABC)和碳青霉烯类敏感组(carbopenems-susceptible Acinetobacter baumannii complex, CSABC)两组。收集两组病人的基础疾病、临床检查、诊断和治疗的具体信息,并进行统计学分析。期望得出CRABC感染的临床相关性危险性因素,为减少临床耐药菌株的产生和传播提供理论指导。
1 材料与方法 1.1 菌株来源分离自2015年1-12月武汉大学中南医院住院患者的临床标本(同一患者剔除重复标本),包括呼吸道、血液、尿液、引流液和伤口分泌物等临床标本。
1.2 鉴定及药敏采用法国生物梅里埃公司的API鉴定板条进行细菌鉴定。药敏试验为K-B纸片琼脂糖扩散法;药敏结果按照2015年临床实验室标准化研究所(clinical and laborarory standards institute, CLSI)的临界值判断。将药敏试验中对美罗培南和亚胺培南均耐药的鲍曼不动杆菌作为CRABC,中敏也作为耐药株考虑[3]。
1.3 质控卫生部临检中心购买的标准菌株:大肠埃希菌ATCC25922,铜绿假单胞菌ATCC27853。
1.4 统计学分析采用世界卫生组织耐药监测机构提供的WHONET 5.5软件进行菌株的耐药性分析。运用SPSS 16.0软件进行统计学分析,连续变量使用t检验,分类变量采用卡方检验或者Fisher确切概率法[3]。感染CRABC危险因素采用单因素和多因素Logistic回归分析,以P < 0.05为差异具有统计学意义。
2 结果 2.1 菌株分离率2015年1-12月共分离出鲍曼不动杆菌299株,剔除临床资料或者药敏结果缺失的19株,共计280株纳入分析。其中CRABC为201株,CSABC为79株。
2015年1-12月的鲍曼不动杆菌杆菌阳性数量如图 1。其中10月份的感染数量最多,2月份的感染数量最少。
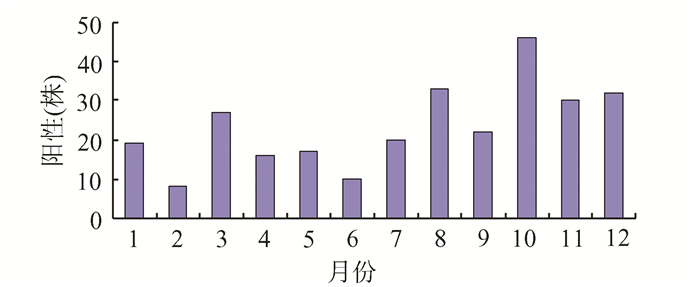
|
图 1 2015年1-12月鲍曼不动杆菌感染数量与时段图 |
280株鲍曼不动杆菌的人口学特征见表 1。其中病人的平均年龄为(65.59±18.57) 岁。其中男性有210人,占75.0%。病人的平均住院天数是(48.11±57.83) d。标本类型主要是呼吸道标本226株,血液11株,尿液6株,引流液和伤口分泌物分别为25株和12株。
| 表 1 感染鲍曼不动杆菌病人的临床基础资料 |
| 表 2 感染CRABC的危险性因素分析 |
280株鲍曼不动杆菌主要来自重症监护室(ICU)、神经内科ICU、呼吸内科ICU、脑外科ICU、普外科和综合科等。
2.3 感染CRABC的危险因素分析根据对亚胺培南和美罗培南的药敏试验结果,将其分为CRABC组和CSABC组。选定的8项可能危险因素有年龄、住院天数、性别、病区、基础疾病、侵入性操作和抗生素使用情况。
201株为CRABC,对碳青霉烯类耐药率已达71.8%,其中对亚胺培南的耐药率为72.5%,对美罗培南的耐药率为72.0%。而根据2010年MOHNARIN耐药监测结果显示,鲍曼不动杆菌对亚胺培南耐药率为53.5%,对美罗培南耐药率为51.9%[4]。
单因素Logistic回归分析显示具有统计学意义的有年龄(OR 0.981, 95% CI 0.966-0.997,P=0.017),标本来源中来自尿液(OR 13.514, 95%CI 1.533-117.592,P=0.018) 的标本;病区中来自ICU(OR 0.118, 95%CI 0.054-0.259,P=0.000)、NCU(OR 3.821, 95%CI 1.541-9.472,P=0.004) 和综合(OR 2.670, 95%CI 1.326-5.377,P=0.006)。列入统计范畴的几种基础性疾病中,在本次研究中均无统计学意义。侵入性操作中的中心静脉导管(OR 0.396, 95%CI 0.232-0.677,P=0.001)、气管插管(OR 0.161, 95%CI 0.087-0.299,P=0.000)、气管切开(OR 0.426, 95%CI 0.204-0.889,P=0.023)、导尿管(OR 0.284, 95%CI 0.160-0.501,P=0.000)、手术引流(OR 0.121, 95%CI 0.055-0.264,P=0.000) 和鼻胃管(OR 0.580, 95%CI 0.343-0.982,P=0.042) 的统计分析均具有统计学意义。在抗生素治疗中碳青霉烯类药物(OR 0.282, 95%CI 0.178-0.551,P=0.000) 的治疗具有统计学意义。
多因素Logistic回归分析显示ICU(OR 0.313, 95%CI 0.107-0.739,P=0.0010)、气管插管(OR 0.279, 95%CI 0.122-0.640,P=0.003)、气管切开(OR 0.251, 95%CI 0.088-0.717,P=0.010)、手术引流(OR 0.322, 95%CI 0.132-0.788,P=0.013) 和碳青霉烯(OR 0.461, 95%CI 0.230-0.922,P=0.029) 类药物的治疗具有统计学意义。
3 讨论重症监护室(ICU)主要收治大手术后或其他有生命危险的危重病人[3]。医院ICU中鲍曼不动杆菌分离率最高,主要与患者接受各种侵袭性治疗或操作有关[6],此外还存在病人之间的交叉感染。所以单因素和多因素Logistic回归分析均提示入住ICU为感染CRABC的危险因素。
本次研究中几种基础疾病均不具有统计学意义,但是我们不得不承认基础疾病影响着病人的免疫力。而在Kimi[2]等的论文中提到对于CRABC引起的菌血症中糖尿病和透析是其危险因素。而在Ye[5]等的论文中其将基础疾病分得更详细,其统计学结果为肝功能缺陷对于感染IR-MDRAB具有统计学意义。本次研究出现的与有关文章不同的结论可能原因是本次所研究的病人群体年龄偏大,他们大部分都有不止一种的基础疾病,所以耐药组和敏感组的差别没有统计学意义。
本次研究显示,我们所调查的几种侵入性操作在单因素Logistic回归分析中均具有统计学差异,其中气管插管、气管切开在多因素Logistic回归分析中也有统计学差异。有报道显示,使用呼吸机24 h和48 h后管道细菌污染率分别为56%和85%,且气管切开或插管后上呼吸道屏障消失,气管插管本身使呼吸道自然防御功能受损,加之吸痰等操作增加了感染机会, 细菌还可经套管旁的间隙进入下呼吸道。Kimi[2]等研究显示,机械通气 > 1周是引起院内获得性鲍曼不动杆菌性肺部感染的首要相关危险因素。虽然一些侵入性操作对于挽救病人是至关重要的,但是本次研究结果却不得不让临床医生对侵入性操作及使用时间的选择更加慎重。尤其对气管切开及插管的患者应加强综合治疗措施,尽量缩短机械通气的时间,争取尽早拔管以减少肺部感染的发生。
碳青霉烯类药物的经验性治疗,是造成其本身耐药性提高的危险因素。其原因很容易被理解为选择性压力的删选。在Kimi[2]等的研究中,碳青霉烯类药物(OR 19.3, 95%CI 4.21-87.9, P=0.001) 是危险因素。而Ye[5]等的研究中,前期碳青霉烯类抗生素的暴露(OR 1.18, 95%CI 1.09-1.27, P < 0.001) 也是危险因素。这与本次研究的分析结果一致。Gehrleinm[4]等研究显示碳青霉烯类药物、第三代头孢抗菌素和氟喹诺酮药物的治疗是产生多重耐药鲍曼不动杆菌的独立危险因素。这将临床医生陷于一个两难的境地,他们既要运用碳青霉烯类药物进行早期的经验性治疗,又担心这样将会造成鲍曼不动杆菌对碳青霉烯类药物耐药率的提高。于是临床医生需要有一个“time at risk”[2]的观念,即在病人出现CRABC之前如何在这段时间里进行合理的抗生素治疗以根除此病原菌,而这个“time at risk”对于每个独立的病人是不同的,这就需要给每个病人提供相应的个性化的治疗。
本次研究显示ICU、侵入性操作中气管插管、气管切开和手术引流均是感染耐碳青霉烯类药物鲍曼不动杆菌的危险性因素。这提示易感病人要求更强烈的介入感染控制措施与集中监测,防止病人间的水平传播,尤其是ICU的病人。碳青霉烯类药物如亚胺培南和美罗培南的使用也是造成本身耐药性产生的危险因素。这要求医生更慎重选择使用抗生素,以防止更广谱耐药菌株的爆发。
目前主要应用替加环素治疗CRABC感染,尤其是菌血症。在某些情况下,多黏菌素也作为现阶段的治疗选择。此外应用更多的是联合治疗。舒巴坦是β-内酰胺酶抑制剂,可以直接抗不动杆菌属的活性,故含舒巴坦的复合制剂对不动杆菌具有良好的抗菌活性。国内目前较多采用以头孢哌酮/舒巴坦为基础的联合方案,临床亦有治疗成功病例,但缺乏大规模临床研究。Gehrleinm [4]等研究显示,70%的多重耐药对多黏菌素联合多西环素敏感,具有良好的临床效果。Santimaleeworagun[7]等对8株CRABC的药敏试验表明,舒巴坦联合磷霉素使用有较强的协同作用,对治疗CRABC是不错的选择。
不管是临床医生还是微生物学专家,都应该积极开发作用于新靶位的抗生素,为病人带来康复的福音。此外,加强耐药监测,合理使用侵入性操作和抗生素、防止院内感染仍是医务人员和微生物工作者所面临的重要任务和巨大挑战。
| [1] | Perez F, Hujer AM, Hujer KM, et al. Global challenge of multidrug-resistant Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2011, 51(10): 3 471-3 484. |
| [2] | Kimi YJ, Kim SI, Hong KW, et al. Risk factors for mortality in patients with carbapenem-resistant Acinetobacter baumannii bacteremia: impact of appropriate antimicrobial therapy[J]. J Korean Med Sci, 2015, 27(5): 471-475. |
| [3] |
李耘, 吕媛, 薛峰, 等. 我国2009至2010年MOHNARIN项目临床分离常见病原菌的耐药监测[J].
中华检验医学杂志, 2015, 35(1): 67-87.
Li G, Lu Y, Xue F, et al. Antimicobial Suscepibiliry Surveillance in China a MOHNARIN Program Report (2009-2010)[J]. Chinese Journal Laboratory Medicine, 2015, 35(1): 67-87. |
| [4] | Gehrleinm M, Leying H, Cullmann W, et al. Imipenem resistance in acinetobacter baumannii is due to altered penicillin-binding Proteins[J]. Chemother, 1991, 37(6): 405-412. DOI: 10.1159/000238887. |
| [5] | Ye JJ, Huang CT, Shie SS, et al. Multidrug resistant Acinetobacter baumannii: risk factors for appearance of imipenem resistant strains on patients formerly with susceptible strains[J]. PLoS One, 2010, 5(4): e9947. DOI: 10.1371/journal.pone.0009947. |
| [6] | Miyasaki Y, Morgan MA, Chan RC, et al. In vitro activity of antibiotic combinations against multidrug-resistant strains of Acinetobacter baumannii and the effects of their antibiotic resistance determinants[J]. FEMS Microbiol Lett, 2015, 328(1): 26-31. |
| [7] | Santimaleeworagun W, Wongpoowarak P, Chayakul P, et al. In vitro activity of colistin or sulbactam in combination with fosfomycin or imipenem against clinical isolates of carbapenem-resistant Acinetobacter baumannii producing OXA-23 carbapenemases[J]. Southeast Asian J Trop Med Public Health, 2011, 42(4): 890-900. |
 2017, Vol. 38
2017, Vol. 38

