2. 华中科技大学同济医学院附属协和医院神经内科 湖北 武汉 430022
2. Dept. of Neurology, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China
低氧预处理对其后的神经元缺血缺氧损伤有保护作用[1, 2],其机理一般认为是通过改变细胞内信号传递通路来实现的[2, 3]。海马是对缺氧损伤最敏感的脑区之一。神经元缺氧时突触抑制较早发生,而离体海马突触环路完整,突触功能可以通过诱发电位记录,因此海马常用于缺氧对神经突触作用研究[4, 5]。c-fos是一种即刻早期反应基因,神经元活动如缺氧刺激等表达活跃,被广泛用作神经元活动的标志物。其表达的Fos蛋白通过细胞内信号传导通路对许多靶基因发挥调控作用[6]。本研究通过观察低氧预处理对缺氧引起的大鼠海马群峰电位抑制、神经元c-fos表达的影响,探讨低氧预处理减轻缺氧性神经突触抑制的机制。
1 材料与方法 1.1 主要试剂人工脑脊液、DMEM/F12购于HyClone公司,胎牛血清、马血清购于Gibco公司,0.25%胰蛋白酶-EDTA消化液和青、链霉素混合液、谷氨酰胺购于Solarbio公司,c-fos免疫组化试剂盒购于武汉博士德公司。
1.2 模型制备及实验方法 1.2.1 大鼠海马脑片制作及脑片低氧预处理模型取雄性成年Wistar大鼠(华中科技大学同济医学院实验动物中心提供),体重120-200 g,麻醉下断头取脑置于4 ℃、95%O2+5%CO2饱和的人工脑脊液中,仔细剥出双侧海马,垂直于海马长轴切成400 μm薄片。将全部脑片置于34 ℃人工脑脊液内,通入95%O2+5%CO2混合气,孵育1.5-2 h待用。脑片低氧预处理模型制作是将脑片置于自制的34 ℃半浸式浴槽内,通入95%N2+5%CO2无氧混合气3 min,后再改通95%O2+5%CO2有氧混合气20 min,如此反复3次。
1.2.2 脑片诱发电位记录和实验分组孵育后的脑片置于半浸式浴槽中,通入95%O2+5%CO2混合气,流量200 ml/min。由三道电子刺激器(Kohden SEN7130,日本)输出方波信号,波宽100 μm,电流强度0.1-0.4 mA。经隔离器内直径40 μm的绝缘不锈钢丝制成的双极电极,进行CA3区Schaffer侧支刺激,记录电极为自制玻璃微电极,内充4 mol/L NaCl,电极电阻4-15 MΩ,电信号经微电极放大器(Kohden MEZ8201,日本)放大后显示在示波器(Kohden VC-10) 上监测,记录CA1区椎体细胞诱发群峰电位(population spike, PS),联机存储处理。
实验分组:对照组(n=8) 不进行缺氧处理;缺氧组(n=8) 开始通入90%N2+10%CO2 200 ml/min即为开始缺氧;低氧预处理组(n=8) 低氧预处理的脑片,随后处理同缺氧组。记录群峰电位开始减小的时间和完全消失的时间。
1.2.3 原代大鼠海马神经元培养及神经元低氧预处理取当天新生Wistar大鼠(同济医学院实验动物中心提供),75%乙醇溶液消毒,无菌条件下断头取脑,分离出双侧海马并剪碎,0.125%胰蛋白酶37 ℃消化30 min。显微镜下观察细胞间连接透亮后,终止消化,200 μm滤网筛除未消化的组织块,收集滤液离心,吸弃上清液,用种植培养液(DMEM/F12 80%、胎牛血清10%、马血清10%、谷氨酰胺100 μg/ml,加入青链霉素使其终浓度为1%)。稀释细胞接种于24孔培养板,置于37 ℃10%CO2培养箱,3-5 d后,加入细胞分裂抑制剂阿糖胞苷3 μg/ml,抑制非神经细胞增殖,作用24 h时更换饲养培养液(DMEM/F12 90%、马血清10%、谷氨酰胺100 μg/ml,加入青链霉素使其终浓度为1%),以后每3 d更换培养液1次,第7-11天备用。神经元低氧预处理是自细胞培养后第5天起,每天将培养的神经元置于密闭的37 ℃低氧(89%N2 +1%O2+10%CO2)恒温容器中30 min,总共处理5 d。
1.2.4 培养海马神经元免疫组织化学染色和实验分组细胞以5×105-1×106/ml的密度接种于35 mm培养皿,采用随机数字表法分为3组:对照组(n=6) 不进行缺氧处理;缺氧组(n=6) 于培养液中通入90%N2+10%CO2缺氧5 min;低氧预处理组(n=6):选择经过低氧预处理的培养神经元,随后处理同缺氧组。按以下程序行免疫组织化学染色:① 0.03%H2O2甲醇室温下孵育30 min,正常单血清1:10在37 ℃下作用1 h;② 加入羊抗c-fos(n=6) 血清(1:100) 中4 ℃孵育72 h;③ 生物素化兔抗羊IgG(1:100)37 ℃作用1 h;④ 链霉亲和素-生物素复合物(1:100)37 ℃作用1 h,用葡萄糖氧化酶-硫酸镍胺法显色10 min。免疫组织化学图像分析:随机抽取50个相邻视野,在显微镜下分别计数视野中c-fos免疫反应阳性和阴性神经元数目,计算阳性神经元所占百分率。应用TTTY-400TC真彩色细胞图像分析仪对各组阳性神经元进行平均光密度分析。
1.3 数据统计与分析数据采用SPSS 13.0统计学软件处理,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,重复测量资料比较采用重复测量设计资料的方差分析,以P<0.05为差异有统计学意义。
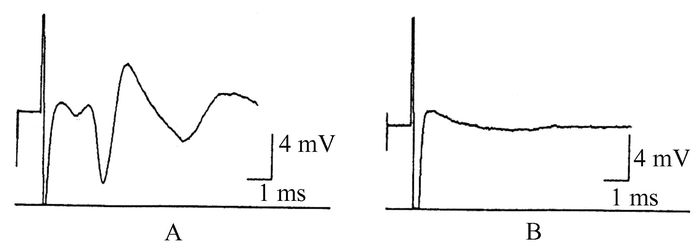
2 结果 2.1 低氧预处理对缺氧抑制海马脑片群峰电位的影响由于海马CA3区和CA1区椎体细胞之间具有突触联系,当局部刺激CA3区侧支通路时,在CA1椎体细胞层可记录到一个幅度较大的PS,系经突触传递诱发的椎体细胞群体的细胞外电位。本实验中发现缺氧2-3 min后PS波幅即开始降低,时程增加,波宽变大,随后逐渐消失(见图 1)。
|
图 1 不同时间点记录的海马脑片群峰电位 A:为开始缺氧前记录的海马脑片群峰电位;B:为缺氧后群峰电位消失 |
我们首先观察了低氧预处理对PS幅值的影响,即以开始低氧预处理前最后时间点的PS幅值为A1,低氧预处理后10 min时记录PS幅值为A2。以A1为100%进行比较,发现低氧预处理后PS幅值的相对平均值为(109.32±8.13)%(n=8),差异有统计学意义(P<0.05)。进一步观察了缺氧抑制海马脑片群峰电位的影响发现经过低氧预处理处理的脑片在缺氧后PS开始减小的时间和完全消失的时间,较缺氧组明显延长,分别为(4.52±0.99) min和(9.04±1.93) min(见表 1)。
| 表 1 低氧预处理对缺氧时大鼠海马脑片群峰电位变化的影响 |
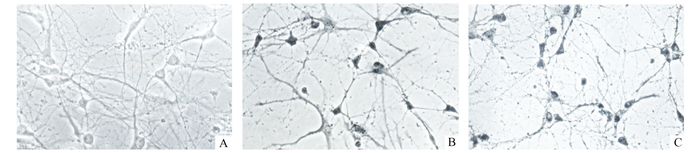
经低氧预处理后的培养海马神经元缺氧后,c-fos表达阳性的细胞数明显少于缺氧组,表达量较缺氧组明显减少,图像分析显示,经低氧预处理后,其平均光密度明显低于缺氧对照组(P<0.05)(见图 2、表 2)。
|
图 2 低氧预处理后海马神经元c-fos蛋白表达变化(×400) A:低氧预处理前的海马神经元;B:缺氧后海马神经元c-fos免疫组化染色;C:低氧与处理后海马神经元缺氧时c-fos免疫组化染色 |
| 表 2 3组培养大鼠海马神经元c-fos表达的比较(n=18,x±s) |
海马是对缺氧最敏感的脑区之一,海马细胞和纤维排列有序,海马细胞易于分离、离体脑片制作简单且方便观察突触功能,因此无论是培养海马神经元还是离体海马广泛用于缺氧研究[4, 5, 7]。
本实验的结果表明,低氧预处理后海马脑片诱发电位PS的幅值显著性大于预处理前,其幅值增加接近8%。低氧预处理可以增加PS幅值,推测其原因为抑制性中间神经元对缺氧更敏感,抑制作用降低所致[8]。神经系统对低氧早期的反应通常是突触传递的可逆性阻断,当灌注液中氧气被氮气所代替时,由于氧分压急剧下降,几分钟内下降到激活突触后神经元的阈值之下,PS即被阻断[8]。低氧预处理的脑片,缺氧时PS减小和消失的时间明显延长,与未经处理的缺氧组比较有显著性差异。说明低氧预处理可以保护缺氧引起的神经突触抑制。
细胞在正常条件下c-fos表达较低,本实验中对照组c-fos表达水平低,缺氧组和低氧预处理组经过缺氧后c-fos表达水平明显高于对照组,缺氧可以刺激细胞c-fos表达,表达的Fos蛋白进而调控靶基因发挥转录[6, 9]。由于脑缺血缺氧诱导c-fos在脑内快速而短暂的表达,其mRNA及Fos蛋白被认为是细胞对缺血损伤的敏感标记[10]。我们的结果发现低氧预处理组c-fos表达水平低于缺氧组。说明低氧预处理处理可以降低c-fos表达,这种降低也许是其可以保护缺氧性神经突触抑制的机制。因此从本实验观察的结果推测,低氧预处理降低c-fos表达,进而改变了Fos蛋白激活的下游机制,延缓了缺氧对神经突触功能的抑制而变现为保护作用。
综上所述,低氧预处理处理可以减轻缺氧对海马神经突触功能的抑制作用,其机制与降低c-fos表达改变了c-fos介导的信号传导通路相关。
| [1] | Do Val-da Silva RA, Peixoto-Santos JE, Scandiuzzi RC, et al. Decreased neuron loss and memory dysfunction in pilocarpine-treated rats pre-exposed to hypoxia[J]. Neuroscience, 2016, 332: 88-100. DOI: 10.1016/j.neuroscience.2016.06.047. |
| [2] | Rybnikova E, Samoilov M. Current insights into the molecular mechanisms of hypoxic pre-and postconditioning using hypobaric hypoxia[J]. Front Neurosci, 2015, 23(9): 388. |
| [3] | Cox-Limpens KE, Gavilanes AW, Zimmermann LJ, et al. Endogenous brain protection: what the cerebral transcriptome teaches us[J]. Brain Res, 2014, 1564: 85-100. DOI: 10.1016/j.brainres.2014.04.001. |
| [4] | Schmidt-Kastner R. Genomic approach to selective vulnerability of the hippocampus in brain ischemia-hypoxia[J]. Neuroscience, 2015, 309: 259-279. DOI: 10.1016/j.neuroscience.2015.08.034. |
| [5] | Zhou C, Bell JJL, Sun H, et al. Hypoxia-induced neonatal seizures diminish silent synapses and long-term potentiation in hippocampal CA1 neurons[J]. J Neurosci, 2012, 31(50): 18211-18222. |
| [6] | Nathaniel TI, Soyinka JO, Adedeji A, et al. Molecular and physiological factors of neuroprotection in hypoxia-tolerant models: Pharmacological clues for the treatment of stroke[J]. J Exp Neurosci, 2015, 26(9): 1-5. |
| [7] | Vieira M, Fermandes J, Carreto L, et al. Ischemic insults induce necroptotic cell death in hippocampal neurons through the up-regulation of endogenous RIP3[J]. Neurobio Dis, 2014, 68: 26-36. DOI: 10.1016/j.nbd.2014.04.002. |
| [8] | Garcia AJ, Putnam RW, Dean JB. Hyperbaric hyperoxia and normobaric reoxygenation increase excitability and activate oxygen-induced potentiation in CA1 hippocampal neurons[J]. J Appl Physiol, 2010, 109(3): 804-819. DOI: 10.1152/japplphysiol.91429.2008. |
| [9] | Zhang H, Li L, Xu GY, et al. Changes of c-fos, malondialdehyde and lactate in brain tissue after global cerebral ischemia under different brain temperatures[J]. J Huazhong Univ Sci Technolog Med Sci, 2014, 34(3): 354-358. DOI: 10.1007/s11596-014-1282-4. |
| [10] | Souza A, Dussan-Sarria JA, Medeiros LF, et al. Neonatal hypoxic-ischemic encephalopathy reduces c-Fos activation in the rat hippocampus: evidence of a long-lasting effect[J]. Int J Dev Neurosci, 2014, 38: 213-222. DOI: 10.1016/j.ijdevneu.2014.09.003. |
 2017, Vol. 38
2017, Vol. 38

