原发性肝癌(primary liver cancer, PLC)是临床最常见的恶性肿瘤之一,我国每年新发PLC病例占全球50%以上,发病率已上升至世界第二[1]。PLC好发于成年男性,高发于东南沿海地区,目前关于该症的发病机制尚无定论,多数学者普遍认为其发病与病毒性肝炎、肝硬化和环境之中致癌物质有关[2]。PLC早期起病隐匿,进展快、恶化程度高,其致死率位居各类恶性肿瘤前列,占癌症相关死亡因素第三位。随着现代医疗科技的迅速发展,PLC早期诊断率和生存率已有显著提升,手术治疗是肝癌患者的首选有效治疗方式,但由于多数患者一经确诊已处于中晚期,失去最佳手术时机,目前手术切除率仍仅有20.0%-30.0%,多数患者尤其是晚期患者,仍需接受如经皮肝动脉化学治疗(transarterial chemoembolization, TACE)、射频消融(radiofrequency ablation, RFA)及中药、西药等其他治疗手段,以改善近期疗效,延长生存期。PLC属典型富血管肿瘤,对传统细胞毒类化疗药物敏感性不高,因此治疗过程中抗肿瘤血管生成非常关键。阿帕替尼是国家食品药品监督管理总局(CFDA) 2014年10月批准上市的一种新型口服小分子抗血管生成制剂,可通过抑制血管内皮细胞生长因子受体-2(VEGFR-2)而抑制肿瘤生长,目前被证实在多种实体瘤实验中有着良好抗血管生成作用,多用于治疗晚期胃腺癌,或胃-食管结合部腺癌三线及以上的治疗[2]。但目前有关其用于Ⅲ期PLC的报道仍相对较少,本研究探讨阿帕替尼治疗晚期PLC患者的疗效及安全性,旨在为临床提供指导。
1 资料与方法 1.1 一般资料本研究已获得伦理委员会批准和患者知情同意。研究对象选取我院肿瘤科2015年12月至2016年11月间收治的72例晚期PLC患者,纳入标准[3]:①均符合临床关于Ⅲ期PLC的诊断标准,且经B超、CT、DSA造影确诊;②年龄18-70岁;③Karnofsy评分>70分;④均知悉本研究并签署知情同意书。排除标准:①合并急性心梗、窦性心动过缓、Ⅱ°及以上房室阻滞等严重心脏病者;②合并主要脏器功能障碍者;③合并化脓性或慢性感染性伤口迁延不愈者;④有精神病史者;⑤入组前1个月内接受过放疗、化疗、生物治疗者;⑥存在化疗禁忌证者;⑦孕妇或哺乳期女性。
1.2 方法对照组患者给予最佳支持治疗及安慰剂治疗, 观察组患者给予口服甲磺酸阿帕替尼(江苏恒瑞医药股份有限公司,H20140104,0.425 g)口服,850 mg/次、1次/d,以温开水送服。出现3级以上毒副作用时予以停药(不超过2周)及对症处理,待好转之后继续减量予425 mg/次,服用至疾病进展或出现不可耐受的毒副作用。
1.3 观察指标① 比较两组患者的近期临床疗效;②比较两组患者的总生存期;③比较两组患者用药后的不良反应。
1.4 评价标准[4]参照《实体瘤疗效评价标准(RECIST)指南1.1版》对临床疗效进行评定分为:①完全缓解(CR):肿瘤消失且持续4周以上;②部分缓解(PR):肿瘤体积缩小50%以上且持续4周以上;③稳定(SD):肿瘤缩小不到50%;④疾病进展(PD):肿瘤增大25%以上。疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%,客观缓解率(objective response rate,ORR)=(CR+PR)/总例数×100%。
生存期(OS):对两组患者进行出院后随访,随访时间为12个月,截止为2017年11月,随访率100%,终点为死亡或随访末期。
1.5 统计学方法所有统计学资料都采用SPSS 21.0专业统计学软件进行数据分析,计量资料以均数±标准差表示,进行t检验。而所有的计数资料以率(%)表示,用χ2检验,以P<0.05为差异具有统计学意义。
2 结果 2.1 两组患者的一般资料比较两组患者的一般资料[性别、年龄、肿瘤直径、甲胎蛋白(AFP)水平]比较无明显差异(P>0.05),具有可比性,详见表 1。
| 表 1 两组患者的一般资料比较 |
观察组的客观缓解率为41.67%,对照组为19.44%,观察组明显高于对照组(χ2=4.19, P=0.04);观察者的疾病缓解率为58.33%,对照组为30.56%,观察组明显高于对照组(χ2=5.63, P=0.02),详见表 2。
| 表 2 两组患者的临床疗效比较[n(%)] |
随访期间,观察组患者的总生存期(DOS)为7.9(5-10)月,平均为(7.19±1.59)个月,对照组的DOS为5.0(2-8)月,平均为(4.38±1.32)个月,差异均有统计学意义(log-rank χ2=38.623,P<0.05)(t=8.159,P=0.000),详见图 1。
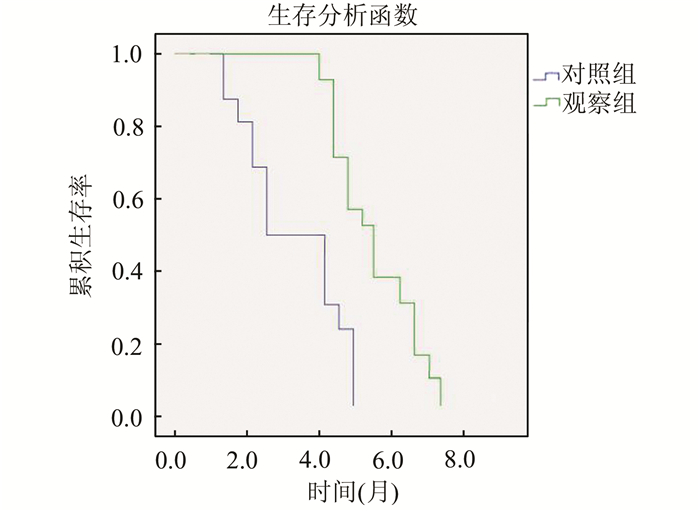
|
图 1 两组患者Kaplan-Meier生存时间曲线 |
观察组的有31例(86.11%)发生不良反应,对照组有26例(72.22%),两组比较无明显差异(P>0.05),详见表 3;观察组中11例不良反应为Ⅲ级、Ⅳ级(30.56%),对照组有8例(22.22%),多为高血压和蛋白尿Ⅲ级、Ⅳ级,两组比较无明显差异(P>0.05)。
| 表 3 两组患者的不良反应比较[n(%)] |
PLC是发生于肝细胞和(或)肝内胆管上皮细胞的恶性肿瘤,近年来PLC的治疗进展得到明显提升,多种治疗方式虽客观上提高了晚期肝癌患者的短期疗效,但其总体预后仍不理想。报道显示,临床如仅给予PLC患者最佳支持治疗,就平均生存期而言,欧美国家可达6-9个月,而除日本以外的亚洲患者仅为3-4个月[5]。药物治疗方面,目前能有效治疗晚期PLC患者的药物有索拉非尼,国内外文献均表明索拉菲尼能够延长晚期PLC患者生存时间,因此被各国多用于无法手术或远处转移的晚期PLC患者[6]。但后期临床使用结果表明,索拉非尼总体客观有效率仍然偏低,患者生存时间获益有限,较多的毒副作用和高昂的价格进一步限制了该药的临床使用[7]。且索拉非尼治疗进展后患者面临无药可用的困境,因此晚期PLC急需寻找新的治疗药物。
既往研究发现新生血管生成与肿瘤的发展有着直接关系,因此在探索治疗肿瘤的过程中,如何抗血管生成,对于控制肿瘤增殖、延缓病情意义重大。有研究认为[8],肿瘤血管的生成步骤是一个井然有序的动态过程,具体表现为肿瘤血管生成因子増多,抑制因子逐步减少,破坏了动态平衡,降解了血管内皮的基底膜,其屏障作用减弱或丧失;血管内皮细胞增殖速度加快并向肿瘤组织周围迁移。因此黏附分子、蛋白水解酶、血管内皮生成因子、抗血管内皮生成因子等同时参与肿瘤血管的生成过程,而血管内皮生长因子(VEGF)及其血管内皮生长因子受体(VEGFR)介导的信号传导通路在调控肿瘤血管生成过程中发挥重要作用。VEGFR家族包括血管内皮细胞生长因子受体-1(VEGFR-1)(Flt-1)、VEGFR-2(KDR/Flk-1)、血管内皮细胞生长因子受体-3(VEGFR-3)(Flt-4)及VEGFR共受体神经毡蛋白1和VEGFR共受体神经毡蛋白。VEGFR-2主要表达于内皮细胞,主要作用是调节细胞有丝分裂、促进血管生成及增强VEGF的扩散。因此,VEGFR-2的表达被认为与肿瘤血管生成关系最为直接[10]。随着抗血管生成药物的发展,作用于VEGF及VEGFR信号通路的抗肿瘤药物引起临床的重视。甲磺酸阿帕替尼是我国恒瑞医药公司自主研发的,也是具有自主知识产权的小分子VEGFR酪氨酸激酶抑制剂Vatalanib (PTK787)的衍生物。作为小分子抗血管生的成靶向药物,其靶点包括VEGFR-1,VEGFR-2,PDGFR,c-KIT,c-Src等,其中对VEGFR-2的活性高出PTK787的13.7倍。甲磺酸阿帕替尼是一种新型口服小分子抗血管生成制剂,可高度选择性地结合并抑制VEGFR-2,抑制肿瘤血管衍生,从而遏制肿瘤的发育。相关文献报道[9],甲磺酸阿帕替尼与VEGFR-2结合力较索拉非尼强10倍,该受体与酪氨酸激酶ATP结合失败而致酪氨酸激酶无法被激活,通路的VEGF生成减少,最终抑制肿瘤血管生成,应用在治疗标准化化疗失败的晚期胃癌患者中,可有效延长生存期。本研究中,观察者的客观缓解率和疾病控制率明显高于对照组,治疗后观察组的平均生存期也高于对照组,可见甲磺酸阿帕替尼片治疗晚期PLC有利于提高临床疗效,这可能与该药物有抗血管生成作用、可抑制肿瘤进展有关,这与廖景升等人[10]报道的疗效结果基本一致。而治疗后,两组均有不良反应发生,但两组比较无明显差异。高血压、蛋白尿、手足综合征是观察组患者的主要不良反应,用药2周左右容易出现高血压,主要因抗血管作用下血管退化导致外周阻力增大而引起,且预防性降压治疗并无法有效避免高血压不良反应的出现,用药期间需戒烟酒、少食盐并及时监测血压。而用药3周后易出现蛋白尿与手足综合征,蛋白尿一般无明显症状,需及时检测尿常规,3期肾功能不全患者应考虑停药,手足综合征的预防需做好皮肤护理,避免皮肤受到刺激与摩擦。其他如Ⅰ-Ⅱ度的恶心、呕吐、头晕等少见的毒副作用,无需特别处理。治疗过程中未发生间质性肺炎,未出现明显血液学毒性等,其中3例因Ⅳ度高血压、4例因Ⅲ度蛋白尿而停药,因此该药的安全性可作为今后临床关注的重点。
综上所述,甲磺酸阿帕替尼治疗晚期原发性肝癌可提高近期临床疗效,且无其他毒副作用,能延缓患者总生存期,建议推广使用。
| [1] |
冯久桓, 秦叔逵, 王琳. 甲磺酸阿帕替尼的研究现状与进展[J].
临床肿瘤学杂志, 2017, 22(4): 345-356.
Feng JH, Qin SK, Wang L. Clinicai and experimental progression of mesylate apatinib[J]. Chinese Clinical Oncology, 2017, 22(4): 345-356. |
| [2] | Zhang Y, Han C, Li J, et al. Efficacy and safety for Apatinib treatment in advanced gastric cancer: a real world study[J]. Scientific Reports, 2017, 7(1): 132-138. DOI: 10.1038/s41598-017-00166-z. |
| [3] | Brower V. Apatinib in treatment of refractory gastric cancer[J]. Lancet Oncology, 2016, 17(4): 137-142. |
| [4] | Kou P, Zhang Y, Shao W, et al. Significant efficacy and well safety of apatinib in an advanced liver cancer patient: a case report and literature review[J]. Oncotarget, 2017, 8(12): 1022-1025. |
| [5] |
宋锦添, 陈奕贵, 许春伟, 等. 阿帕替尼治疗53例晚期原发性肝癌的疗效[J].
临床与病理杂志, 2017, 37(3): 557-563.
Song JT, Chen YG, Xu CW. Effect of apatinib on treatment of 53 cases of advanced primary liver cancer[J]. Journal of Clinical and Pathological Research, 2017, 37(3): 557-563. |
| [6] | Yu J, Zhang Y, Leung LH, et al. Efficacy and safety of angiogenesis inhibitors in advanced gastric cancer: a systematic review and meta-analysis[J]. J Hematol Oncol, 2016, 9(1): 111-116. DOI: 10.1186/s13045-016-0340-8. |
| [7] | Peng H, Zhang Q, Li J, et al. Apatinib inhibits VEGF signaling and promotes apoptosis in intrahepatic cholangiocarcinoma[J]. Oncotarget, 2016, 7(13): 172-176. |
| [8] | Kou P, Zhang Y, Shao W, et al. Significant efficacy and well safety of apatinib in an advanced liver cancer patient: a case report and literature review[J]. Oncotarget, 2017, 8(12): 689-692. |
| [9] | Scott AJ, Messersmith WA, Jimeno A. Apatinib: a promising oral antiangiogenic agent in the treatment of multiple solid tumors[J]. Drugs Today (Barc), 2015, 51(4): 223-226. DOI: 10.1358/dot.2015.51.4.2320599. |
| [10] |
廖景升, 刘琦, 黎焕君, 等. 甲磺酸阿帕替尼治疗晚期原发性肝癌疗效及安全性观察[J].
海南医学, 2017, 28(5): 714-716.
Liao JS, Liu Q, Li HJ, et al. Effects and safety of Apatinib mesylate in the treatment of advanced primary liver cancer[J]. Hainan Medical Journal, 2017, 28(5): 714-716. DOI: 10.3969/j.issn.1003-6350.2017.05.009. |
 2018, Vol. 39
2018, Vol. 39


