2. 武汉大学人民医院妇产科 湖北 武汉 430060;
3. 湖北省妇幼保健院产科 湖北 武汉 430070;
4. 武汉市中心医院妇产科 湖北 武汉 430014
2. Dept. of Gynaecology and Obstetrics, Renmin Hospital of Wuhan University, Wuhan 430060, China;
3. Dept. of Obstetrics, Maternal and Child Health Hospital of Hubei Province, Wuhan 430070, China;
4. Dept. of Gynecology and Obstetrics, Wuhan Central Hospital, Wuhan 430014, China
宫颈癌是危害女性健康的肿瘤之一,其发病率及死亡率在女性生殖系统肿瘤中位于前3位[1],转移是宫颈癌复发及预后不良的主要因素之一[2]。寻找分子靶向治疗的靶点与药物是当下紧迫的任务。
Hedgehog(Hh)信号通路的异常激活参与包括宫颈癌在内的多种肿瘤的发生、发展[3],主要机制包括Hh配体依赖机制和非配体依赖机制[4]。该通路是肿瘤分子靶向治疗药物研发的热门靶点,其末端转录因子Gli1的活化是此通路完全激活的标志。有研究表明[5],FoxM1是Hh通路的直接靶基因。FoxM1是叉头框(Foxhead Box,Fox)转录因子超家族主要成员,其主要生物学功能是调节细胞周期及有丝分裂[6]。研究表明,在胶质母细胞瘤中,Gli1通过调控FoxM1的转录活性,从而增强癌细胞的增殖、侵袭及迁移能力[7]。Cyclin D1是调控细胞周期进展的正向调节因子之一,通过调控细胞周期的不同节点来促进细胞的有丝分裂,其表达受FoxM1的调控,是FoxM1的下游分子[8]。本实验是在前期研究的基础上,用不同浓度Gli抑制剂GANT61作用于Hela细胞,探究其对Hela细胞的作用及相关分子机制,为宫颈癌的分子靶点治疗提供新思路。
1 材料与方法 1.1 材料人宫颈癌细胞系Hela购自武汉拜意尔生物技术有限公司,DMEM高糖培养基购自HyClone公司(美国),胎牛血清购于杭州天杭生物科技有限公司(中国),GANT61购于Selleck公司(美国),Gli1抗体、FoxM1抗体、Cyclin D1抗体及GAPDH抗体均购于Abcam公司(美国),HRP-山羊抗兔二抗购于武汉阿斯本生物技术有限公司(中国),BCA蛋白质浓度测定试剂盒、细胞周期检测试剂盒购于天津三箭生物技术有限公司(中国),CCK-8试剂盒购于碧云天生物技术有限公司(中国),Transwell板(8 μm)购于Corning公司(美国)及Matrigel胶购于BD公司(美国),Trizol试剂购于InvitrogenTM公司(美国),荧光定量PCR试剂盒购于TaKaRa公司(日本),逆转录引物采用Primer BLAST在线设计,由武汉金开瑞生物工程有限公司合成。
1.2 方法 1.2.1 抑制剂GANT61的配置先用二甲基亚砜(DMSO)配制浓度为80 mmol/L的母液,溶解时50 ℃烘箱助溶,再用DMEM培养基稀释成相应浓度备用。
1.2.2 细胞培养及处理将人宫颈癌细胞系Hela培养于含10%胎牛血清,青-链霉素各100 U/ml的DMEM高糖培养基,37 ℃ 5% CO2培养箱中孵育,取生长状态良好的对数生长期细胞进行实验。根据预实验检测的GANT61对Hela细胞活力半抑制浓度(IC50)进行如下实验分组:0 (即含0.1%DMSO对照组),20, 40及60 μmol/L。
1.2.3 CCK-8法检测Hela细胞的增殖能力取对数生长期Hela细胞,按5×103/孔的密度接种于96孔板,加入含10%胎牛血清的培养基100 μl,置于37 ℃ 5% CO2培养箱中培养24 h以贴壁。然后予细胞换液,加入不同浓度GANT61(终浓度为0,1,10,15,20,25,30,40,80 μmol/L),以含0.1% DMSO培养基的细胞组为正常对照组和只含培养基组为空白对照,每组5个复孔。继续培养48 h后加入CCK-8溶液10 μl,避光继续培养1-4 h,酶标仪(DR-200Bs)测定450 nm处各孔光吸收值(OD值),按公式计算药物对细胞的作用效果,存活率(%)=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%;抑制率(%)=100%-存活率。SPSS统计软件计算GANT61抑制Hela细胞的IC50值约为36.337 μmol/L,后续实验GANT61的浓度设置为0, 20, 40及60 μmol/L。
1.2.4 流式细胞仪检测细胞周期Hela细胞经GANT61(0,20,40,60 μmol/L)作用24 h,采用流式细胞仪检测细胞周期。细胞经PBS洗涤3次后离心(300 g,5 min),弃上清,再缓慢加入预冷的90%乙醇重悬细胞,4 ℃孵育20 min后离心,PBS洗涤后加入500 μl RNAse/PI重悬细胞,避光染色20 min后选择相应通道上机检测,实验重复3次。
1.2.5 RT-PCR检测mRNA表达Hela细胞经GANT61(0,20,40 μmol/L)处理48 h,Trizol法提取总RNA,操作方法严格按照试剂盒说明书进行。采用PrimeScript逆转录试剂盒(含gDNA Eraser)合成cDNA。逆转录条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃备用。GAPDH作内源性标准化对照,每组样品作3个复孔。扩增条件:95 ℃预变性1 min;95 ℃ 15 s,58 ℃ 20 s,72 ℃ 45 s,共40个循环。采用2-ΔΔCt法计算目的基因mRNA的表达水平。实验重复3次。引物序列见表 1。
| 表 1 引物的名称和序列 |
Hela细胞经GANT61(0,20,40 μmol/L)处理48 h,严格按试剂说明书要求提取细胞总蛋白,BCA法测定总蛋白浓度,然后每孔上样量40 μg蛋白质进行SDS-PAGE分离,分离后的样品转移至PVDF膜,含5%脱脂奶粉的封闭液室温封闭1.5 h,加入兔抗人GAPDH单克隆抗体(1:10 000),兔抗人Gli1(1:500)、FoxM1(1:500)、Cyclin D1(1:2 000)单克隆抗体,4 ℃孵育过夜,然后将所述膜在室温下与HRP-山羊抗兔第二抗体(1:10 000)温育孵育30 min,TBST洗涤4次,ECL显影,Bio-Rad曝光系统暗室曝光。
1.2.7 Transwell实验检测Hela细胞的侵袭及迁移能力用无血清培养基将Matrigel基质胶按1:3比例稀释,取50 μl加入Transwell小室中,置于37 ℃,5% CO2温箱培养1 h,使基质胶凝固,迁移实验无此步骤。将Hela细胞饥饿处理12 h后按GANT61(0,20,40 μmol/L)分组,取1×105/ml的单细胞悬液200 μl接种于含无血清培养基的上室,下室含10%FBS培养基,37 ℃,5%CO2温箱培养24 h,取出小室,PBS洗去培养基,0.01%结晶紫染色10 min;洗除小室表面的结晶紫并用棉签轻轻擦掉上层未迁移/侵袭的细胞。100倍显微镜下随机5个视野观察细胞并拍照、记数。实验重复3次。
1.3 统计学方法使用IBM SPSS 21.0软件进行统计学分析,各组样本均数比较均采用单因素方差分析(One-way ANOVA),所有实验数据均表示为均值±标准差;使用Graphpad prism 5.0软件绘图;P<0.05表示差异有统计学意义。
2 结果 2.1 GANT61抑制Hela细胞增殖采用CCK-8法检测不同浓度GANT61对Hela细胞增殖能力的影响。实验结果分析发现,GANT61对Hela细胞的生长表现为抑制作用,且该抑制效果呈剂量依赖性(P<0.01),其作用的IC50值约为36.337 μmol/L,结果见图 1。
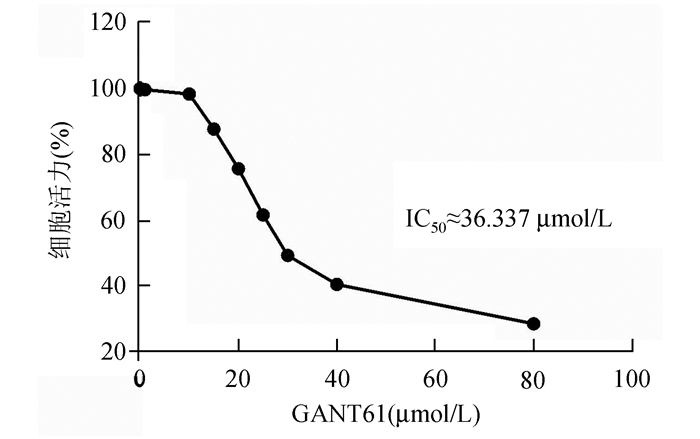
|
图 1 CCK-8法检测不同浓度GANT61对Hela细胞活力的影响 |
各组细胞经GANT61处理后,采用流式细胞术检测细胞周期分布情况。如图 2所示,与对照组(0 μmol/L)相比,随着GANT61浓度的增加,实验组G2/M期细胞比例增加(P<0.01),并可观察到当GANT61浓度为60 μmol/L时S期细胞比例增加,与对照组比较差异有统计学意义(P=0.033),各组均未见明显的亚-G1峰,结果见图 2。
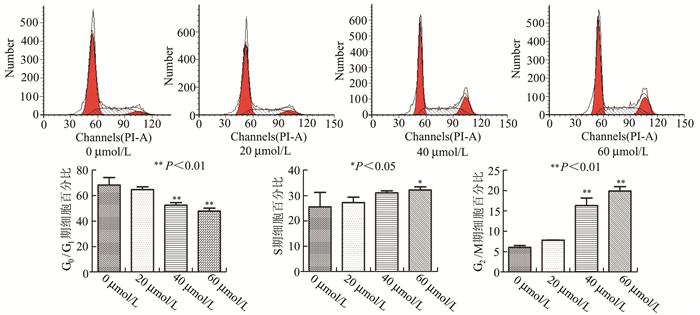
|
图 2 流式细胞仪检测不同浓度GANT61对Hela细胞周期的影响 |
荧光定量PCR结果显示,与对照组(0 μmol/L)相比,GANT61(20 μmol/L)组与GANT61(40 μmol/L)组的Gli1 mRNA、FoxM1 mRNA及CyclinD1 mRNA的表达水平降低(P<0.01),且随GANT61浓度的增加,其相应的mRNA表达水平逐步降低(P<0.01)。Western Blot检测结果与荧光定量PCR数据分析基本一致,如图 3A所示,GANT61可剂量依赖性的降低Gli1、FoxM1及CyclinD1对应的蛋白表达(图 3)。
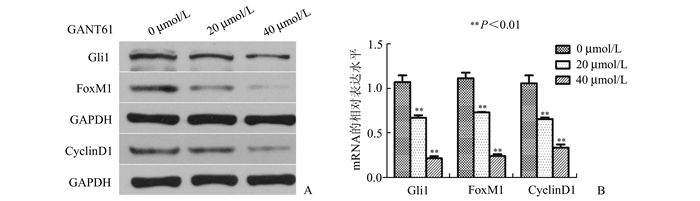
|
图 3 RT-PCR及Western Blot检测GANT61对Hela细胞Gli1、FoxM1及Cyclin D1的mRNA水平与蛋白表达的影响 A:Gli1、FoxM1、Cyclin D1对应的蛋白表达水平;B:Gli1、FoxM1、Cyclin D1对应的mRNA水平 |
采用Transwell及Matrigel基质胶实验检测细胞的迁移及侵袭能力。各组细胞经GANT61作用后采用结晶紫染色,在倒置显微镜下观察并计数穿膜细胞数,结果如图所示。穿透小室膜的细胞数量按实验分组GANT61(0,20,40 μmol/L)分别为:迁移实验:303.67±12.89,208.67±5.51,123.33±17.62,组间比较差异均有统计学意义(P<0.01);侵袭实验:126.33±8.02,82.87±9.71,46.67±5.13,组间比较差异均有统计学意义(P<0.01)(图 4)。
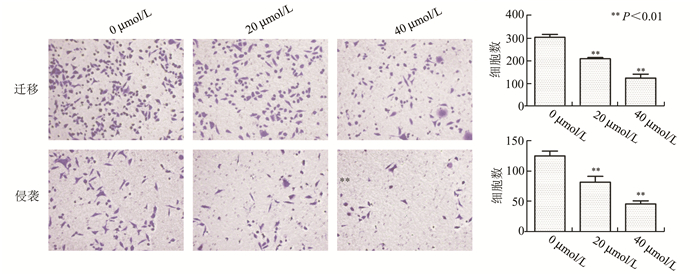
|
图 4 Transwell实验检测GANT61对Hela细胞迁移及侵袭能力的影响(结晶紫染色×100) |
我们的前期研究发现,在CIN Ⅱ/Ⅲ级宫颈组织和宫颈癌组织中,Hh关键成分Shh、PTCH1、SMO、Gli1等的表达明显高于正常宫颈组织[9],且在宫颈癌细胞系中,Hela细胞中Gli1与FoxM1的表达量均较其他细胞系高[6, 10],为便于观察现象,我们在前期研究的基础上,选用Hela细胞为本实验研究对象。
GANT61是由美国国家癌症研究所研发的Gli转录因子抑制剂,是近年来Gli靶点抑制剂的研究热点,可抑制Gli1的DNA结合能力[11],进而达到阻断Hh信号通路的目的。虽然SMO抑制剂维莫德吉(GDC-0449)和索尼吉步(SANT1)已被美国FDA批准上市并用于晚期基底细胞癌的治疗,但却因SMO突变出现了耐药[12]。而Gli是SMO的下游靶蛋白,如果直接抑制Gli的表达,那么就可以从源头上解决目前SMO突变引起的耐药问题。Benvenuto等[13]研究发现乳腺癌组织及癌细胞系中Hh通路高表达,用GDC-0449和GANT61分别作用于乳腺癌细胞系后,GANT61对乳腺癌细胞的生长抑制效果强于GDC-0449,并且可显著抑制乳腺癌原位移植瘤的生长,减少放疗抵抗。在本实验中,我们发现GANT61对Hela细胞生长的抑制作用呈剂量依赖性;GANT61对Hela细胞48 h的IC50值约为36 μmol/L(见图 1)。由此可知,GANT61的确可以抑制Hela细胞的增殖能力。同时,我们用Transwell小室及Matrigel基质胶实验检测发现,GANT61能够剂量依赖性地抑制该细胞的侵袭及迁移能力(见图 4)。此外,本研究除了检测GANT61对Hela细胞常规生物学特性的影响,还探讨了该影响的具体机制,即通过抑制Gli1的表达,减弱FoxM1的核内转录活性,从而阻滞细胞周期的G2/M期和S期进展。
FoxM1是通过调节细胞周期相关因子来推动细胞G1/S期及G2/M期节点的进程,促进细胞的增殖[8]。Cyclin D1是受FoxM1调控的细胞周期中起关键作用的正向调节因子,特异性过表达于多种肿瘤细胞。多项研究表明,FoxM1除可调节细胞周期相关因子外,还可通过调节血管形成因子及EMT等来介导癌细胞的侵袭及转移[14, 15]。本研究发现,GANT61可剂量依赖性的将Hela细胞周期阻滞在G2/M期,当浓度达到60 μmol/L时,开始出现S期阻滞(见图 2)。因此我们推测,GANT61很可能通过影响细胞周期的进展来抑制Hela细胞的增殖。RT-PCR与Western Blot检测发现,随着GANT61浓度的增加,FoxM1与Cyclin D1的表达水平下降,该结果验证了我们的设想。
我们的前期研究发现,Gli1与FoxM1均高表达于宫颈癌组织[9],下调SiHa、Hela细胞系中Gli1的表达后,FoxM1的表达量同步降低[16]。有研究表明[5, 7],FoxM1是Hh通路末端转录因子Gli1的直接靶标,其转录活性直接受Gli1的调控,且Gli1发挥作用需由FoxM1介导。在本研究中,当GANT61抑制Hela细胞中Gli1的表达后,FoxM1的mRNA水平和蛋白表达水平呈同步降低,且与细胞周期阻滞具有显著相关性。该结果验证了我们的设想,即在宫颈癌中,FoxM1是Hh通路末端转录因子Gli1的靶基因。
本研究表明,GANT61可有效阻滞细胞周期的进展,从而抑制Hela细胞的增殖、侵袭及迁移能力,为宫颈癌的分子靶向治疗提供了潜在的治疗靶点。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI: 10.3322/caac.21387. |
| [2] | Vishnoi K, Mahata S, Tyagi A, et al. Cross-talk between human papillomavirus oncoproteins and hedgehog signaling synergistically promotes stemness in cervical cancer cells[J]. Sci Rep, 2016, 6: 34377. DOI: 10.1038/srep34377. |
| [3] | Jiang J, Hui CC. Hedgehog signaling in development and cancer[J]. Dev Cell, 2008, 15(6): 801-812. DOI: 10.1016/j.devcel.2008.11.010. |
| [4] | Gunarta IK, Li R, Nakazato R, et al. Critical role of glioma-associated oncogene homolog 1 in maintaining invasive and mesenchymal-like properties of melanoma cells[J]. Cancer Sci, 2017, 108(8): 1602-1611. DOI: 10.1111/cas.2017.108.issue-8. |
| [5] | Wang D, Hu G, Du Y, et al. Aberrant activation of hedgehog signaling promotes cell proliferation via the transcriptional activation of forkhead Box M1 in colorectal cancer cells[J]. J Exp Clin Cancer Res, 2017, 36(1): 23. DOI: 10.1186/s13046-017-0491-7. |
| [6] | Chen H, Zou Y, Yang H, et al. Downregulation of FoxM1 inhibits proliferation, invasion and angiogenesis of HeLa cells in vitro and in vivo[J]. Int J Oncol, 2014, 45(6): 2355-2364. DOI: 10.3892/ijo.2014.2645. |
| [7] | Xue J, Zhou A, Tan C, et al. Forkhead Box M1 is essential for nuclear localization of glioma-associated oncogene homolog 1 in glioblastoma multiforme cells by promoting importin-7 expression[J]. J Biol Chem, 2015, 290(30): 18662-18670. DOI: 10.1074/jbc.M115.662882. |
| [8] | Wang JS, Ren TN, Xi T. Ursolic acid induces apoptosis by suppressing the expression of FoxM1 in MCF-7 human breast cancer cells[J]. Med Oncol, 2012, 29(1): 10-15. DOI: 10.1007/s12032-010-9777-8. |
| [9] | Chen H, Wang J, Yang H, et al. Association between FoxM1 and hedgehog signaling pathway in human cervical carcinoma by tissue microarray analysis[J]. Oncol Lett, 2016, 12(4): 2664-2673. DOI: 10.3892/ol.2016.4932. |
| [10] |
李盼盼, 陈红, 李玲玲, 等. Hh信号通路抑制剂Cyclopamine对Hela细胞增殖、侵袭迁移的影响[J].
武汉大学学报:医学版, 2017, 38(3): 407-412, 442.
Li PP, Chen H, Li LL, et al. Effect of Cyclopamine, an Hh Signal Pathway Inhibitor, on the Proliferation, Invasion and Metastasis of Hela Cells[J]. Medical Journal of Wuhan University, 2017, 38(3): 407-412, 442. |
| [11] | Lauth M, Bergstrom A, Shimokawa T, et al. Inhibition of GLI-mediated transcription and tumor cell growth by small-molecule antagonists[J]. Proc Natl Acad Sci USA, 2007, 104(20): 8455-8460. DOI: 10.1073/pnas.0609699104. |
| [12] | Kwon GP, Ally MS, Bailey-Healy I, et al. Update to an open-label clinical trial of vismodegib as neoadjuvant before surgery for high-risk basal cell carcinoma (BCC)[J]. J Am Acad Dermatol, 2016, 75(1): 213-215. DOI: 10.1016/j.jaad.2016.02.1235. |
| [13] | Benvenuto M, Masuelli L, De Smaele E, et al. In vitro and in vivo inhibition of breast cancer cell growth by targeting the Hedgehog/GLI pathway with SMO (GDC-0449) or GLI (GANT-61) inhibitors[J]. Oncotarget, 2016, 7(8): 9250-9270. |
| [14] | Wierstra I. FOXM1 (Forkhead box M1) in tumorigenesis: overexpression in human cancer, implication in tumorigenesis, oncogenic functions, tumor-suppressive properties, and target of anticancer therapy[J]. Adv Cancer Res, 2013, 119: 191-419. DOI: 10.1016/B978-0-12-407190-2.00016-2. |
| [15] | Wei P, Zhang N, Wang Y, et al. FOXM1 promotes lung adenocarcinoma invasion and metastasis by upregulating SNAIL[J]. Int J Biol Sci, 2015, 11(2): 186-198. DOI: 10.7150/ijbs.10634. |
| [16] |
陈丹, 陈红, 董良波, 等. Gli1与FoxM1在子宫颈癌组织和细胞中的表达及意义[J].
武汉大学学报:医学版, 2016, 37(3): 430-435.
Chen D, Chen H, Dong LB, et al. Significance and Expression of Gli1 and FoxM1 in Cervical Cancer Cells in vitro and in vivo[J]. Medical Journal of Wuhan University, 2016, 37(3): 430-435. |
 2018, Vol. 39
2018, Vol. 39


