2. 武汉大学人民医院 消化内科,湖北 武汉 430060
2. Dept. of Gastroentrology, Renmin Hospital of Wuhan University, Wuhan 430060, China
丙氨酸-乙醛酸转氨酶2类似物1(alanine-glyoxylate aminotransferase 2-like 1,AGXT2L1)又名ETNPPL,定位于人染色体的4q25, 在序列上与丙氨酸-乙醛酸转氨酶2(alanine-glyoxylate aminotransferase 2, AGXT2)存在36%的一致性。目前ETNPPL的研究较少,相关研究表明在多类型精神疾病中该基因存在异常表达[1-3]。例如在躁狂小鼠模型中,给予心境稳定剂碳酸锂后,小鼠脑组织ETNPPL的表达明显增加[1]; 与正常脑组织对比,患有双相情感障碍以及精神分裂症患者脑组织的ETNPPL的表达明显增高[2]; 但ETNPPL的具体功能仍未清楚,特别是对于肿瘤研究,ETNPPL的作用仍是未知。
在本研究中,我们将肝细胞癌细胞系作为研究对象,通过Western blot检测ETNPPL的表达情况,并通过siRNA干扰技术,检测ETNPPL靶向敲低对肝细胞癌细胞增殖能力的影响。
1 材料与方法 1.1 细胞及细胞培养人正常肝细胞细胞系L02,人肝细胞癌细胞系HepG2、Bel-7402、SMMC7721、Huh7、PLC、LM3、97L、97H,均由我院消化实验室冻存复苏得到。培养基使用含有10%胎牛血清和1%双抗(青霉素/链霉素)的DMEM培养液,置于37 ℃、饱和湿度、体积分数为5%CO2的培养箱中培养。上述9种细胞均呈贴壁生长,培养过程中根据细胞生长状况适时更换培养液,细胞铺满培养皿时以0.25%胰蛋白酶消化,按1:3传代后继续培养。
1.2 siRNA转染设计、合成靶向ETNPPL的siRNA由江苏吉玛完成。引物序列见表 1。
| 表 1 引物序列号 |
将各组细胞接种于6孔板中,当细胞融合达到60%-70%左右时进行转染,具体转染步骤参见LipofectAMINETM2000试剂盒中提供的产品说明书。加入转染6 h后更换培养基,继续培养24 h后抽提RNA进行敲低效果验证和后续实验。
1.3 Western blot检测按照试剂盒说明书对各组细胞总蛋白进行提取,之后行Western blot检测。将总蛋白变性后,进行SDS-PAGE凝胶电泳与转膜,之后使用TBST溶液清洗后,使用ETNPPL抗体(1:500)、内参GAPDH抗体(1:1 000)孵育(4 ℃,12 h)。之后TBST溶液洗3次×10 min,再以碱性磷酸酶标记的二抗(1:2 000)于室温孵育1 h。之后之后TBST溶液洗3次×10 min,使用超敏ECL化学发光、显影。定影。
1.4 CCK8实验取对数生长期的各组细胞,0.25%的胰蛋白酶消化,调整97H和LM3细胞的细胞密度,使得细胞悬液密度为2×105/ml并接种于96孔培养板,每孔100 μl,置于培养箱中培养,24 h后每个孔加入CCK8溶液10 μl,继续于培养箱中培养、孵育1 h,使用酶标仪测定450 nm处的吸光度。此后每24 h测定一次细胞的吸光度。每个实验孔设置两个平行复孔。
1.5 平板克隆形成实验取对数生长期的各组细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,计数,接种于6孔板,调整细胞数量为每个孔1 000个,轻轻转动培养板,使细胞分散均匀,之后置37 ℃5% CO2及饱和湿度的环境下,静置培养1周。之后固定细胞,并使用结晶紫对细胞进行染色,计数每个细胞克隆所含细胞的数量,计算细胞集落形成率,拍照。每个实验孔设置两个平行复孔。
1.6 统计学处理作图及统计学处理软件使用GraphPad Prism 6, 定量资料以x±s表示,两组间比较采用t检验; 以P<0.05为差异有统计学意义。
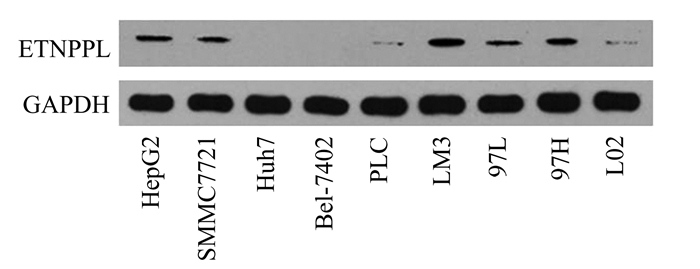
2 结果 2.1 ETNPPL在多种肝细胞癌细胞系中高表达为了探索ETNPPL在肝细胞癌中的表达,我们首先使用Western blot检测了ETNPPL在多种肝细胞癌细胞系(HepG2、Bel-7402、SMMC7721、Huh7、PLC、HCCLM3、97L、97H)中的表达情况。Western blot的结果显示(图 1),以正常肝脏细胞系L02作为对照细胞系,ETNPPL在HepG2、SMMC7721、HCCLM3、97L和97H中有不同程度的表达增高,而在97H和HCCLM3细胞中表达尤为高。ETNPPL在肝细胞癌细胞中的异常表达提示其可能在肝细胞癌的发生和进展中起了重要作用。因为97H和HCCLM3细胞中,ETNPPL增高显著,我们选择这两种细胞系进行后续实验。
|
图 1 ETNPPL在不同肝细胞癌细胞系中的表达 |
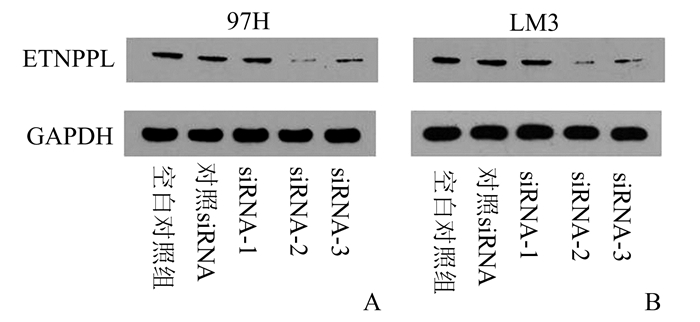
使用ETNPPL靶向siRNA转染97H细胞和HCCLM3细胞后,培养48 h,提取总蛋白后进行Western blot检测(图 2):与空白组和对照siRNA组相比,ETNPPL-siRNA-2的干扰效果均为最好(图 2)。siRNA-2的干扰效率超过70%,能满足后续研究的需要。
|
图 2 Western blot验证ETNPPL靶向siRNA的干扰功能 A:97H细胞; B:HCCLM3细胞 |
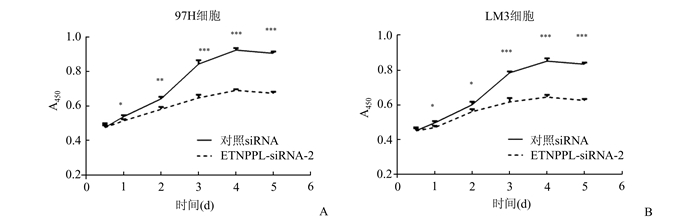
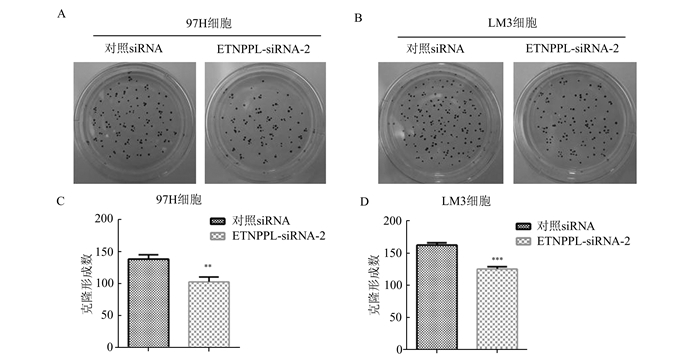
CCK8法检测结果(图 3)显示:97H和HCCLM3这两组细胞系中,ETNPPL干扰组的细胞第1天到第5天的细胞活性相较于对照组,均受到到显著抑制。平板克隆形成实验(图 4)显示,97H和HCCLM3这两组细胞中,ETNPPL干扰组的细胞的平板克隆形成能力较对照组受到了显著抑制。以上结果提示ETNPPL2可以调控肝细胞癌细胞系的增殖能力。
|
图 3 CCK8实验检测ETNPP干扰对肝细胞癌细胞增殖活性的影响 A:97H细胞; B:HCCLM3细胞 |
|
图 4 平板克隆形成实验检测ETNPP干扰对肝细胞癌细胞克隆形成能力的影响 A:97H细胞; B:LM3细胞; C:97H细胞克隆形成数目统计; D:LM3细胞克隆形成数目统计 |
肝癌是世界范围内发病率最高的恶性肿瘤之一,具有高度恶性、进展迅速、预后差的特点。根据美国癌症协会的最新数据,肝癌死亡病例在男女患者中分列第5位和第9位[4]。我国是肝癌的高发地区,而肝细胞癌约占原发性肝癌的90%。所以,明确肝细胞癌发生及发展的相关机制,寻找与肝细胞癌发病的相关基因十分重要。
作为细胞膜中含量最丰富的两种磷脂,卵磷脂(phosphatidylcholine)和脑磷脂(phosphatidylcholine)的异常可以导致细胞信号传导异常,相关机制可能是影响膜受体的活性,从而令第二信使的产出受阻[5]。磷酸乙醇胺(phosphoethanolamine,PEA)是卵磷脂和脑磷脂的重要底物[6]。近些年来,多项研究表明人工合成的外源性PEA在多种肿瘤中具有抗肿瘤作用[7-11]。如在黑素瘤细胞中,PEA会导致细胞周期G2/M期阻滞,并导致线粒体膜电位改变、激发caspase-3诱导的细胞凋亡[7]; 在黑素瘤和埃利希腹水癌的动物模型中,给予PEA后,能提高动物的生存期,使肿瘤的增殖受到抑制而且没有发现肝毒性和骨髓抑制的现象[8]。在肾细胞癌中,PEA能抑制肿瘤的肺转移,并且能够使一系列肿瘤相关蛋白表达下调,例如血管内皮生长因子受体1(vascular endothelial growth factor receptor 1,VEGFR1)、细胞周期蛋白D1(cyclin D1)等[9]。
令人启发的是,最近发现ETNPPL的表达产物具有PEA的磷酸酶活性,能够不可逆地降解PEA生成磷酸盐、乙醛和氨[12, 13]。据此我们推测,ETNPPL很可能是调控细胞磷脂合成的重要基因,如果在肿瘤细胞中靶向敲低ETNPPL, 会导致内源性PEA的贮积,从而起到肿瘤抑制作用。
在本研究中,我们发现在多种肝细胞癌细胞系中ETNPPL均有表达,且HCCLM3和97H这两种细胞系中表达尤为明显。这两种肝细胞癌细胞系的恶性程度高,所以我们推测ETNPPL可能在肝细胞癌的发病过程中具起重要调控作用。所以我们利用RNA干扰技术将肝细胞癌细胞系中ETNPPL敲低后,通过检测肝细胞癌细胞的克隆形成能力和细胞活性,发现细胞的增殖相关表型明显被抑制。本研究表明ETNPPL与肝细胞癌的增殖密切相关。
本研究首次通过细胞实验证实了ETNPPL在肿瘤进展中的作用,并为PEA的肿瘤抑制作用提供了新的证据。然而ETNPPL在肿瘤进展中是否还有其他调控机制,以及ETNPPL在其他肿瘤中的作用是否类似,仍有待于探索。
| [1] | McQuillin A, Rizig M, Gurling HM. A microarray gene expression study of the molecular pharmacology of lithium carbonate on mouse brain mRNA to understand the neurobiology of mood stabilization and treatment of bipolar affective disorder[J]. Pharmacogenet Genomics, 2007, 17(8): 605-617. DOI: 10.1097/FPC.0b013e328011b5b2. |
| [2] | Shao L, Vawter MP. Shared gene expression alterations in schizophrenia and bipolar disorder[J]. Biol Psychiatry, 2008, 64(2): 89-97. DOI: 10.1016/j.biopsych.2007.11.010. |
| [3] | Stankiewicz AM, Goscik J, Swiergiel AH, et al. Social stress increases expression of hemoglobin genes in mouse prefrontal cortex[J]. BMC Neurosci, 2014, 15(1): 130. DOI: 10.1186/s12868-014-0130-6. |
| [4] | Ward E, Desantis C, Robbins A, et al. Childhood and adolescent cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(2): 83-103. DOI: 10.3322/caac.v64.2. |
| [5] | Eyster KM. The membrane and lipids as integral participants in signal transduction: lipid signal transduction for the non-lipid biochemist[J]. Adv Physiol Educ, 2007, 31(1): 5-16. DOI: 10.1152/advan.00088.2006. |
| [6] | Pavlovic Z, Bakovic M. Regulation of phosphatidylethanolamine homeostasis: the critical role of CTP: phosphoethanolamine cytidylyltransferase (Pcyt2)[J]. Int J Mol Sci, 2013, 14(2): 2529-2550. DOI: 10.3390/ijms14022529. |
| [7] | Ferreira AK, Meneguelo R, Marques FL, et al. Synthetic phosphoethanolamine a precursor of membrane phospholipids reduce tumor growth in mice bearing melanoma B16-F10 and in vitro induce apoptosis and arrest in G2/M phase[J]. Biomed Pharmacother, 2012, 66(7): 541-548. DOI: 10.1016/j.biopha.2012.04.008. |
| [8] | Ferreira AK, Meneguelo R, Pereira A, et al. Anticancer effects of synthetic phosphoethanolamine on Ehrlich ascites tumor: an experimental study[J]. Anticancer Res, 2012, 32(1): 95-104. |
| [9] | Ferreira AK, Meneguelo R, Neto SC, et al. Synthetic phosphoethanolamine induces apoptosis through caspase-3 pathway by decreasing expression of Bax/Bad protein and changes cell cycle in melanoma[J]. J Cancer Sci Ther, 2011, 3: 53-59. |
| [10] | Ferreira AK, Meneguelo R, Pereira A, et al. Synthetic phosphoethanolamine induces cell cycle arrest and apoptosis in human breast cancer MCF-7 cells through the mitochondrial pathway[J]. Biomed Pharmacother, 2013, 67(6): 481-487. DOI: 10.1016/j.biopha.2013.01.012. |
| [11] | Ferreira AK, Santana-Lemos BA, Rego EM, et al. Synthetic phosphoethanolamine has in vitro and in vivo anti-leukemia effects[J]. Br J Cancer, 2013, 109(11): 2819-2828. DOI: 10.1038/bjc.2013.510. |
| [12] | Veiga-da-Cunha M, Hadi F, Balligand T, et al. Molecular identification of hydroxylysine kinase and of ammoniophospholyases acting on 5-phosphohydroxy-L-lysine and phosphoethanolamine[J]. J Biol Chem, 2012, 287(10): 7246-7255. DOI: 10.1074/jbc.M111.323485. |
| [13] | Schiroli D, Cirrincione S, Donini S, et al. Strict reaction and substrate specificity of AGXT2L1, the human O-phosphoethanolamine phospholyase[J]. IUBMB Life, 2013, 65(7): 645-650. DOI: 10.1002/iub.1178. |
 2016, Vol. 37
2016, Vol. 37

