胃癌是世界范围内最常见的恶性肿瘤之一,在发展中国家胃癌发生率较高,占世界胃癌总发生率的67%左右;尤其是在我国,由于人们饮食习惯的改变,从而导致近年来临床上胃癌患者越来越多。我国胃癌死亡率为25.2/10万,是恶性肿瘤患者死亡的首要因素,其致死率占恶性肿瘤总致死率的23.2%。肿瘤的转移及复发是导致临床上胃癌患者疗效较差、预后不良的首要原因。肿瘤细胞的侵袭浸润是肿瘤转移复发的基础,即肿瘤细胞从肿瘤原发灶脱离后,首先进入血液循环或淋巴循环系统,然后定植于其他部位并形成新的肿瘤病灶,同时这些肿瘤细胞也可以反过来由新的病灶通过体液系统返回到原发灶处继续发展并增强肿瘤的生长。胃癌的发生是一个动态变化的过程,在胃癌发展的不同阶段有不同的成分参与其中,对这一过程中可能涉及到的分子机制进行研究,将有利于我们去更好地了解胃癌的发生发展。
基质金属蛋白酶(matrix metalloproteinases, MMPs)是由间质细胞或肿瘤细胞向外分泌产生的一类蛋白酶,通常具有分解细胞外基质及基底膜组分的功能,在肿瘤细胞的黏附、侵袭及转移等生物行为中有着重要的作用,同时它们还能够促进肿瘤微环境中血管的形成,参与临床上肿瘤患者的转移及复发,因此与临床上肿瘤的进展有紧密联系。研究表明,在胃癌的侵袭及其转移过程中,MMPs及其抑制因子TIMPs发挥了重要作用,特别是MMP-2。另外,MMPs与上皮间质转化(epithelial-mesenchymal transition,EMT)关系密切,MMPs既可以作为EMT的标志物,又可以作为EMT的诱发因子[1]。MMPs是间质细胞的特有标志蛋白之一,同时也可指示EMT过程的发生。MMPs可以通过Rac1b和活性氧分子(ROS)途径、TGF-β途径、β-catenin途径诱导EMT的发生。研究表明,EMT过程可发生在许多肿瘤的进展过程中,通过这一方式可使肿瘤细胞自身的生物学性状发生改变,进而增强其侵袭转移的能力,导致肿瘤的转移及复发。
Twist作为一种功能性碱性螺旋-环-螺旋转录因子,在EMT调节过程中发挥重要生物学功能。它能够与其它的相同结构的蛋白以二聚体形式结合,该二聚体进一步活化或者抑制不同的下游区目标,从而实现对E-钙黏蛋白的调节,而E-钙黏蛋白表达缺失标志着EMT的发生。Twist能够负向调节E-钙黏蛋白的表达,而E-钙黏蛋白的缺失能够进一步增加Twist的表达,正是通过这一正反馈调节机制,从而使肿瘤细胞持续间质化,诱导了EMT的发生[3],进而促进肿瘤细胞的侵袭和转移[4]。
本研究通过免疫组织化学技术分别对胃癌组织中Twist和MMP-2的表达进行检测,初步探讨其表达强度与临床上胃癌患者病理特征的相关性,并深入分析两者之间的相互作用。
1 材料与方法 1.1 标本的收集本研究所需病理组织切片均来自于武汉大学中南医院肿瘤科2004年1月至2008年1月入院并确诊的胃癌患者,共37例。患者年龄分布24-79岁,男性22例,女性15例。临床分期:Ⅰ期5例、Ⅱ期6例、ⅢA期9例、ⅢB期5例、Ⅳ期12例。Ⅰ-Ⅲ期患者行D2淋巴结清扫的根治性胃切除手术和一些Ⅳ期患者进行姑息性手术。Ⅱ期以后的所有患者在手术后21 d接受铂和5-氟尿嘧啶为主的化学辅助治疗。
1.2 免疫组化染色脱蜡:脱蜡前应将石蜡切片在60 ℃恒温箱中烘烤2.5 h,后用二甲苯(100%)浸泡20 min;水化:放入无水乙醇(100%)、7 min,再放入95%、85%、75%乙醇各5 min;自来水冲洗3-5 min,蒸馏水1 min;抗原修复:置0.01 mol/L枸橼酸缓冲液(pH 6.0)中用中火8 min,停火8 min,中低火7 min,自然冷却2-3 h;PBS冲洗2-3次,每次5 min;阻断:3%H2O2作用30 min,以排除内源性过氧化物酶的干扰;PBS冲洗2-3次,每次5 min;封闭:滴加适量BSA溶液,室温条件下封闭30 min,弃去多余液体;滴加Ⅰ抗50 μl,4 ℃过夜(需在37 ℃复温45 min);PBS冲洗2-3次,每次5 min;滴加Ⅱ抗50 μl,室温静置50 min,PBS冲洗2-3次,每次5 min;显色:滴加适宜DAB染色,作用5-10 min,通过显微镜观察以控制最佳染色效果(阳性细胞为胞质呈棕色者);蒸馏水冲洗10 min左右后立即终止反应;复染:用苏木精复染2 min后,用酒精盐酸水化;自来水冲洗10-15 min;脱水、透明、封片(中性树胶);结果分析:通过显微镜于高倍镜视野下(×400)随机选取切片中的5个视野进行拍照,然后利用病理图像采集系统对所拍摄的照片进行定量灰度扫描并加以分析。
1.3 染色结果判定Twist阳性结果判定标准:Twist阳性染色主要位于胃癌组织细胞的胞质中,亦有少数表达在胞核中;MMP-2阳性结果判定标准:MMP-2阳性染色主要位于胃癌组织细胞的胞质中,亦有少数胞核中表达。经免疫组织化学染色鉴定,若染色后胃癌组织细胞出现棕黄色着色,则判断该细胞为Twist或MMP-2阳性细胞。染色强度由强至弱依次计分为:棕褐色(3分),棕黄色(2分),淡黄色(1分),无色(0分);同时对每个视野下的阳性细胞进行计数并计算出其占该视野下肿瘤细胞总数的百分比,按照阳性细胞数量比例由高至低依次计分为:大于50%(3分),25%-50%(2分),5%-25%(1分),小于5%(0分)。最后综合细胞染色强度得分及阳性细胞所占比例得分对胃癌病理切片染色结果进行定性判断,取两者得分乘积,最终计分 < 3者记为阴性,≥3者记为阳性。
1.4 统计学处理应用SPSS 19.0软件进行分析,两者之间的相关性比较采用非参数Spearman等级相关检验,两者与临床病理特征之间的相关性通过卡方检验进行分析。检验水准为α=0.05。
2 结果 2.1 胃癌组织石蜡切片中Twist蛋白的表达情况在37例胃癌组织中,有21例表达Twist蛋白,其阳性率为56.8%,且Twist大部分分布在胃癌细胞的胞质中,其胞核中也有小部分分布(详见图 1)。经统计分析可知,Twist的表达与胃癌的浆膜浸润及淋巴转移相关(均P<0.05),但与远处转移、TNM分期、性别、年龄等无关(均P>0.05)(表 1)。
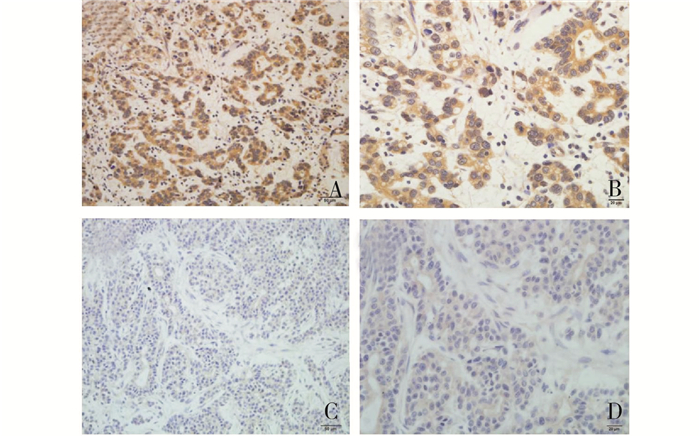
|
图 1 胃癌组织石蜡切片中Twist蛋白的表达结果 A和B:胃癌组织中Twist蛋白阳性表达结果,可见Twist主要定位于胞质中,胞核也有少部分表达,A:×200,B:×400;C和D:对照组Twist蛋白阴性表达结果,基本未见Twist蛋白表达,C:×200,D:×400 |
| 表 1 Twist和MMP-2蛋白表达与胃癌临床病理特征的关系 |
在37例胃癌组织中,有20例表达MMP-2蛋白,其阳性率为54.1%,且MMP-2集中分布在胃癌细胞的胞质中,其胞核中也有小部分分布(详见图 2)。经统计分析可知,MMP-2的表达与胃癌的复发、远处转移相关(均P<0.05),但与年龄、浆膜浸润、远处转移及TNM分期等无关(均P>0.05)(表 1)。
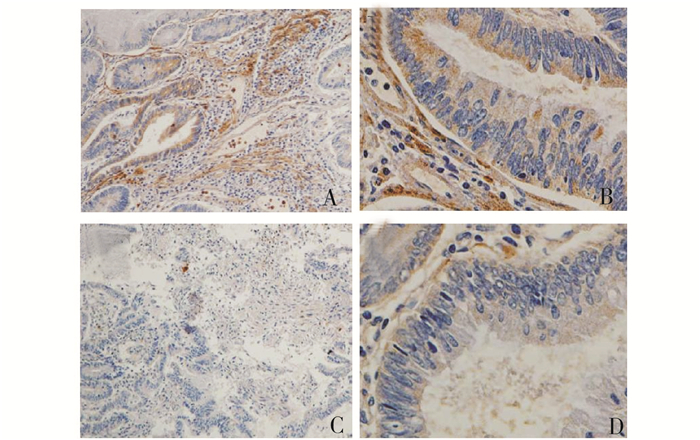
|
图 2 胃癌组织石蜡切片中MMP-2蛋白的表达结果 A和B:胃癌组织中MMP-2蛋白阳性表达结果,可见MMP-2主要定位于胞质中,也有少部分表达于胞核,A:×100,B:×400;C和D:对照组MMP-2蛋白阴性表达结果,基本未见MMP-2蛋白表达,C:×100,D:×400 |
| 表 2 胃癌组织中Twist和MMP-2蛋白表达的相关性分析 |
经Spearman等级相关分析发现Twist与MMP-2蛋白的表达呈正相关,r=0.257,P=0.046(表 2)。
3 讨论Twist蛋白作为编码位于常染色体上碱性螺旋-环-螺旋蛋白家族中的高度保守转录调控因子,其在胚胎生长发育阶段诱导细胞迁移中起着关键作用。最近研究显示,Twist是一种癌基因蛋白,能够通过阻断N-Myc、NF-κB/TNF及p53信号通路进而抑制肿瘤细胞的分化及凋亡等生物过程,同时Twist还可以通过调节上皮细胞间质化(EMT)来诱导肿瘤的发生发展。Liu等采用RT-PCR技术检测61例胃癌与其癌旁组织中Twist mRNA的表达,结果显示,Twist mRNA在胃癌组织中的表达水平显著增高,且其表达与胃癌细胞分化程度、浸润转移及TNM分期等有着显著的关联。同时转染Twist mRNA的MKN45细胞比未转染的对照组相比,Twist蛋白的表达显著减少,提示Twist表达可能与胃癌上皮间质转化导致的侵袭和转移有关[5]。Ru等研究显示,Twist蛋白的表达与患者年龄、肿瘤体积、浸润转移、分化程度和TNM分期有关,在Ⅰ-Ⅲ期胃癌患者中,Twist高表达患者5年生存率较Twist低表达患者而言明显降低,提示Twist可能与胃癌的发生、发展有关[6]。Feng等研究发现高侵袭性的MGC-803和HGC-27细胞与低侵袭性的MGC-803和HGC-27细胞相比,Twist的表达会明显升高。Twist过度表达的MGC-803细胞中,细胞的迁移性增加,细胞死亡的敏感性降低。小干扰RNA介导Twist消融的胃癌细胞系会表现出抑制迁移能力,促进细胞凋亡,细胞周期阻滞升高。这提示Twist是一个胃癌增殖和转移的关键调控因子[7]。Luo等研究表明Twist高表达的Twist S-MKN28细胞比MKN28、pcDNA3-MKN28细胞的黏附、迁移和侵袭能力明显提高,同时TCF-4的下游靶基因细胞周期蛋白D1和MMP-2的表达与Twist的高表达成正相关,抑制Twist的表达会减弱细胞侵袭能力,降低细胞周期蛋白D1和MMP-2的表达,进而说明Twist在胃癌转移和复发过程中起着重要作用[8]。Zhu等研究证明Twist能够通过升高FGFR2的表达从而导致临床上胃癌患者预后较差[9]。本研究结果显示,37例胃癌组织中,Twist蛋白的阳性率为56.8%,且Twist表达与浆膜浸润和淋巴转移有关。提示Twist是胃癌演进过程中的一个重要因子,对肿瘤局部侵袭和转移有促进作用,是一个判断胃癌进展的辅助标志物。鉴于Twist在胃癌发生、发展中的作用,我们进一步探讨了Twist对肿瘤组织发挥作用时可能的下游靶基因的影响。
MMP-2是MMPs家族的研究热点,能够靶向性作用于基底膜和细胞外基质的大多数蛋白质。MMP-2主要降解明胶及Ⅳ型胶原,使得基底膜受到破坏,有助于肿瘤细胞的浸润和转移。Hwang等研究表明MMP-2表达与肿瘤部位、大小、分化程度密切相关,提示MMP-2可能与胃癌的进展有关[10, 11]。Mrena等研究显示上皮细胞中MMP-2表达与肿瘤分期、浸润深度有关,而基质细胞中MMP-2表达与肿瘤分期、肠型有关。且MMP-2与预后差相关[12]。Wang等研究发现,转移性胃癌患者MMP-2的表达显著高于原发性胃癌,转移性胃癌呈现出更积极的组织形态变化,提示MMP-2可能与胃癌转移的发生机制有关[13]。我们检测了37例胃癌组织中MMP-2蛋白的表达情况,结果显示其表达与复发、远处转移有关,提示MMP-2在胃癌发展过程中扮演了重要角色。
本研究将Twist与MMP-2的表达进行了相关性分析。结果显示,Twist的表达与MMP-2的表达呈正相关。Luo等将Twist基因稳定转染到胃癌细胞中,结果显示肿瘤细胞侵袭和迁徙能力显著增加,同时MMP-2的表达也升高[8]。以上研究结果表明,Twist基因和MMP-2在胃癌发生、发展过程中关系密切,在一定水平上,Twist调控着MMP-2的表达过程。
| [1] | Orlichenko LS, Radisky DC. Matrix metalloproteinases stimulate epithelial-mesenchymal transition during tumor development[J]. Clin Exp Metastasis, 2008, 25(6): 593-600. DOI: 10.1007/s10585-008-9143-9. |
| [2] | Bonnomet A, Brysse A, Tachsidis A, et al. Epithelial-to-mesenchymal transitions and circulating tumor cells[J]. J Mammary Gland Biol Neoplasia, 2010, 15(2): 261-273. DOI: 10.1007/s10911-010-9174-0. |
| [3] | McConkey DJ, Choi W, Marquis L, et al. Role of epithelial-to-mesenchymal transition (EMT) in drug sensitivity and metastasis in bladder cancer[J]. Cancer Metastasis Rev, 2009, 28(3-4): 335-344. DOI: 10.1007/s10555-009-9194-7. |
| [4] | Yang J, Mani SA, Donaher JL, et al. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis[J]. Cell, 2004, 117(7): 927-939. DOI: 10.1016/j.cell.2004.06.006. |
| [5] | Liu AN, Zhu ZH, Chang SJ, et al. Twist expression associated with the epithelial-mesenchymal transition in gastric cancer[J]. Mol Cell Biochem, 2012, 367(1-2): 195-203. DOI: 10.1007/s11010-012-1333-8. |
| [6] | Ru GQ, Wang HJ, Xu WJ, et al. Upregulation of Twist in gastric carcinoma associated with tumor invasion and poor prognosis[J]. Pathol Oncol Res, 2011, 17(2): 341-347. DOI: 10.1007/s12253-010-9332-0. |
| [7] | Feng MY, Wang K, Song HT, et al. Metastasis-induction and apoptosis-protection by TWIST in gastric cancer cells[J]. Clin Exp Metastasis, 2009, 26(8): 1013-1023. DOI: 10.1007/s10585-009-9291-6. |
| [8] | Luo GQ, Li JH, Wen JF, et al. Effect and mechanism of the Twist gene on invasion and metastasis of gastric carcinoma cells[J]. World J Gastroenterol, 2008, 14(16): 2487-2493. DOI: 10.3748/wjg.14.2487. |
| [9] | Zhu DY, Guo QS, Li YL, et al. Twist1 correlates with poor differentiation and progression in gastric adenocarcinoma via elevation of FGFR2 expression[J]. World J Gastroenterol, 2014, 20(48): 18306-18315. DOI: 10.3748/wjg.v20.i48.18306. |
| [10] | Hwang TL, Lee LY, Wang CC, et al. Claudin-4 expression is associated with tumor invasion, MMP-2 and MMP-9 expression in gastric cancer[J]. Exp Ther Med, 2010, 1(5): 789-797. |
| [11] | Lee LY, Wu CM, Wang CC, et al. Expression of matrix metalloproteinases MMP-2 and MMP-9 in gastric cancer and their relation to claudin-4 expression[J]. Histol Histopathol, 2008, 23(5): 515-521. |
| [12] | Mrena J, Wiksten JP, Nordling S, et al. MMP-2 but not MMP-9 associated with COX-2 and survival in gastric cancer[J]. J Clin Pathol, 2006, 59(6): 618-623. DOI: 10.1136/jcp.2005.033761. |
| [13] | Wang LB, Jiang ZN, Fan MY, et al. Changes of histology and expression of MMP-2 and nm23-H1 in primary and metastatic gastric cancer[J]. World J Gastroenterol, 2008, 14(10): 1612-1616. DOI: 10.3748/wjg.14.1612. |
 2017, Vol. 38
2017, Vol. 38
