2. 武汉大学基础医学院病理生理学教研室 湖北 武汉 430071
2. Dept. of Pathophysiology, School of Basic Medical Sciences, Wuhan University, Wuhan 430071, China
腹膜透析(peritoneal dialysis, PD)是治疗终末期肾病(end-stage renal disease, ESRD)的主要方法,常规腹膜透析液以葡萄糖作为渗透溶剂。然而长期腹膜透析后会出现腹膜间皮细胞的缺失、间质纤维化,最终形成腹膜纤维化,超滤功能丧失,导致患者最终退出腹膜透析[1]。以往研究表明,腹膜液中葡萄糖浓度的高低对腹膜纤维化有重要影响,然而其作用机制尚未明了,需要进一步研究。
1 材料与方法 1.1 主要材料胎牛血清(CSF)、DMEM培养基(Gibco, 11965-092) 购自Gibco公司。腹膜透析液(PDS)购自美国Baxter公司。角蛋白、波形蛋白和Ⅷ因子免疫组化试剂盒购自武汉博士德公司。抗NLRP3(#15101)、LC3B(#2775) 抗体购自CST公司。胰酶、葡萄糖、鱼滕酮(Rotenone)购自Sigma公司。荧光探针DCFH-DA购自Molecular probe公司。
1.2 腹膜间皮细胞的培养与鉴定人腹膜间皮细胞株(HMrSV5) 购自广州铭善上生物科技有限公司,细胞生长于含10%胎牛血清的DMEM完全培养液中,5% CO2、37 ℃条件下培养。常规换液传代,以第3-6代细胞进行免疫组化鉴定并进行实验。细胞鉴定根据显微镜下形态学观察, 间接免疫组化法检测角蛋白、波形蛋白和Ⅷ因子。
1.3 实验分组实验分5组:正常培养细胞组(阴性对照组,Con组)、DMEM+1.5%腹透液(1.5%PDS组)、DMEM+2.5%腹透液(2.5%PDS组)、DMEM+4.25%腹透液(4.25%PDS组)、DMEM+ 4 μmol/L Rotenone(阳性对照组)。各组使用相应浓度的PDS与DMEM按1:1体积比例混合后培养细胞,于24、48 h收样检测线粒体活性氧及细胞质活性氧;于48 h收样Western Blot检测NLRP3和LC3蛋白表达变化;取处理48 h样品进行透视电镜观察。
1.4 主要方法 1.4.1 细胞内氧自由基水平的测定对处理过的HMrSV5细胞,用胰酶消化制备成单细胞悬液,用0.5 ml冰冷PBS调整细胞量为5万。直接向细胞悬液中加入荧光探针DCFH-DA(2’, 7’-二氯荧光黄双乙酸盐)探针至溶液终浓度100 μmol/L,避光37 ℃孵育时间30 min。孵育结束后,用PBS洗涤3次,加入1.0 ml Hanks液重悬,采用488 nm波长激发,测定530 nm以上的发射波长收集荧光信号;细胞应可分成两个亚群:氧自由基阴性细胞仅有很低的荧光强度,氧自由基阳性细胞有较强的橙色荧光。
1.4.2 线粒体氧自由基检测收集1×106个细胞,用冷PBS洗涤细胞,并重悬细胞量为105/ml。直接向细胞悬液中加入二氢罗丹明(dihydrorhodamine 123, DHR123),终浓度为0.5 μmol/L,在37 ℃、5%CO2培养箱内避光孵育30 min,用PBS洗涤3次,加入1.0 ml Hanks液重悬,采用流式细胞分析方法,激发波长488 nm,发射波长565 nm以上收集平均荧光强度(mean fluorescence intensity,MFI)进行分析。
1.4.3 蛋白免疫印迹(Western Blot)细胞中蛋白质用RIPA液提取,具体操作参见奥斯伯等主编的《分子生物学实验指南》。提取蛋白质后,用Bio-Rad蛋白测定试剂盒进行浓度测定并将蛋白浓度调成2 μg/μl,取出10 μg蛋白液加入上样缓冲液,进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),其中NLRP3分离胶8%,LC3B分离胶12%,浓缩胶5%。恒压100 V电泳至分离胶底部;恒流350 mA,60 min转移到硝酸纤维素膜上,用5%的BSA封闭60 min后,分别加入l:1 000稀释的兔抗人NLRP3和LC3B抗体,摇床上振摇120 min,用含吐温20的磷酸盐缓冲液(PBST)洗涤3次,每次10 min。再加入1:10 000稀释的羊抗兔IgG-HRP,摇床上振摇45 min,PBST洗涤3次,每次10 min。电化学发光(ECL)试剂显色、曝光,并用扫描仪进行扫描分析。
1.4.4 透射电镜观察按照前面分组进行样品处理,到达处理时间点后,消化细胞,离心收集,PBS洗涤,离心收集细胞团,进行2.5%戊二醛固定2 h。用0.1 mol/L磷酸漂洗液漂洗3次,每次15 min,1%锇酸固定液进行后固定2 h,用0.1 mol/L磷酸漂洗液漂洗3次, 每次15 min;4 ℃各级乙醇逐级脱水,包埋,固化,超薄切片机切片50-60 nm,3%醋酸铀-枸橼酸铅双染色,最后置FEI Tecnai 12型透射电子显微镜观察并拍片。
1.5 统计学处理每个实验重复3次(n=3),计算平均值±标准差。统计软件为SPSS 18.0。每个处理组的数据均和对照组相比较。采用单因素方差分析及t检验,P<0.05为差异有统计学意义。
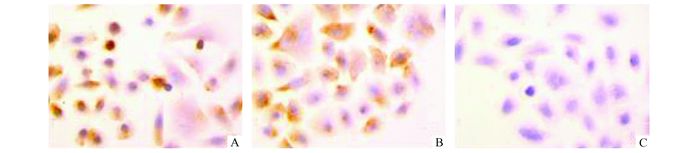
2 结果 2.1 腹膜间皮细胞的鉴定人腹膜间皮细胞株(HMrSV5) 形态呈多边形,贴壁生长至融合状态呈现典型的铺路石样排列。免疫组化结果显示,抗角蛋白和波形蛋白均阳性,胞质可见棕色颗粒,胞核中未见;抗Ⅷ因子相关抗原表达阴性,胞质及胞核未见棕色颗粒(图 1)。据此可见,该细胞为人腹膜间皮细胞株。
|
图 1 人腹膜间皮细胞免疫组化鉴定(×400) A:免疫组化检测角蛋白; B:免疫组化检测波形蛋白; C:免疫组化检测第Ⅷ因子相关抗原 |
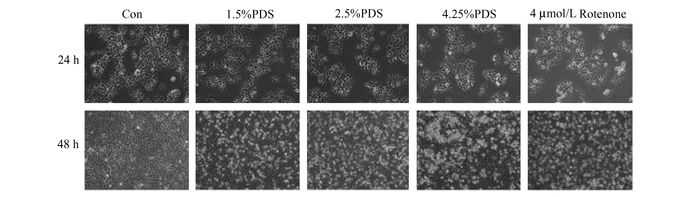
PDS对HMrSV5细胞形态的影响:干预培养24 h后,正常对照组细胞呈多边形,边界清晰,1.5%-4.25%PDS对细胞生长速度有不同影响,细胞密度均低于对照组,部分细胞逐渐转变为长梭形,阳性对照Rotenone细胞出现生长缓慢,部分细胞漂起。干预培养48 h后,正常对照组细胞汇合度达到100%,细胞呈现铺路石状。1.5%-4.25% PDS组细胞有不同程度细胞脱落,细胞边界不清晰;高糖4.25% PDS组细胞出现成片脱落,而阳性对照Rotenone组几乎没有贴壁细胞(图 2)。
|
图 2 各分组细胞形态变化(×100) |
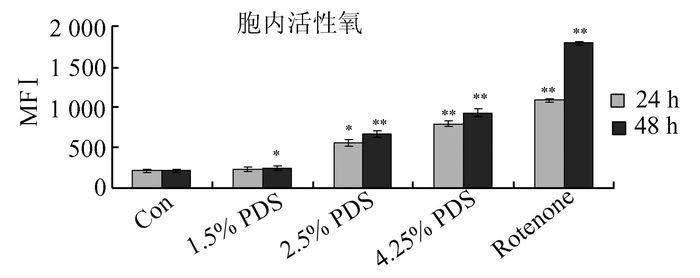
不同葡萄糖浓度对细胞内氧自由基生产的影响:将各组细胞分别培养24、48 h,流式细胞仪检测结果显示,高糖环境下人腹膜间皮细胞内氧自由基产生水平显著高于阴性对照组(P<0.05,P<0.01),并且随葡萄糖浓度增加,时间延长,氧自由基产生水平逐渐增高。其中4.25% PDS组处理48 h及阳性对照Rotenone处理组氧自由基产生水平显著升高(图 3)。
|
图 3 细胞内活性氧水平的测定 *P<0.05,**P<0.01,与前一组比较 |
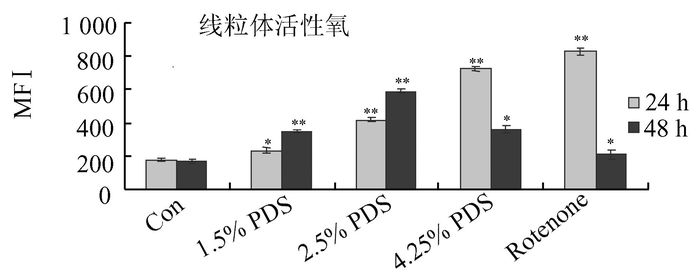
选择不同浓度葡萄糖浓度及不同时间刺激后人腹膜间皮细胞线粒体氧自由基检测,在24 h内,随葡萄糖浓度升高,线粒体氧自由基水平逐渐升高;在处理48 h,中浓度2.5% PDS组的线粒体氧自由基为最高组,高浓度4.25% PDS组出现回落。阳性对照组Rotenone线粒体氧自由基也出现48 h低于24 h, 可能线粒体氧自由基泄漏到细胞质中(图 4)。
|
图 4 线粒体活性氧水平的测定 *P<0.05,**P<0.01,与前一组比较 |
蛋白免疫印迹显示,1.5%、2.5%、4.25% PDS处理48 h可引起细胞炎症因子NLRP3高表达,并随葡萄糖浓度增加而升高,阳性对照组(Rotenone)达到最高峰。自噬分子LC3B也随葡萄糖浓度升高表达明显,LC3Ⅰ/LCⅡ比值显著升高,阳性对照组(Rotenone)比值达到高峰(图 5)。
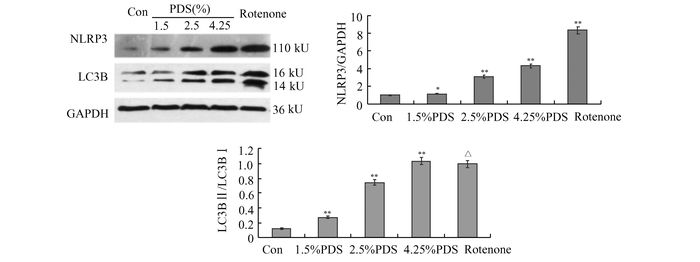
|
图 5 蛋白印迹检测各组NLRP3和LC3B表达水平 **P<0.01, 与前一组比较;△P<0.01,与对照组比较 |
对照组细胞染色质松散,细胞轮廓清晰。细胞内线粒体丰富,大多数是呈圆形或卵圆形,线粒体嵴明显,排列整齐。1.5% PDS处理HMrSV5细胞48 h透射电镜观察到有染色质固缩,细胞内出现双层膜组成的自噬小体及内质网肿胀。2.5%处理HMrSV5细胞48 h细胞器结构损伤,可见线粒体肿胀,细胞空泡化, 溶酶体出现。4.25%PDS处理组细胞中细胞核固缩明显,有自噬小体,线粒体结构不清晰(图 6)。

|
图 6 透射电镜检测各组 A:阴性对照组; B:1.5%PDS组; C:2.5%PDS组; D:4.5%PDS组 |
腹膜间皮细胞起源于中胚层,可以同时表达上皮细胞和纤维细胞特征性的中间纤维角质蛋白和波形纤维蛋白,并合成多种细胞外基质蛋白、金属蛋白酶等基质降解酶,在组织损伤与修复过程中起重要作用[2, 3]。通过形态学观察及免疫组化染色鉴定,充分证明人腹膜间皮细胞HMrSV5的可靠性。PD4低钙腹膜透析液的钙离子浓度属生理范围,它是目前国内唯一符合KDIGO指南推荐钙离子浓度的腹膜透析液。PD4系列腹膜透析液(百特公司)均有三种葡萄糖浓度:1.5%、2.5%和4.25%,透析液含糖浓度越高,渗透性越大对水分清除能力越大,可以根据患者的不同情况,满足临床的不同处方需求。
腹膜透析是根据腹膜具有半透膜的特性,向腹腔内注入透析液,借助腹膜毛细血管内血浆与腹腔内的透析液中的溶质梯度和渗透梯度,通过弥散和渗透原理清除机体内代谢废物和多余的水分,是肾脏替代治疗的主要手段之一[4]。与腹膜透析有关的最重要生理结构是腹膜,腹膜间皮细胞是构成腹膜的最重要的细胞群体,它在保持腹膜结构的完整性和功能有效性中起重要作用。长期用高糖腹透液进行腹膜透析可使得腹膜间皮层细胞脱落、缺失,金属蛋白酶等基质降解酶的产生减少,基质金属蛋白酶及其抑制剂平衡被破坏,抑制细胞外基质的降解;同时增加纤维连接蛋白、活化蛋白的表达,促进腹膜纤维化[5]。
荧光探针DCFH-DA是一种非极性荧光染料,本身不发光,可以自由穿过细胞膜,进入细胞内后,被细胞内非特异性酯酶水解脱乙酰基生成DCFH,而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内产生的氧自由基可以氧化DCFH生成发绿色荧光的二氯荧光素(DCF)[6]。检测DCF的荧光强度就可以间接地反映细胞内氧自由基的水平,观察随葡萄糖浓度变化及不同作用时间对人腹膜间皮细胞产生氧自由基的影响。结果显示高糖可刺激体外培养的人腹膜间皮细胞氧自由基的生成。
线粒体是真核细胞内的一种能量转换细胞器,通过氧化磷酸化为好氧生物提供生命活动所需要的能量,被形象地称为细胞的“动力工厂”。高浓度葡萄糖PDS通过抑制线粒体呼吸链酶复合物的活性,引起人腹膜间皮细胞的氧化损伤,进而导致腹膜间皮细胞层的高通透性增高。推测高糖PDS引起的氧化损伤可能与线粒体呼吸链的活性改变有关,导致线粒体源性的氧自由基生产增加,通透性升高。
细胞自噬是维持细胞内环境自稳的一种自我保护机制,是由溶酶体介导的降解细胞内受损的蛋白质或者细胞器的代谢过程[7];一种是炎症小体可能通过细胞自噬而被直接降解[8];另一更有可能是,细胞自噬会下调氧自由基的产生,进而抑制炎症小体[9]。当细胞自噬不能正常发挥作用时,会形成氧自由基在线粒体的不正常积聚,胞内释放增多。而氧自由基能够被免疫细胞内的炎症小体识别,刺激促炎因子的释放,引起炎症反应[10]。
因此,针对氧化应激采取有效的治疗措施势在必行。一些抗氧化剂如维生素E具有较强的抗氧化作用,可清除线粒体氧化产生的氧自由基,维持细胞内环境的稳定,在防治腹膜纤维化的发展过程中起到一定的作用。本实验为基础研究及临床防治腹膜超滤衰竭和腹膜纤维化,提供了新的研究方向和防治思路。
| [1] |
任昊, 陈生晓, 刘宏发, 等. 含糖腹透液对大鼠腹膜间皮细胞功能的影响[J].
南方医科大学学报, 2009, 29(8): 1752-1754.
Ren H, Chen SX, Liu HF, et al. Effects of peritoneal dialysis solution on apoptosis and intracellular free calcium, cell surface ICAM-1 expression of rat peritoneal mesothelial cells[J]. J South Med Univ, 2009, 29(8): 1752-1754. |
| [2] | Cela O, Piccoli C, Scrima R, et al. Bupivacaine uncouples the mitochondrial oxidative phosphorylation, inhibits respiratory chain complexes Ⅰ and Ⅲ and enhances ROS production: Results of a study on cell cultures[J]. Mitochondrion, 2010, 10: 487-496. DOI: 10.1016/j.mito.2010.05.005. |
| [3] |
朱雪倩, 凌光辉, 肖力, 等. 线粒体呼吸链在高糖腹膜透析液诱导人腹膜间皮细胞层高通透性中的作用[J].
中华肾脏病杂志, 2010, 26(10): 785-790.
Zhu XQ, Ling GH, Xiao L, et al. Role of mitochondrial chain in hyperpermeability of human peritoneal mesothelial cells induced by high glucose peritoneal dialysate[J]. Chin J Nephrol, 2010, 26(10): 785-790. DOI: 10.3760/cma.j.issn.1001-7097.2010.10.013. |
| [4] |
洪富源, 孙芳, 刘军, 等. 细胞内活性氧在糖基化终末产物促人腹膜间皮细胞分泌血管内皮生长因子中的作用[J].
肾脏病与透析肾移植杂志, 2008, 17(6): 523-528.
Hong FY, Sun F, Liu J, et al. Effect of reactive oxygen species on AGE-HSA induced expression of VEGF in human peritoneal mesothelial cells[J]. Chinese Journal of Neuphrology, Dialysis & Transplantation, 2008, 17(6): 523-528. |
| [5] | Tal MC, Sasai M, Lee HK, et al. Absence of autophagy results in reactive oxygen species-dependent amplification of RLR signaling[J]. Proc Natl Acad Sci USA, 2009, 106(8): 2770-2775. DOI: 10.1073/pnas.0807694106. |
| [6] | Wu YT, Tan HL. Dual role of 3-methyladenine in modulation of autophagy via different temporal patterns of inhibition on class Ⅰ and Ⅲ phosphoinositide 3-kinase[J]. J Biol Chem, 2010, 285(14): 10850-10861. DOI: 10.1074/jbc.M109.080796. |
| [7] |
李金凤, 谢笛, 何平平, 等. NLRP3炎性体与代谢性疾病的研究进展[J].
生物化学与生物物理进展, 2014, 41(5): 425-434.
Li JF, Xie D, He PP, et al. Research advances of the NLRP3 inflammasome and metabolic disease[J]. Prog Biochem Biophys, 2014, 41(5): 425-434. |
| [8] |
何贤辉, 何健, 欧阳东云. 细胞自噬与炎症反应相互作用的研究进展[J].
暨南大学学报:自然科学与医学版, 2013, 34(2): 125-128.
He XH, He J, Ouyang DY. Advances in the interaction of autophagy with inflammatory response[J]. Journal of Jinan University: Natural Science & Medicine Edition, 2013, 34(2): 125-128. |
| [9] |
夏海发, 尚游, 姚尚龙. 死亡相关蛋白激酶1的分子结构与炎症调节作用的研究进展[J].
中华危重病急救医学, 2015, 27(1): 158-160.
Xia HF, Shang Y, Yao SL. Advances in molecular structure of death-related protein kinase 1 and regulation of inflammation[J]. Chinese Critical Care Medicine, 2015, 27(1): 158-160. |
| [10] | Zhou R, Yazdi AS, Menu P, et al. A role for mitochondria in NLRP3 inflammasome activation[J]. Nature, 2011, 469(7329): 221-225. DOI: 10.1038/nature09663. |
 2017, Vol. 38
2017, Vol. 38

 ,
,