主动脉夹层(aortic dissection,AD)是一种危及生命的心血管急症,大量的流行病学调查显示男性与女性的主动脉夹层发病率之比为3:1-5:1,高于同期高血压的发病率之比,提示雌激素对主动脉夹层可能有一定的保护作用[1]。雌激素受体(estrogen receptor,ER)是介导雌激素作用的载体,目前研究较多的雌激素受体有三种,包括定位于细胞核内的雌激素受体α(estrogen receptor alpha,ERα)和雌激素受体β(estrogen receptor beta,ERβ)以及定位于细胞膜上的G蛋白耦联受体30(G protein coupled receptor 30,GPR30)。雌激素受体的激活参与了雌激素对众多心血管系统疾病的保护作用,然而女性群体中主动脉夹层发病率较低是否与雌激素受体相关,目前研究较少。我们推测夹层主动脉中雌激素受体水平下调,且这种下调引起相关因子的改变,从而增加了主动脉夹层的易感性。为了验证上述假设,我们通过对正常与夹层主动脉中雌激素受体的研究,初步探讨其与主动脉夹层发病的关系及可能的机制。
1 材料与方法 1.1 一般信息夹层主动脉标本取自2014年1-12月在我院诊断为Stanford A型主动脉夹层并行“全弓替换+支架象鼻”手术治疗的男性患者,共16例,年龄(48.6±6.9)岁。正常主动脉取自移植供体,男性,排除心血管系统疾病,共10例。主动脉标本取下后用冰生理盐水冲洗干净,一部分置于4%多聚甲醛溶液中固定,一部分存放于-80 ℃冰箱保存。
1.2 材料维多利亚蓝B (国药集团),丽春红S (国药集团),兔抗人ERα,兔抗人ERβ单克隆抗体(Abcam公司,美国),兔抗人GPR30单克隆抗体(Bioss公司,美国),兔抗人结缔组织生长因子(CTGF)多克隆抗体(Abcam公司,美国),兔抗人基质金属蛋白酶(MMP-2,MMP-9),GAPDH单克隆抗体(Cell Signaling Technology公司,美国),羊抗兔多克隆荧光二抗(LI-COR公司,美国),免疫组化试剂盒(北京中杉金桥公司),DAB显色试剂盒(武汉博士德公司),Odyssey红外扫描显影仪(LI-COR公司,美国),Olympus BX51正置显微镜(Olympus公司,日本)。
1.3 维多利亚蓝染色5 μm石蜡切片脱蜡,70%乙醇冲洗2 min,维多利亚蓝染液染色1 h,95%乙醇分色2 s,蒸馏水洗2 min,丽春红S染液染色3-4 min,无水乙醇浸洗切片2次,二甲苯脱水透明,中性树胶封片。
1.4 免疫组织化学染色检测主动脉中雌激素受体的表达5 μm石蜡切片脱蜡,3%的过氧化氢封闭内源性过氧化物酶,微波抗原修复,PBS冲洗后滴加相应一抗,4 ℃湿盒中孵育过夜,PBS冲洗后滴加二抗,室温孵育30 min,PBS冲洗后滴加DAB显色液,苏木素复染1 min,水洗后1%的盐酸乙醇分化,逐级脱水后中性树胶封片。显微镜下观察,正常与夹层主动脉均于200倍下随机选择5个视野,计算视野内阳性细胞百分比,取平均值。
1.5 Western blot检测主动脉中ERα,ERβ,CTGF,MMP-2,MMP-9的表达RIPA裂解液裂解组织,4 ℃离心取上清,BCA法测定蛋白浓度。煮沸5 min,以10%分离胶和5%浓缩胶电泳,电转仪转膜,TBS-T洗涤,5%BSA室温封闭,分别加入相应一抗,4 ℃孵育过夜。TBS-T清洗,羊抗兔荧光二抗室温孵育1 h,TBS-T清洗,Odyssey红外扫描显影仪扫描荧光条带,Quantity one软件进行灰度测量,以目的蛋白与内参蛋白的灰度比值作为蛋白相对表达量。
1.6 统计学分析采用GraphPad Prism 5进行统计学分析。连续性变量以平均值±标准差(x±s)表示,两组之间比较采用t检验;线性回归分析ERα,ERβ与CTGF,MMP-2,MMP-9之间的关系,P<0.05为差异有统计学意义。
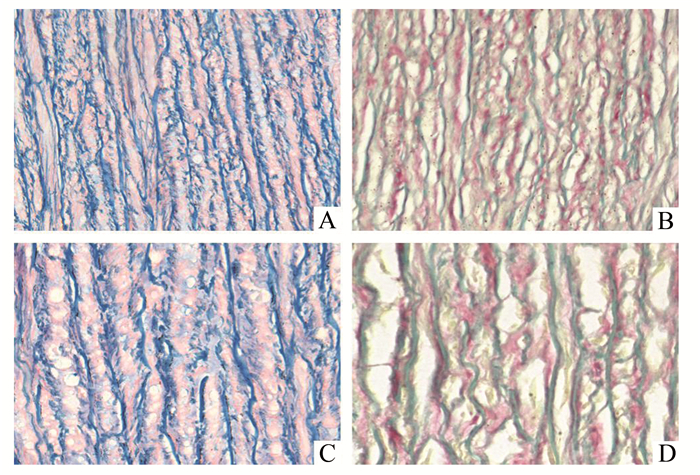
2 结果 2.1 维多利亚蓝染色正常主动脉胶原纤维与弹力纤维比例适当,排列整齐,致密有序;夹层主动脉中胶原沉积及弹力纤维断裂增多,两者排列疏松紊乱,分布不均,比例失调,见图 1。
|
图 1 正常主动脉与夹层主动脉维多利亚蓝染色结果(蓝色为弹力纤维,红色为胶原纤维) A.正常主动脉×200;B.夹层主动脉×200;C.正常主动脉×400;D.夹层主动脉×400 |
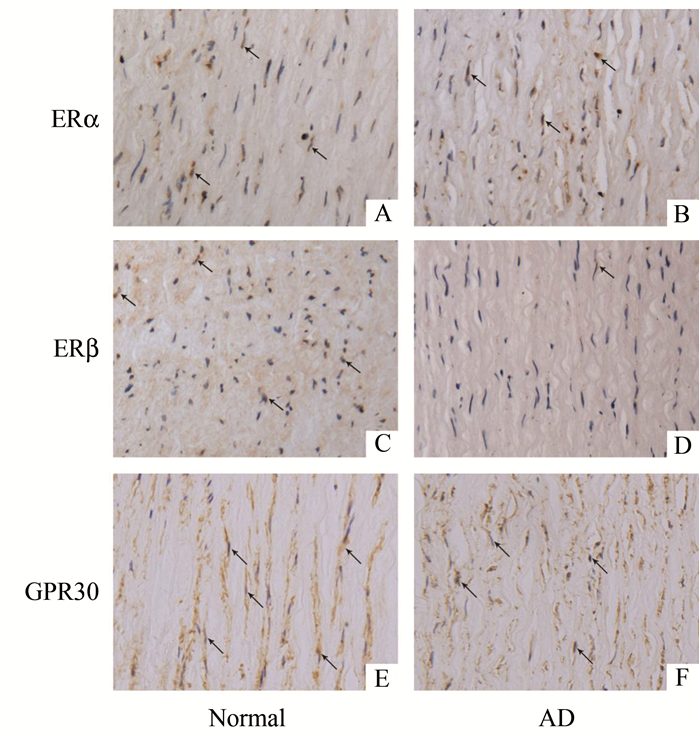
见图 2。正常主动脉与夹层主动脉中均有雌激素受体表达,其中雌激素受体α表达在两组中无显著差异[(44.5±14.7)% vs (38.6±7.8)%,P=0.83],雌激素受体β在夹层主动脉中表达显著降低[(46.1±12.4)% vs (16.9±5.8)%,P<0.05],GPR30在两组中表达无明显差异[(66.3+11.7)% vs (58.4±17.9)%,P=0.71]。
|
图 2 正常主动脉与夹层主动脉中雌激素受体免疫组织化学染色结果(黑色箭头示阳性细胞×200) |
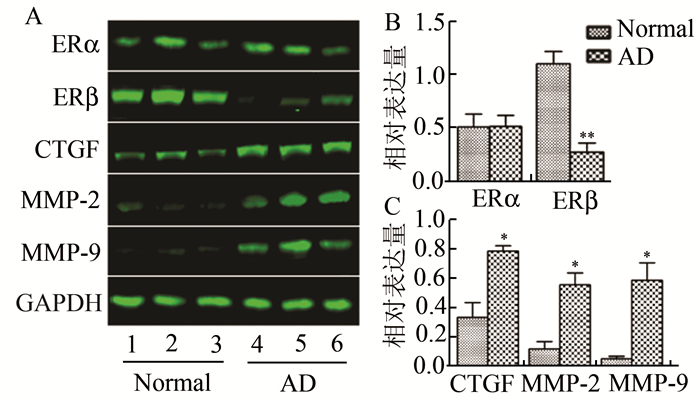
雌激素受体α与雌激素受体β在正常主动脉中均有表达,且ERβ表达较高,夹层主动脉中ERα表达与正常主动脉无明显差异而雌激素受体β表达显著降低(P<0.01)。CTGF在正常主动脉中表达较弱,MMP-2与MMP-9表达极弱,夹层主动脉中CTGF,MMP-2,MMP-9表达均显著升高(P<0.05)(图 3)。
|
图 3 Western blot检测正常与夹层主动脉中ERα、ERβ、CTGF、MMP-2、MMP-9蛋白的表达水平 A. Western blot电泳图;B. ERα在正常与夹层主动脉中表达无差异,而ERβ表达显著降低;C.夹层主动脉中CTGF、MMP-2、MMP-9表达显著升高; *P<0.05,**P<0.01 |
ERβ的表达与CTGF、MMP-2、MMP-9的表达显著相关(P<0.05),而CTGF的表达不仅与MMP-9显著相关(P<0.05),还与ERβ显著相关。
| 表 1 ERα、ERβ与CTGF、MMP-2、MMP-9蛋白表达水平的相关性分析 |
雌激素一直被认为是心血管系统疾病的保护因子。绝经前女性与同年龄段男性相比,高血压、冠心病发病率均较低,绝经后这种差异消失,同时绝经后早期进行雌激素替代治疗能够一定程度降低发病风险的升高[3]。Zheng等[3]研究表明患有心血管系统疾病的男性体内雌激素水平同样较健康男性低。Nienaber等[4]分析国际主动脉夹层注册机构(International Registry of Acute Aortic Dissection,IRAD)的数据发现,50岁以前女性主动脉夹层发病率较男性低,而随着年龄的增长,这种优势逐渐缩小,75岁之后男女性主动脉夹层发病率趋于一致。
在动物模型中,雌激素已经被证明对腹主动脉瘤有保护作用。Cho等[5]发现在外源性雌激素以及睾丸切除的大鼠中,腹主动脉瘤增长速度较慢,并且伴随着较少的巨噬细胞浸润和较高的MMP-13水平;吴晓飞等[6]研究表明雌激素的保护作用可能通过抑制MMP-2以及MMP-9的分泌来实现。然而,在同样是主动脉扩张性疾病的主动脉夹层中,雌激素的保护作用及其机制目前尚未阐明。
雌激素的作用主要通过雌激素受体的激活在不同水平上实现,ERα与ERβ通过与雌激素反应元件(estrogen reaction element,ERE)或DNA结合改变基因转录水平,而GPR30则通过PI3K和MAPK信号通路快速调节目的蛋白的活性。在心血管系统中,雌激素受体的作用可能不一致,ERα主要参与抗动脉粥样硬化,而ERβ能有效抑制心肌肥厚与纤维化,GPR30通常与内皮细胞的功能及血管舒张有关。
我们的实验结果显示在正常主动脉中ERβ的表达较ERα高,而夹层主动脉中两者关系相反。免疫组化结果提示在正常与夹层主动脉组织中ERα与GPR30无明显改变,而ERβ的表达明显下调。CTGF是CCN家族的成员之一,其主要作用是促进成纤维细胞增殖与细胞外基质的重构。目前的研究表明雌激素与CTGF之间存在相互作用,并在许多以组织纤维化为特征的疾病中扮演重要角色。Cheng等[7]通过质粒转染实验也证实CTGF能够抑制ER的表达。本研究Western blot结果表明主动脉夹层中ERβ下调同时伴随CTGF、MMP-2、MMP-9表达增加,且ERβ的变化与CTGF、MMP-2、MMP-9的变化显著相关。这提示ERβ表达下调可能是CTGF与MMP表达增加的原因之一。
基质金属蛋白酶(matrix metallopeptidase,MMP)的表达在细胞外基质重构过程中起重要作用,众多MMP家族成员在夹层主动脉中表达升高。MMP-2和MMP-9属明胶酶类,其中MMP-2主要由平滑肌细胞分泌,而MMP-9主要由炎症细胞分泌。最近研究发现,血管紧张素Ⅱ诱导的中性粒细胞分泌MMP-9可能在主动脉夹层发病的过程中起到关键作用[9],而CTGF恰能通过NF-κB信号通路趋化炎症细胞[10]。Western blot结果显示正常主动脉中MMP表达极少,而夹层主动脉中MMP表达明显增高,且MMP-9与CTGF的表达显著相关,提示CTGF可能通过上述信号通路促进炎症细胞表达MMP-9,继而诱发主动脉夹层。
综上所述,本研究表明夹层主动脉组织中雌激素受体β表达降低,并且这种改变可能导致了CTGF以及MMP的表达上调,从而促进细胞外基质的重构,增加了主动脉夹层的易感性。需注意的是本研究为观察性研究,且样本数量有限,尽管能够为雌激素对主动脉夹层的保护作用提供一些线索,但其详细机制仍有待更进一步的实验明确。
| [1] | 薛凌, 罗建方, 黄文晖, 等. 主动脉夹层患者临床特征的性别差异[J]. 中华心血管病杂志, 2008, 36(5): 415-417. |
| [2] | Grodstein F, Manson JE, Stampfer MJ. Hormone therapy and coronary heart disease: the role of time since menopause and age at hormone initiation[J]. Journal of Womens Health, 2006, 15(6): 392-394. |
| [3] | Zheng H, Li Y, Dai W, et al. Role of endogenous estrogen on the incidence of coronary heart disease in men[J]. Angiology, 2012, 63(8): 591-596. DOI: 10.1177/0003319711432626. |
| [4] | Nienaber CA, Fattori R, Mehata RH, et al. Gender-felated differences in acute aortic dissection[J]. Circulation, 2004, 109: 3014-3021. DOI: 10.1161/01.CIR.0000130644.78677.2C. |
| [5] | Cho BS, Woodrum DT, Roelofs KJ, et al. Differential regulation of aortic growth in male and female rodents is associated with AAA development[J]. Journal of Surgical Research, 2009, 155(2): 330-338. DOI: 10.1016/j.jss.2008.07.027. |
| [6] | 吴晓飞, 张健, 辛世杰, 等. 雌激素在大鼠腹主动脉瘤形成中的作用[J]. 中华医学杂志, 2007, 87(7): 471-474. |
| [7] | Cheng L, Yang Z, Wang X, et al. Suppression of estrogen receptor transcriptional activity by connective tissue growth factor[J]. PLoS One, 2011, 6(5): 1575-1581. |
| [8] | 张雷, 田磊, 廖明芳, 等. 基质金属蛋白酶9在胸主动脉瘤和胸主动脉夹层中的表达[J]. 中华实验外科杂志, 2008, 25(8): 1055-1057. |
| [9] | Kurihara T, Shimizu-Hirota R, Shimoda M, et al. Neutrophil-derived matrix metalloproteinase 9 triggers acute aortic dissection[J]. Circulation, 2012, 126(25): 3070-3080. DOI: 10.1161/CIRCULATIONAHA.112.097097. |
| [10] | Sánchez-López E, Rayego S, Rodrigues-Díez R, et al. CTGF promotes inflammatory cell infiltration of the renal interstitium by activating NF-kappaB[J]. Journal of the American Society of Nephrology, 2009, 20(7): 1513-1526. DOI: 10.1681/ASN.2008090999. |
 2016, Vol. 37
2016, Vol. 37

 ,
,