2. 武汉大学基础医学院解剖学教研室 湖北 武汉 430071
2. Dept. of Anatomy, Basic Medical Sciences of Wuhan University, Wuhan 430071, China
抗癌药物中烷化剂是最为传统的一类,白消安(即马利兰)作为烷化剂中的一种一直在肿瘤治疗的过程中起了很大的作用,尤其是在治疗慢性粒髓细胞性白血病的过程中,环磷酰胺联合白消安的治疗方案更是被广泛应用[1, 2]。几十年的临床应用,再加上其价格低廉,多数烷化剂药物如白消安仍然活跃在临床抗肿瘤一线,但同时临床上也观察到该类药物的生殖毒性作用也较明显,部分青少年男性患者在使用大剂量的烷化剂类药物治疗后导致不育的结果[3, 4]。临床上已有报道有些青少年男性肿瘤患者在使用烷化剂类化疗药物后,成年时期出现性欲减退,乳房女性化(乳腺发育)、睾丸萎缩等不良反应,男性精液中精子的数量有不断减少的趋势,不育比率明显增高[5],男性不育的比例大大增加[6]。目前关于白消安对雄性动物生殖细胞发育影响的相关报道较少。本实验通过使用白消安干预并研究对青春期雄性小鼠生殖系统的影响,以了解烷化剂类抗肿瘤药物对男性青少年肿瘤患者生殖系统发育的影响。
1 材料与方法 1.1 实验动物和材料BALB/c小鼠由武汉大学动物实验中心提供,选取4-6周的健康雄性小鼠作实验动物,108只,随机分为对照组(n=24)和4种不同剂量实验组(n=84)共5组。各组动物自由摄食和饮水。干预药物白消安为Sigma公司产品。
1.2 干预方法各实验组分别以10 mg/kg 1次(n=18)、间隔两周10 mg/kg 2次(n=18)、20 mg/kg (n=24)、30 mg/kg (n=24)的剂量对健康雄性BLBA/c小鼠进行白消安腹腔注射,各组动物再随机分为3组,在药物干预后每组分别饲养4周、8周和12周。
1.3 标本采集各组动物分别于药物干预4周、8周、12周后由武汉大学动物实验中心领取出进行称重,记录体重。再行后处理,用生理盐水(0.85%氯化钠、1%亚硝酸钠、5 000 μ/L肝素钠)经主动脉冲洗灌入,待肝脏颜色变白后换用4%多聚甲醛溶液进行固定,至肝脏质硬至一定程度(10-15 min)后取材,剪取双侧睾丸、附睾头部及尾部,去除脂肪,分别称量各器官湿重。睾丸组织置于4%多聚甲醛固定,并进行组织学观察。
1.4 组织形态学观察将已固定好的睾丸组织进行石蜡包埋、切片(片厚4 μm)、苏木精-伊红(HE)染色,显微镜观察并拍照,观察睾丸的生精上皮结构变化。
1.5 性行为学观察及生育实验在白消安注射后12周,随机取9只对照组小鼠、9只20 mg/kg实验组小鼠及11只30 mg/kg实验组小鼠分别与正常有生育力的雌鼠1:1比例同笼2周,每只雄鼠录像观察15 min,观察时保持相对黑暗安静环境,于下午和晚上进行。记录爬跨时间、插入时间及射精时间等性行为学指标,受孕及产仔情况。
1.6 统计学分析实验数据采用SPSS 19.0统计软件处理,结果均以x±s表示,样本量相同时,组间比较采用配对样本t检验;样本量不相同时,组间比较采用独立样本t检验。以P < 0.05为差异有统计学意义。
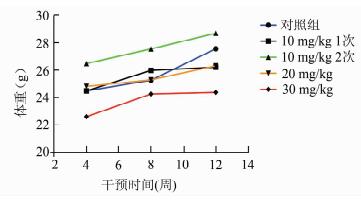
2 结果 2.1 动物一般情况在用药物干预后, 30 mg/kg剂量组动物出现精神萎靡,进食量减少, 毛发光泽度下降。干预结束后, 各组体重指数见图 1,各实验组与对照组比较均无显著差异,但在整个实验期间30 mg/kg实验组体重始终低于低于对照组。
|
图 1 白消安干预后各组动物体重的比较 |
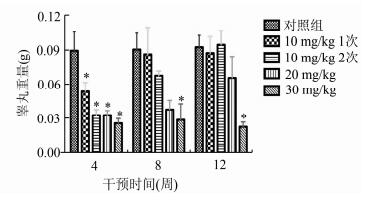
由图 2可见,各实验组睾丸重量与对照组在4周均有显著性差异;在8周仅30 mg/kg组睾丸重量与对照组有显著性差异,而20 mg/kg组睾丸重量均低于对照组;在12周20 mg/kg组、30 mg/kg组睾丸重量与对照组均有显著性差异。实验过程中对附睾重量进行数据统计结果显示各实验组附睾的重量与相应的对照组附睾重量均无显著差异。
|
图 2 白消安干预后各组动物睾丸重量的比较 *与对照组比较, P < 0.05 |
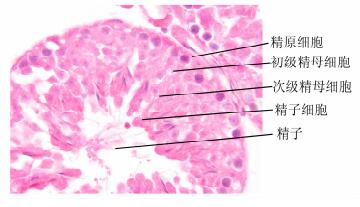
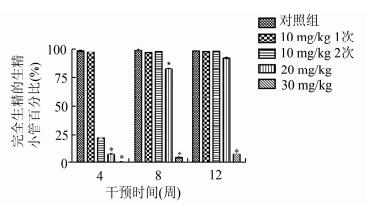
HE染色法后,在显微镜下观察完全生精的生精小管(见图 3)并随机选取各实验组小鼠睾丸组织120个生精小管观察完全生精的生精小管数量并计算其百分比,统计结果见图 4。4周时,10 mg/kg 2次组、20 mg/kg组和30 mg/kg组与对照组相比均有显著差异;8周时,20 mg/kg组和30 mg/kg组与对照组相比均有显著差异;12周时,仅30 mg/kg组与对照组相比均有显著差异。
|
图 3 白消安干预后小鼠睾丸组织完全生精(×100) 完全生精指睾丸标本组织结构正常,曲细精管内可见各级生精细胞:从外周到管腔依次为精原细胞、初级精母细胞、次级精母细胞、精子细胞、精子,层次清楚,排列规则,管腔内有大量成熟精子 |
|
图 4 白消安干预后小鼠睾丸组织完全生精的生精小管数量百分比的比较 *与对照组比较, P < 0.05 |
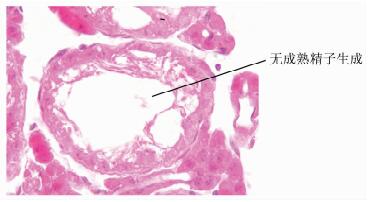
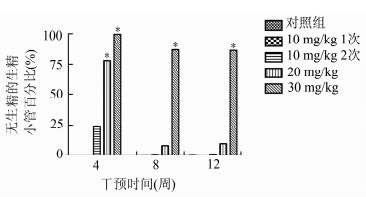
HE染色法后,在显微镜下观察完全生精的生精小管(见图 5),并随机选取各实验组小鼠睾丸组织120个生精小管观察无生精的生精小管数量并计算其百分比,统计结果见图 6。4周时,20 mg/kg组和30 mg/kg组与对照组相比均有显著差异;8周和12周时,仅30 mg/kg组与对照组相比均有显著差异。
|
图 5 白消安干预后小鼠睾丸组织完全生精(×100) 无生精指管腔内各级生精细胞数量明显减少,层次减少,普遍无成熟精子生成 |
|
图 6 白消安干预后小鼠睾丸组织无生精的生精小管数量百分比的比较(x±s) *与对照组比较, P < 0.05 |
单独将对照组和20 mg/kg组、30 mg/kg组分别比较,爬跨时间和生育率均无显著性差异,将20 mg/kg组和30 mg/kg组合并后与对照组进行比较,爬跨时间和生育率存在显著性差异。由于小鼠插入及射精活动的发生率极低故未予以分析。
| 表 1 白消安干预后对照组和所选组别的爬背率和生育率的比较(%) |
有报道称近20年来,随着医学技术的发展,小儿白血病是很少的几种可以治愈的恶性肿瘤之一,而烷化剂类化疗药物白消安的副作用影响了青少年患者成年后的生育能力,已有文献报道环磷酰胺、丙丁酸氮芥等烷化剂对睾丸损害最显著[7-9], 口服环磷酰胺2月后可致无精子症[3],同时也有其它报道烷化剂可导致无精子症或少精子[4, 5]。临床上若小儿白血病患者治愈且成年后有生育要求,其将面临能否生育或生育能力低下的问题。
白消安(busulfan,1,4-丁二醇二甲磺酸酯,C6H14O6S2)是一种磺酸酯类药物,慢性粒细胞性白血病的患者在接受移植祖细胞治疗前常会使用白消安作为预处理药物,但白消安会通过形成DNA-DNA、DNA-蛋白质交叉链以及单链断裂而并发持续性的无精子症。无精子现象是因为白消安主要对G0/G1期细胞产生毒性作用,使细胞在随后有丝分裂的S/G2期死亡。白消安作用于睾丸后,不仅可以优先杀死各级精原细胞,诱发生精细胞凋亡,同时会抑制精子发生,减少精子形成[10]。口服白消安通过首关消除吸收,导致血药浓度水平变化不稳,也因其直接暴露在消化系统中,增加了其药物毒性以及治疗后的死亡率[7-9]。静脉注射白消安的制剂后来被开发,从而提供了更可靠的药代动力学和使用剂量[11]。
本实验以雄性青春期小鼠为模型研究烷化剂类抗癌药物白消安对哺乳动物生殖系统发育的影响。以雄性青春期小鼠体重、生殖器官重量、睾丸形态学改变及小鼠性行为学活动与生育能力为观察指标,结果表明烷化剂类抗癌药物白消安可损害睾丸组织发育。在整个实验期间30 mg/kg实验组体重始终低于低于对照组,这可能是因为给予30mg/kg的剂量后,实验小鼠的精神萎靡,进食情况量减少有关。烷化剂类抗癌药物白消安可损害睾丸组织发育,其毒性效应具有量效和时效,中高剂量(即20 mg/kg和30 mg/kg)白消安对雄性青春期小鼠生殖系统的损伤在8周、12周均未恢复,实验时程中尚未恢复,但并非完全不可逆[12],而低剂量实验组(即10 mg/kg 1次和10 mg/kg 2次)均可恢复。睾丸生精小管为精子产生部位,约占睾丸总体积98%, 睾丸生精小管质量反映睾丸质量[13],白消安对雄性生殖系统的毒性作用,导致睾丸发生变化,从而影响睾丸的功能。使用白消安干预后,雄性青春期小鼠的性欲和生殖能力均受到了一定程度的损害。
综上所述,白消安对雄性青春期小鼠有生殖毒性,且损伤程度具有量效和时效关系,因此在应用烷化剂治疗时尽量采用低剂量、短疗程方案。白消安对生殖系统的毒性作用明确存在,具体通过何种机制产生雄性生殖系统损害,如何避免或将对雄性生殖系统损害降至最低等方面还有待进一步研究。
| [1] | Santos GW, Tutschika PJ, Brookmeyer R, et al. Marrow transplantation for acute nonlymphocytic leukemia after treatment with busulfan and cyclophosphamide[J]. N Engl J Med, 1983, 309(22): 1347-1353. DOI: 10.1056/NEJM198312013092202. |
| [2] | Tutschka PJ, Copelan EA, Klein JP. Bone marrow transplantation for leukemia following a new busulfan and cyclophosphamide regimen[J]. Blood, 1987, 70(5): 1382-1388. |
| [3] | Kenney LB, Laufer MR, Grant FD, et al. High risk of infertility and long term gonadal damage in males treated with high dose cyclophosphamide for sarcoma during childhood[J]. Cancer, 2001, 91(3): 613-621. DOI: 10.1002/(ISSN)1097-0142. |
| [4] | Longhi A, Macchia-godena M, VitaliG, et al. Fertility in male patients treated with neoadjuvant chemotherapy for osteosarcoma[J]. J Pediatr Hematol Oncol, 2003, 25(4): 292-296. DOI: 10.1097/00043426-200304000-00005. |
| [5] | Becker S, Berhane K. A meta-analysis of 61 sperm count studies revisited[J]. Fertil Steril, 1997, 67(6): 1103-1108. DOI: 10.1016/S0015-0282(97)81446-X. |
| [6] | Meistrich ML. Male gonadal toxicity[J]. Pediatr Blood Cancer, 2009, 53(2): 261-266. DOI: 10.1002/pbc.v53:2. |
| [7] | Andersson BS, Thall PF, Madden T, et al. Busulfan systemic exposure relative to regimen-related toxicity and acute graft-versus-host disease:defining a therapeutic window for i.v.BuCy2 in chronic myelogenous leukemia[J]. Biol Blood Marrow Transplant, 2002, 8(9): 477-485. DOI: 10.1053/bbmt.2002.v8.pm12374452. |
| [8] | Slattery JT, Sanders JE, Buckner CD, et al. Graft-rejection and toxicity following bone marrow transplantation in relation to busulfan pharmacokinetics[J]. Bone Marrow Transplant, 1995, 16(1): 31-42. |
| [9] | Scott B, Deeg HJ, Storer B, et al. Targeted busulfan and cyclophosphamide as compared to busulfan and TBI as preparative regimens for transplantation in patients with advanced MDS or transformation to AML[J]. Leuk Lymphoma, 2004, 45(12): 2409-2417. DOI: 10.1080/10428190412331283206. |
| [10] | Marcon L, Zhang X, Hales BF, et al. Effects of chemotherapeutic agents for testicular cancer on rat spermatogonial stem/progenitor cells[J]. J Androl, 2011, 32(4): 432-443. DOI: 10.2164/jandrol.110.011601. |
| [11] | Andersson BS, Kashyap A, Gian V, et al. Conditioning therapy with intravenous busulfan and cyclophosphamide (Ⅳ BuCy2) for hematologic malignancies prior to allogeneic stem cell transplantation:a phase Ⅱ study[J]. Biol Blood Marrow Transplant, 2002, 8(3): 145-154. DOI: 10.1053/bbmt.2002.v8.pm11939604. |
| [12] | Cakici C, Buyrukcu B, Duruksu G, et al. Recovery of fertility in azoospermia rats after injection of adipose-tissue-derived mesenchymal stem cells:the sperm generation[J]. Biomed Res Int, 2013, 2013: 529589. |
| [13] | Chi H, Chun K, Son H, et al. Effect of genistein administration on the recovery of spermatogenesis in the busulfan-treated rat testis[J]. Clin Exp Reprod Med, 2013, 40(2): 60-66. DOI: 10.5653/cerm.2013.40.2.60. |
 2016, Vol. 37
2016, Vol. 37

 ,
,