2. 中南大学湘雅三医院/卫生部移植医学工程技术研究中心 湖南 长沙 410013
2. The 3rd Xiangya Hospital of Central South University, & Research Center of National Health Ministry on Transplantation Medicine Engineering and Technology, Changsha 410013, China
皮肤具有保护、感觉、调节体温、吸收、分泌与排泄、呼吸、新陈代谢、免疫等生理功能[1, 2]。大面积烧伤、创伤、手术伤口等造成皮肤的连续性中断形成创面,可引发机体产生一系列病理生理变化,甚至会危及伤者生命。据报道,每年约有350万人死于创伤[3],创伤成为全世界发病和死亡的主要原因[4]。伤口在形成和愈合过程中难免会被自然界中的微生物所侵袭感染,感染后的伤口不仅会在愈合时间和质量上受到阻碍,严重者会严重威胁患者生命安全。相关统计发现术后伤口感染率排在所有医疗相关感染的第3位[5, 6]。如何避免和应对皮肤伤口感染的发生,使伤口感染率降到最低,同时使伤口感染对人类带所来的威胁降到最低一直是医学相关研究者的重要命题。现如今生物抗菌材料(生物质有机成分及化学合成肽等)、新型抗菌药物等的研究越来多[7, 8],在证实相应材料及药物体外抗菌性能的前提下,于动物在体进行抗菌实验是进一步验证材料及药物抗菌效果和生物学性能的必经之路[9]。基于此,一个稳定有效的动物皮肤感染模型的建立对皮肤抗感染的研究至关重要,本文旨在建立一个有效稳定的大鼠皮肤伤口感染模型,为相关动物实验研究创造条件。
1 材料与方法 1.1 材料 1.1.1 实验动物健康雄性SD大鼠54只,6-8周龄,体重250-300 g,购自北京维通利华实验动物养殖中心,SPF级,动物许可证号:SCXK(鄂)2007-0006。实验动物均饲养于标准实验条件(温度:20-25 ℃,湿度:50%-70%)。动物的管理及人文关怀均按照1998年中华人民共和国国家科学技术委员会颁布的《实验动物管理条例》及1996年美国国家科学院制定的《实验动物关怀及应用指南》执行。
1.1.2 菌种和培养基LB琼脂/肉汤培养基购于中国Hopebio公司。本实验中所使用的大肠杆菌(E. coli, ATCC 8739)和金黄色葡萄球菌(S.aureus, ATCC 29213)购于美国模式培养物集存库(American type culture collection,ATCC)。在两种菌种购置得到后,按照说明书操作步骤将菌种涂布于LB固体培养基上,于二氧化碳细菌培养箱中培养24 h,同样方法继续传代2-3代,使细菌达到最佳活力状态。
1.1.3 试剂与仪器JR-1/2智能恒温控制仪(成都泰盟科技有限公司),BL-420生物技能实验系统(成都泰盟科技有限公司),动物手术台(兴化市同昌不锈钢制品厂),特制皮肤打孔器(直径15 mm打孔器),迈瑞兽用全自动血液细胞分析仪(型号:BC-2800vet),静脉留置针贴膜(3M Tegaderm Film REF: 1624W,USA),硫化钠(CAS:1313-84-4,上海阿拉丁生化科技股份有限公司),戊巴比妥钠(通用CAS:57-33-0,货号:P3761,美国Sigma公司)。
1.2 实验分组及干预54只SD雄性大鼠,随机分为3组,包括非感染组(n=6)、E.coli感染组(n=24)、S.aureus感染组(n=24)。E. coli感染组和S.aureus感染组又分为106,107,108,109集落形成单位(CFU)/ml 4个不同菌浓度的感染亚组,各亚组为6只。分别进行相应的处理:①非感染组:实验大鼠行背部伤口手术,在伤口内滴加无菌生理盐水100 μl,后用临床静脉留置针贴膜进行封闭;②E. coli感染组:同理行大鼠背部伤口制备,各亚组于伤口处滴加E. coli菌液浓度分别为106, 107, 108, 109 CFU/ml的菌液100 μl,后用贴膜固定封闭;③S.aureus组:同E. coli组在制备完成伤口模型后加相应浓度菌液,后固定封闭。
1.3 SD大鼠背部伤口及感染模型的制备查阅相关文献,根据文献中菌液制备、相关动物伤口模型的大小深度、以及感染菌量使用情况我们摸索出一套合适的建模方法[10, 11]。
(1) 不同浓度E. coli和S.aureus菌液制备方法:①菌种平板涂布获得单一集落形成单位。整个操作在灭菌的生物安全柜中进行,用细菌接种棒挑取1-2环细菌(E. coli或者S.aureus)在事先准备好的LB固体培养基上规则划线,盖上培养皿将其放置37 ℃细菌培养箱中培养24 h。②挑取单菌落制备菌悬液。在细菌培养24 h后拿出培养皿,75%乙醇消毒后移入生物安全柜中。用细菌接种棒挑取单一菌落,放入到事先准备好的无菌LB液体培养基试管中,塞上试管塞将其置于细菌摇床(250 r/min,37 ℃)上摇菌过夜。③测量菌液浓度制得不同浓度的细菌菌液。取出摇床上摇菌过夜的菌液,观察菌液颜色和浊度等初步判断是否污染,随后对两种菌体进行电镜观察以确保菌种未被污染。用分光光度计测量原始菌液的浓度,后用梯度稀释法得到106,107,108,109 CFU/ml 4个不同菌浓度的菌液(E. coli和S.aureus菌液)。
(2) SD大鼠背部伤口及感染模型制备具体方法:实验开始前对SD大鼠进行称重记录,3%的戊巴比妥钠(30 mg/kg大鼠体重)腹腔注射行麻醉处理。用小动物剃毛刀于麻醉后大鼠背部行初步剃毛,大鼠背部毛发剃除范围尽量大,随后用7 %的硫化钠进行彻底地去毛处理,10 min后用生理盐水洗净擦干大鼠背部皮肤,以上步骤方便后续伤口处贴贴膜固定用。在完成脱毛处理后将大鼠背部朝上妥善固定于小动物试验台上,实验过程中维持大鼠体温为(36.5±0.3)℃,用10%聚维酮碘对大鼠背部进行消毒处理,准备手术。调整皮肤打孔器的孔径为1.5 cm,将打孔器与皮肤接触头进行消毒,后在大鼠背部脊柱两侧行皮肤打孔处理,过程中保证无菌,打孔深度达到破坏肌肉层为止。用无菌纱布或者棉签擦拭伤口部位,已达到对伤口止血和清除伤口处血液。向不同菌种不同菌液浓度组的伤口处滴加相应浓度的菌液100 μl。用留置针贴膜妥善封闭伤口处,确保贴膜能够与皮肤紧密贴附,贴膜周围用临床无菌胶布再次固定,确保菌液能够足够时间的与伤口处组织接触。待大鼠麻醉苏醒后将每只大鼠单独置于独立通气饲养笼(IVC)中饲养,饲养过程中对大鼠的生存状态、伤口感染变化情况等进行观察拍照记录,直至伤口处明显感染灶形成。
1.4 细菌扫描电镜检测在上述制备菌液过程中,得到细菌悬液后采集一部分菌液,将菌液离心后固定制备成扫描电镜样本,最后在扫描电镜下观察,确定细菌的生长形态、增殖状况、是否存在杂菌污染等。
1.5 血常规检测待伤口处明显感染灶形成,将各组动物处死心脏采血至抗凝采血管中。采用小动物全自动血常规分析仪对大鼠全血进行血常规分析。
1.6 HE染色检测各组伤口组织炎性浸润情况待各组伤口达到感染标准后,将各组动物处死取伤口处组织,4%多聚甲醛固定,石蜡包埋,4 μm切片,经HE染色后在光镜下观察伤口组织的炎性浸润情况。
2 结果 2.1 细菌的培养和菌体形态鉴定在得到两种菌种后于LB固体培养基上对其传代培养(图 1,a1;b1),目的是使得细菌在传代过程中增强细菌活力和状态。随后挑取固体培养基上的单菌落在LB液体培养基中培养制得菌悬液,最后我们将菌液离心,制备成电镜样本,在扫描电镜下对细菌形态进行观察分析(图 1,a2;b2),确认两种菌体在培养的过程中状态良好,同时没有杂菌污染。
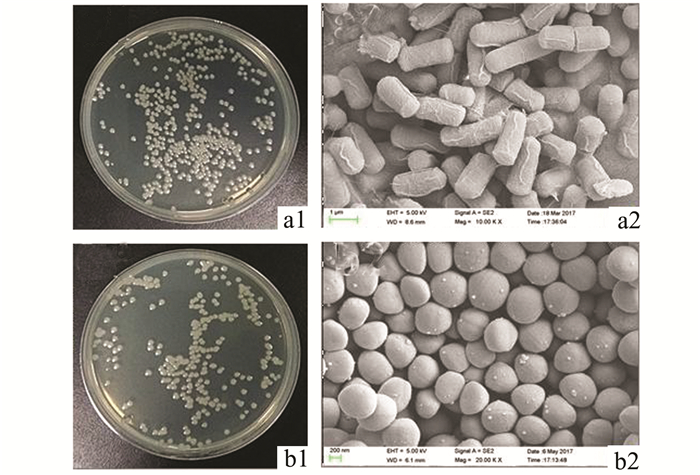
|
图 1 大肠杆菌和金黄色葡萄球菌形态 a1:大肠杆菌单菌落; a2:大肠杆菌扫描电镜照片(×10 000);b1:金黄色葡萄球菌单菌落; b2:金黄色葡萄球菌扫描电镜照片(×20 000) |
E. coli和S.aureus感染组伤口在24 h左右初步形成白色脓胎,48 h能够看到明显的脓胎形成。其中E. coli组的感染伤口处较湿润,脓胎呈灰白色,而S.aureus组感染伤口感染灶较前者稍干燥,脓胎颜色为白色,48 h后颜色逐渐转为浅黄色(图 2)。
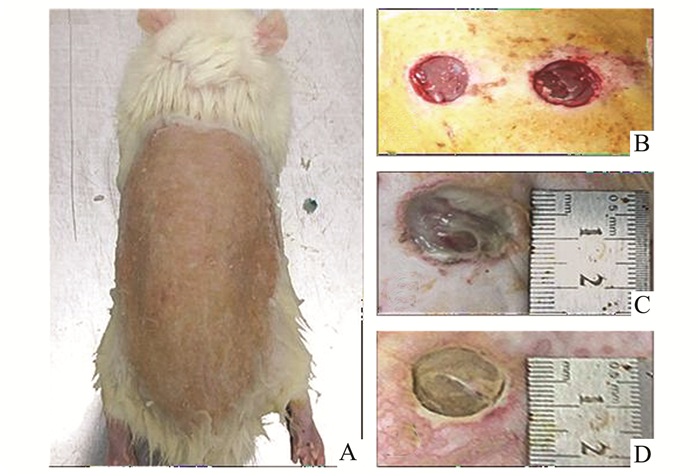
|
图 2 大鼠背部感染伤口模型的制备 A:大鼠彻底脱毛之后;B:大鼠背部伤口手术后;C:大鼠背部伤口大肠杆菌感染48 h后图片;D:大鼠背部伤口金黄色葡萄球菌感染48 h后图片 |
大鼠状态方面,随着菌液浓度从106 CFU/ml增加至109 CFU/ml,大鼠伤口感染程度逐渐加重。E. coli感染组在最高浓度109 CFU/ml情况下大鼠依旧存活的较好。而S.aureus感染组随着菌液浓度增长大鼠状态明显变差,同时在109 CFU/ml亚组感染大鼠死亡率较高。最后我们对各组大鼠在不同浓度菌液感染后的存活率进行统计(表 1)。
| 表 1 各组大鼠术后48 h的存活率统计 |
在术后48 h我们通过血常规对各组大鼠血液进行分析,可以直观的观察到大鼠血液中的细胞成分变化。结果表明无论是E. coli还是S.aureus感染组大鼠机体发生严重的炎症反应,各项炎症指标大幅度增高(表 2)。但是我们分析发现,血常规分析仪给出的数值组内差异较大,同时感染指标与感染严重程度不成严格的规律性变化,其原因与检测血液的浓度差异以及血常规检测本身不稳定性有关。所以结果表明,血常规是大致反映感染及感染严重程度的参考指标,但不是评判其严重程度的准确指标。
| 表 2 各组(非感染、大肠杆菌、金葡菌感染组)大鼠术后48 h血常规结果 |
我们对大鼠感染伤口处行组织病理学分析,目的是了解感染后伤口处组织病理学变化。伤口组织HE染色可以得出:无论是感染组和非感染组,伤口组织相对于正常皮肤组织都有较多炎性细胞的浸润,同时感染组(E. coli和S.aureus)组织中大量的炎性细胞的浸润,组织表面有显著的炎性细胞和炎性坏死灶的堆积(图 3)。最后我们对伤口处组织炎性细胞进行免疫组化检测,根据计数炎症组织中特异的CD45+细胞来反映炎性细胞浸润比例(图 3d)。
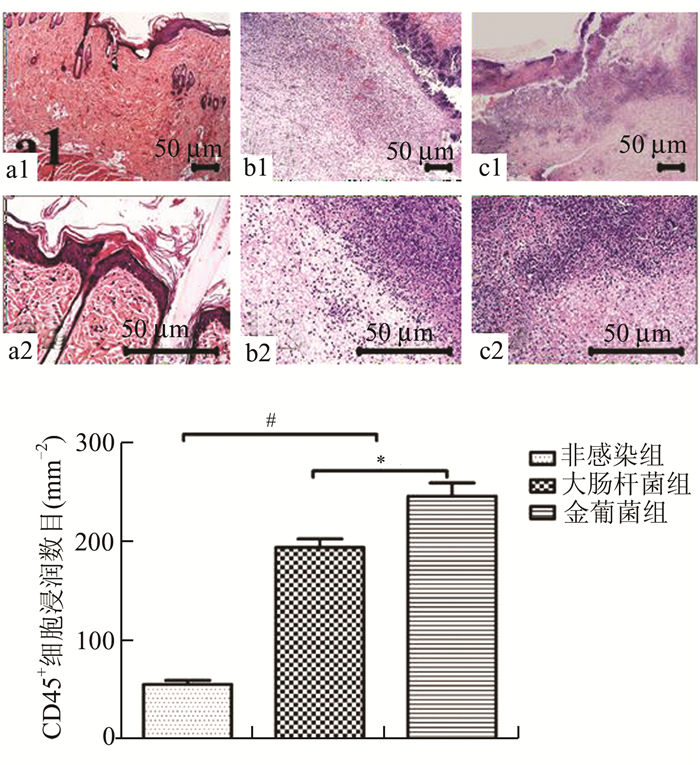
|
图 3 各组大鼠伤口组织HE染色照片及CD45+细胞计数比较 a、b、c分别为正常、大肠杆菌、金黄色葡萄球菌组病理照片;d图为三组组织中CD45+细胞的浸润数目,其中大肠杆菌和金葡菌组取的是108CFU组,#P<0.001,*P<0.05 |
菌液的制备过程是本模型的关键步骤之一,其中应该注意的几点问题有:①细菌实验必须在达到无菌的微生物实验室和试验台中进行,避免其他杂菌的混入,同时也避免实验细菌的播散;② ATCC菌种在复苏后需在传代培养至少3代后用于在体实验中,确保实验菌种活力最佳;③得到菌悬液后必须对其镜下检测判定其无杂菌的污染,随后测得原始菌液浓度,最后用稀释法获得所需的不同浓度梯度的菌液。
在动物模型制备过程中我们采用的是于大鼠背部脊柱两侧对称的打孔,其目的是一个伤口用于观察感染和愈合过程的形态变化,另一个伤口用于组织标本采集。同时在制备大鼠伤口模型过程中关键一点是必须确保伤口的深度能够达到深筋膜层,即能破坏到大鼠的皮下肌肉层。其原因是大鼠的皮下血管分布较人皮肤少,感染的发生需要激活血液系统中的炎性细胞随之参与感染的发生,我们在实验过程中发现不破坏到肌肉层的感染组感染显著降低。另外,本实验中采用的是菌液滴注于伤口处,为了菌液能够与伤口处充分接触,不会因为时间推移以及大鼠体位改变而菌液流失,造成组内或者组间的差异较大。我们摸索出一种有效可行的方法,在滴注了菌液之后采用临床上常用的静脉留置针贴膜将伤口处进行封闭处理,其目的具有两点:①保证各组伤口中相同菌液量与伤口组织接触,减少因体位改变后菌液流失造成的组内和组间的差异;②封闭伤口将其与外界隔绝,避免杂菌的混入造成多重细菌的感染。实验前之所以要用7%硫化钠处理大鼠皮肤残留的毛发,目的是能够保证大鼠皮肤光滑,使得贴膜能够与皮肤充分贴合,确保菌液能够相对较长时间停留在伤口内。
实验后期通过感染大鼠血液常规、皮肤组织病理标本的检测我们发现E. coli和S.aureus能够在伤口处形成预期的感染灶,同时随着感染灶内菌液浓度的改变感染呈逐渐递增状态。
皮肤伤口感染是制约创伤及临床术后患者愈合的关键因素,虽然抗生素的使用极大改善了感染所带来的打击,但是随之而来的是因抗生素滥用引起的超级耐药菌感染[12]。创伤和术后伤口感染的预防和治疗尤其关键,我们通过在大鼠背部制备伤口,同时使用E. coli和S.aureus来感染伤口处,成功制备大鼠皮肤伤口感染模型。由于以上两种细菌是感染最常见的两种细菌,其模型对临床伤口感染具有很好研究和指导意义。
| [1] | Hirabayashi T, Anjo T, Kaneko A, et al. PNPLA1 has a crucial role in skin barrier function by directing acylceramide biosynthesis[J]. Nat Commun, 2017, 8: 14 609. DOI: 10.1038/ncomms14609. |
| [2] | Narbutt J, Bednarski IA, Lesiak A. The effect of an emollient with benfothiamine and Biolin prebiotic on the improvement of epidermal skin function[J]. Postepy Dermatol Alergol, 2016, 33(3): 224-231. |
| [3] | Sen CK, Gordillo GM, Roy S, et al. Human skin wounds: a major and snowballing threat to public health and the economy[J]. Wound Repair Regen, 2009, 17(6): 763-771. DOI: 10.1111/wrr.2009.17.issue-6. |
| [4] | Arumugam S, Al-Hassani A, El-Menyar A, et al. Frequency, causes and pattern of abdorminal trauma: A 4-year descriptive analysis[J]. J Emerg Trauma Shock, 2015, 8(4): 193-198. DOI: 10.4103/0974-2700.166590. |
| [5] | Rose J, Weiser TG, Hider P, et al. Estimated need for surgery worldwide based on prevalence of diseases: a modelling strategy for the WHO Global Health Estimate[J]. Lancet Glob Health, 2015, 3(Suppl 2): S13-S20. |
| [6] | Meara JG, Leather AJ, Hagander L, et al. Global Surgery 2030: evidence and solutions for achieving health, welfare, and economic development[J]. Lancet, 2015, 386(9 993): 569-624. |
| [7] | Fischbach MA, Walsh CT. Antibiotics for emerging pathogens[J]. Science, 2009, 325(5 944): 1 089-1 093. |
| [8] | Slaughter BV, Khurshid SS, Fisher OZ, et al. Hydrogels in regenerative medicine[J]. Adv Mater, 2009, 21(32-33): 3 307-3 329. DOI: 10.1002/adma.v21:32/33. |
| [9] | Mogosanu GD, Grumezescu AM. Natural and synthetic polymers for wounds and burns dressing[J]. Int J Pharm, 2014, 463(2): 127-136. DOI: 10.1016/j.ijpharm.2013.12.015. |
| [10] | Li P, Poon YF, Li W, et al. A polycationic antimicrobial and biocompatible hydrogel with microbe membrane suctioning ability[J]. Nat Mater, 2011, 10(2): 149-156. DOI: 10.1038/nmat2915. |
| [11] | Huang Y, Zhong Z, Duan B, et al. Novel fibers fabricated directly from chitin solution and their application as wound dressing[J]. J Mater Chem B, 2014, 2(22): 3 427-3 432. DOI: 10.1039/c4tb00098f. |
| [12] | Blair JM, Webber MA, Baylay AJ, et al. Molecular mechanisms of antibiotic resistance[J]. Nat Rev Microbiol, 2015, 13(1): 42-51. DOI: 10.1038/nrmicro3380. |
 2018, Vol. 39
2018, Vol. 39


