活体肝移植的实施大大降低了等待移植儿童患者的死亡率,随着外科技术的改善,供受者的手术安全性以及术后生存质量都得到了很大提高。目前国际上儿童移植术后1年和5年生存率分别提高到了90%和85%[1, 2]。尽管如此,活体肝移植供体仍然存在一定的并发症几率,甚至可能导致死亡。因此,对活体肝移植的实施仍须万分谨慎。考虑行活体肝移植必须满足三个条件:第一,肝移植是挽救患儿的唯一治疗方法;第二,患儿无法获得尸体供肝;第三,病情不允许等待尸体肝移植。此外,供者必须经过伦理委员会的审查,必须完全知悉手术可能带来的风险,手术的决定必须是其完全自由意志的体现,未受到来自亲属及其他人的压力。除了健康状况、手术方式、手术风险以及供肝体积等标准以外,对于遗传性代谢性疾病的受者,其亲属供者还必须接受基因背景的筛查和评估。
活体肝移植供者通常为患者的直系亲属。按照国际通行惯例,对供者的评估通常分为三个部分和五个步骤:第一部分包括供者一般情况、血型、疾病史、体重等;第二部分主要是体格检查、精神心理状态、心肺功能评估、实验室检查,以及影像学检查;其中影像学检查主要用于评估供肝体积、肝内解剖结构变异等,包括超声、增强三维CT、磁共振等;第三部分包括必要时的侵入性检查,以了解供肝潜在的问题,例如肝穿活检、肝内血管造影、ERCP等,进一步了解肝脏脂肪变性、动静脉走行以及胆道变异情况。五个评估步骤详见表 1。上述评估的目的在于筛选出完全健康的、手术风险最小的活体供者。原则上出现任何不合格项目均应否定供者资格。
| 表 1 供者术前评估步骤 |
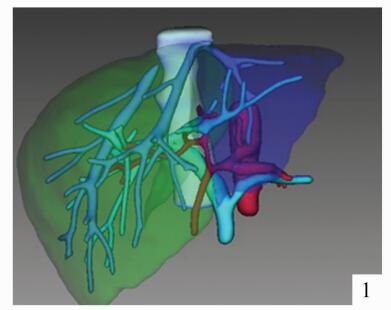
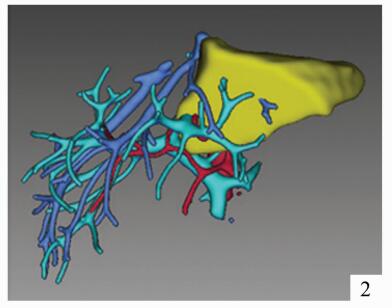
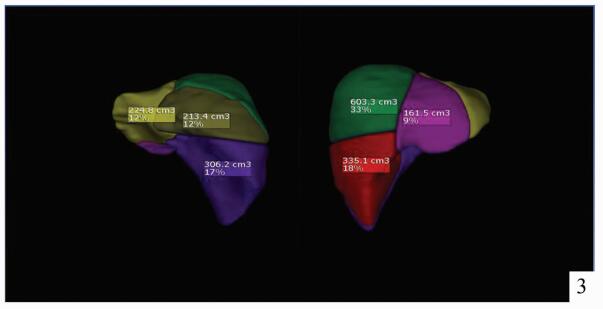
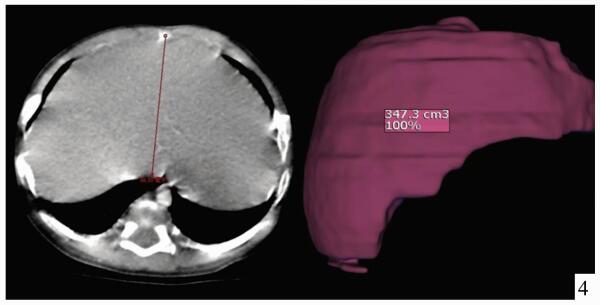
儿童活体肝移植与成人不同,受者体重跨度大,所需供肝质量因人而异。但通常大部分患儿所需肝脏体积均较小,供肝类型以左外叶及左半肝常见,供者剩余肝体积通常远远大于标准肝体积的30%(供者安全所需的最低剩余肝体积)[3]。2岁以内的婴幼儿活体肝移植经常出现供肝体积过大的问题,研究表明,对于儿童肝移植来说,移植物体重比(GRWR)在2%-4%之间,受者预后较为良好,并发症明显少于对照组[4]。为了维持GRWR在合理范围内,对供肝进行减体积或者行单段肝移植有时就成为必要措施。因此,术前对供者肝脏体积进行精确的评估与计算显得极为重要。笔者所在中心引进国际先进的影像学评估软件IQQA-Liver 3D系统,对供者肝脏体积、肝内外血管走行进行精确计算与显示,并能在术前模拟切除手术,精确计算供肝体积及残余肝体积(图 1-3)。与传统CT三维重建的计算结果相比,该系统对供肝体积的计算结果以及肝内外血管走行的三维重建,与术中实际所见较为接近,可作为术前供肝体积评估的可靠依据。对于受者,使用该系统也能对受者的病肝进行体积计算,结合受体CT前后径径线。间接反映肝窝空间大小,选择大小合适的供肝(图 4)。
|
图 1 全肝三维重建及左外叶分割 |
|
图 2 单Ⅱ段移植物分割 |
|
图 3 各肝段体积计算 |
|
图 4 受体肝窝前后径线测定及病肝体积计算 |
供肝脂肪变性不仅与移植肝术后无功能相关,而且会加重肝脏缺血-再灌注损伤,影响术后肝细胞再生[5]。因此,脂肪肝会同时增加供者和受者的手术风险,在计算GRWR时应考虑到这一点[6]。对肝脏脂肪变性程度的评估最为准确的是供肝穿刺活检,但该方法为有创操作,应用受到限制,目前主要根据供者的CT值和体重指数(BMI)进行评估。肝脏CT值<50、肝脾CT值比值的倒置常表示肝脏存在脂肪浸润,脂肪变性的程度与CT值数值呈负相关。有研究显示,肝脏脂肪变性程度与供者BMI呈线性相关[7],BMI<25的供者基本可排除严重的脂肪变性,可不予穿刺活检,但对于BMI>28 kg/m2的供者,影像学方法对其肝脏脂肪变性程度的评估便不再敏感,有必要进行穿刺活检。过度肥胖的潜在供者能否作为供肝者一直存在争议,一个较为安全可靠的方法就是在有限的时间内,鼓励供者通过运动和节食进行减重,尽可能降低BMI,可有效降低脂肪肝相关的手术风险。
2 受者的术前评估 2.1 适应证目前国际上儿童肝移植适应证以先天性及代谢性疾病为主,包括胆道闭锁、Alagille综合征、Wilson病、囊性纤维化、自身免疫性肝病以及肝脏恶性肿瘤等。其中,胆道闭锁是儿童肝移植最主要的适应证,美国儿童肝移植学组(SPLIT)统计的儿童肝移植适应证列表详见表 2,国内儿童肝移植适应证疾病谱基本与此类似。患者通常在出生后8到10周内及时接受肝门空肠吻合术(Kasai术),可以使部分患者免于肝脏移植手术。Kasai术后并发症包括反复发作的胆管炎、门静脉高压以及胆汁引流不畅等,这些都可作为儿童肝移植的适应证,尤其是反复发作的胆管炎,即使没有并发肝功能的失代偿,亦可行肝移植术以改善其生存状态。80%的胆道闭锁患者都在20岁之前接受了肝移植手术,其中大部分患儿在4岁以前就不得不接受肝移植治疗。因此,Kasai术可作为胆道闭锁的初步处理手段,如果术后血清总胆红素依然居高不下,应立即进行肝移植评估。对于遗传代谢性疾病患儿,还应增加家庭遗传背景的评估筛查,避免隐性基因携带者作为供者捐献。
| 表 2 SPLIT 2 445例儿童肝移植适应证占比 |
由于供肝的缺乏以及活体供者的手术风险,对儿童肝移植受者的评估显得尤为谨慎,术前应对严重影响受者预后的因素进行排除,以保障受者真正受益于肝移植手术。受者禁忌证主要包括晚期肝脏恶性肿瘤、肝外脏器的原发或转移恶性肿瘤、严重全身感染、严重的心肺功能不全、不可逆的神经系统损伤、淋巴组织细胞增生症等。
2.3 手术时机的选择肝移植手术时机的选择取决于肝脏原发病的种类。合适的时机应该为病情进展至肝移植手术能让患儿最大获益而又较少出现移植术后并发症的时刻。移植时患儿及疾病进展情况直接影响移植术后生存率。那些术前需要重症监护的患儿,尤其是需要呼吸支持或透析治疗的患儿,移植术后1年生存率显著下降。各种原因引起的急性肝功能障碍都需要立即进行肝移植手术;代谢性肝病如酪氨酸血症、枫糖尿症等,通常会导致包括神经系统在内的多个系统的严重症状,在确诊后尽早进行肝移植评估;儿童肝脏恶性肿瘤较为少见,主要包括肝母细胞瘤和肝细胞肝癌,都需尽早进行肝移植术前评估。
胆道闭锁作为儿童肝移植最主要的适应证,在接受Kasai术后3个月内血清总胆红素水平持续超过6 mg/dl时,患者2年生存率仅为16%。该部分患者应及时进行肝移植术前评估。对于未接受Kasai术的胆道闭锁患者,当血清总胆红素水平达到2-6 mg/dl时就应进行肝移植评估[8]。但是,胆红素水平并不是判断肝移植时机的唯一指标,与肝脏原发疾病相关的症状,如生长发育迟缓、体重增长缓慢、消化道出血、大量腹水、反复发作的胆管炎、出血倾向以及肝性脑病等,都是实施肝移植的重要参考因素。这些因素中,对肝移植手术风险影响较大的主要是患者体重,根据我中心之前的研究,受者体重大于7.5 kg、相应年龄达到1岁左右时,可大大提高受者的生存率[9]。因此,在患者条件允许的情况下,可适当延长等待时间,尽量多地增加受者体重。
2.4 营养状况评估肝病儿童通常伴有营养不良的状况,吸收障碍和体内高代谢状态导致这些患者比正常儿童的能量需求高出20%-80%,术前进行营养支持的干预能够改善受者的术后生存状态[10]。营养状况的评估方法主要包括体重、肱三头肌内侧皮肤褶皱厚度以及上臂周长的测量。多数患有胆汁淤积症婴儿伴有由于胆汁排泄障碍导致的脂肪和脂溶性维生素吸收障碍。脂溶性维生素缺乏会引起一系列的并发症,如佝偻病、骨折、凝血障碍和视觉障碍。通过口服复合脂溶性维生素液体制剂能够补充相关缺乏维生素。尽管这些复合制剂是非常安全的,但是在对胆道闭锁患儿的研究中,仍然发现在补充复合脂溶性维生素患儿中仍存在脂溶性维生素缺乏。因此,应该考虑实施个体化的脂溶性维生素补充方案[11, 12]。
2.5 心肺功能评估肝肺综合征和肺动脉高压是影响肝移植受者预后的重要因素。静息状态下血氧饱和度的测定是肝肺综合征的筛查方法之一,氧饱和度低于97%的患者需进一步检查以排除肝肺综合征;肺动脉高压一般可以通过胸片、心电图、心脏多普勒超声进行测算。肝肺综合征肺高压定义为静息状态下平均肺动脉压大于25 mmHg。严重的肝肺综合征患者肺动脉压力可大于50 mmHg,心肺并发症死亡率高达100%[13]。此外,右心压力过度升高不仅可能影响移植物的灌注,也可能因心功能不佳而无法耐受手术[14]。
2.6 受体肝脏解剖学评估受体术前影像资料对评估肝脏解剖变异具有重要参考意义,评估内容包括肝脏总体积、肝内外血管走行及位置、肝动脉及门静脉血流方向和血流速度等。如前所述,腹围和病肝体积决定了患者腹腔内的可容纳空间,可影响供肝的植入及腹腔关闭;肝静脉与腔静脉汇合处的解剖关系可为供肝流出道的整形与重建提供参考;门静脉管腔直径、血流方向与流速、有无附壁血栓等因素与术中门静脉重建方式以及术后门静脉血栓形成关系密切,应给予充分的术前评估并制定相应预案。
上海交通大学医学院附属仁济医院肝脏外科自2006年起,至今已完成600余例儿童肝移植手术,术后5年生存率超过80%,其中绝大部分儿童受者年龄均小于2岁[15]。在对这些低龄、低体重患者实施肝移植的过程中,我们发现,婴幼儿活体肝移植在手术技术和术后管理方面更具挑战性,如供肝体积的匹配、血管并发症、感染等。因此,儿童活体肝移植手术对供受体术前评估均提出了更高的要求。在此基础上,我们对儿童活体肝移植供受者术前的评估要点进行了简单总结,对于其中的不足之处,仍需进一步探索和完善。
| [1] | SPLIT Research Group. Studies of Pediatric Liver Transplantation (SPLIT):year 2000 outcomes[J]. Transplantation, 2001, 72(3): 463-476. DOI: 10.1097/00007890-200108150-00018. |
| [2] | Ng VL, Fecteau A, Shepherd R, et al. Outcomes of 5-year survivors of pediatric liver transplantation: report on 461 children from a North American multicenter registry[J]. Pediatrics, 2008, 122: e1 128-e1 135. DOI: 10.1542/peds.2008-1363. |
| [3] | Shirabe K, Shimada M, Gion T, et al. Postoperative liver failure after major hepatic resection for hepatocellular carcinoma in the modern era with special reference to remnant liver volume[J]. J Am Coll Surg, 1999, 188(3): 304-309. DOI: 10.1016/S1072-7515(98)00301-9. |
| [4] | Kasahara M, Sakamoto S, Umeshita K, et al. Effect of graft size matching on pediatric living-donor liver transplantation in Japan[J]. Exp Clin Transplant, 2014, 12(Suppl 1): 1-4. DOI: 10.6002/ect. |
| [5] | Marsman WA, Wiesner RH, Rodriguez L, et al. Use of fatty donor liver is associated with diminished early patient and graft survival[J]. Transplantation, 1996, 62(9): 1 246-1 251. DOI: 10.1097/00007890-199611150-00011. |
| [6] | Marcos A, Fisher RA, Ham JM, et al. Liver regeneration and function in donor and recipient after right lobe adult to adult living donor liver transplantation[J]. Transplantation, 2000, 69(7): 1 375-1 379. DOI: 10.1097/00007890-200004150-00028. |
| [7] | Rinella ME, Alonso E, Rao S, et al. Body mass index as a predictor of hepatic steatosis in living liver donors[J]. Liver Transpl, 2001, 7(5): 409-414. DOI: 10.1053/jlts.2001.23787. |
| [8] | Squires RH, Ng V, Romero R, et al. Evaluation of the pediatric patient for liver transplantation: 2014 practice guideline by the American Association for the Study of Liver Diseases, American Society of Transplantation and the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition[J]. J Pediatr Gastroenterol Nutr, 2014, 59(1): 112-131. DOI: 10.1097/MPG.0000000000000431. |
| [9] | 朱建军, 夏强. 体重对婴幼儿活体肝移植预后的影响[J]. 肝胆外科杂志, 2011, 19(3): 184-186. |
| [10] | Nightingale S, Ng VL. Optimizing nutritional management in children with chronic liver disease[J]. Pediatr Clin North Am, 2009, 56(5): 1 161-1 183. DOI: 10.1016/j.pcl.2009.06.005. |
| [11] | Shneider BL, Magee JC, Bezerra JA, et al. Efficacy of Fat-Soluble Vitamin Supplementation in Infants With Biliary Atresia[J]. Pediatrics, 2012, 130(3): e607-e614. DOI: 10.1542/peds.2011-1423. |
| [12] | Shen YM, Wu JF, Hsu HY, et al. A pilot study of an oral absorbable fat-soluble vitamin formulation in pediatric patients with cholestasis[J]. J Pediatr Gastroenterol Nutr, 2012, 55(5): 587-591. DOI: 10.1097/MPG.0b013e31825c9732. |
| [13] | Krowka MJ, Plevak DJ, Findlay JY, et al. Pulmonary hemodynamics and perioperative cardiopulmonary-related mortality in patients with portopulmonary hypertension undergoing liver transplantation[J]. Liver Transpl, 2000, 6(4): 443-450. DOI: 10.1053/jlts.2000.6356. |
| [14] | Mandell MS, Lindenfeld J, Tsou MY, et al. Cardiac evaluation of liver transplant candidates[J]. World J Gastroenterol, 2008, 14(22): 3 445-3 451. DOI: 10.3748/wjg.14.3445. |
| [15] | Wan P, Li Q, Zhang J, et al. Influence of graft size matching on outcomes of infantile living donor liver transplantation[J]. Pediatr Transplant, 2015, 19(8): 880-887. DOI: 10.1111/petr.12592. |
 2016, Vol. 37
2016, Vol. 37

