细胞缺氧应激是心脏疾病发展过程中的一个共同病理基础[1]。在心肌缺血、缺血再灌注损伤、心肌肥厚、心衰等病程中都观察到反应活性氧增加现象[2]。研究发现反应活性氧短时间低浓度的增加,可氧化修饰细胞内钙离子通道与钙泵,重建胞内钙稳态,使细胞增强对氧化压力的承受力[3]。但心室肌组织中不同部位的心肌细胞对氧化应激的反应性可能不同,目前尚未见这方面的研究报道。本实验采用体外给予可自由通过细胞膜的过氧化氢(H2O2)来模拟体内反应活性氧增加, 探讨100 μmol/L H2O2暴露对内外膜心室肌细胞收缩和钙瞬变的影响差异性。
1 材料与方法 1.1 材料C57/BL6雄性小鼠,6-8周龄,购于武汉大学医学部实验动物中心。荧光染料fura-2 AM购于InvitrogenTM公司,溶解在二甲基亚砜(DMSO)中, 分装保存于-20 ℃冰箱内。H2O2配置浓度为100 μmol/L。单细胞收缩功能及钙瞬变检测系统购买于美国IonOptix公司。
1.2 试剂KB液(mmol/L):K-glutamate 100, KCl 25, KH2PO410, MgSO41, Glucose 22, EGTA 0.5, HEPES5, 用KOH将pH调至7.2。KR液(mmol/L):NaCl 35, KCl 4.75, KH2PO4 1.19, Na2HPO4·12H2O 16, Sucrose 134, NaHCO3 25, Glucose·H2O 10, HEPES 10。台式液(mmol/L):NaCl 137, KCl 5.4, MgCl2·6H2O 1.2, HEPES 10, Glucose·H2O 10, Na2HPO4·12H2O 1.2, CaCl 1.8, 用NaOH将pH调至7.4。
1.3 内、外膜心肌细胞的分离戊巴比妥钠加肝素钠(1 000个单位)腹腔注射麻醉小鼠。开胸取出心脏,置于预热至37 ℃并氧合5 min的KR液中。主动脉插管结扎后将心脏悬挂与Langendorff灌流系统[4],KR液加0.8 mg/ml的胶原酶灌流15 min后取下心脏,用小镊子撕取左心室内膜心肌组织和外膜心肌组织,剪碎,过滤,溶于台氏液中,即分别得到内膜心肌细胞和外膜心肌细胞悬浮液。
1.4 H2O2对内、外膜心肌细胞肌小节收缩功能及胞内钙瞬变的影响取1.5 μmol/L fura-2 AM加入1.5 ml内膜心肌细胞悬浮液中,室温下避光静置20 min后弃上清液,台氏液洗涤细胞2次后,将细胞悬液移入灌流槽中,待细胞吸附后,选取边缘干净,横纹肌清晰,跟随外界电刺激频率稳定收缩的心肌细胞成像于电脑显示屏,并用台氏液持续灌流,调节荧光检测窗口使之与细胞边缘重合,选择胞内清晰的6-8个肌小节,实时同步检测肌小节收缩功能及细胞内钙瞬变。然后将灌流液更换为含有100 μmol/L H2O2的台式液持续灌流1 min,再更换为台氏液,实时检测H2O2对内膜心肌细胞肌小节收缩和胞内钙瞬变的影响。
1.5 数据的读取肌小节收缩图形的振幅反映肌小节收缩力。钙瞬变图形的基线值反映心肌细胞舒张期胞质内钙浓度,即肌浆网自发的钙释放;钙瞬变图形的振幅反映心肌细胞收缩期胞质内钙浓度,即钙触发的肌浆网钙释放。
1.6 统计学方法所有实验数据以x±s表示,采用SPSS软件,行t检验分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 内、外膜心肌细胞钙瞬变的跨膜差异性我们统计了来自6只C57/BL6小鼠左心室的22个内膜心肌细胞和26个外膜心肌细胞,在电刺激频率为1 Hz, 台氏液灌流,未接触H2O2情况下,内、外膜心肌细胞自身的钙瞬变差异,发现内膜心肌细胞的钙瞬变振幅(F340/380)(0.241±0.014)显著大于外膜心肌细胞钙瞬变振幅(0.203±0.011)(P < 0.05),即内膜心肌细胞钙触发的钙释放大于外膜心肌细胞。且内膜心肌细胞钙瞬变基线值(F340/380)(0.521±0.023)显著大于外膜心肌细胞的(0.466±0.022)(P < 0.05, 表 1),即内膜心肌细胞舒张期钙浓度,反映肌浆网自发的钙释放也大于外膜心肌细胞。图 1展示了典型的正常内外膜心肌细胞钙瞬变。
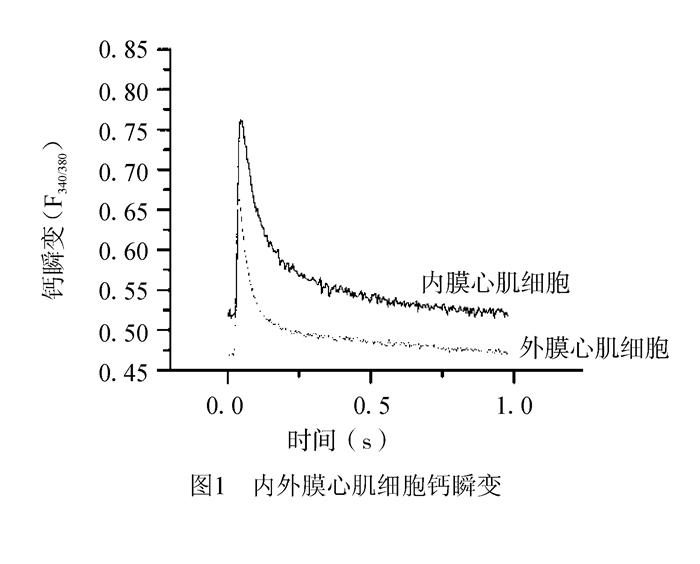
|
图 1 内外膜心肌细胞钙瞬变 |
| 表 1 内外膜心肌细胞钙瞬变比较 |
图 2显示了H2O2灌流前和100 μmol/L H2O2灌流1 min后不同时间点内膜心肌细胞肌小节收缩以及胞内钙瞬的变化。1 min时肌小节收缩幅度增加到最大,并且增加幅度能保持到7 min以上。胞内钙瞬变的变化与肌小节收缩幅度的变化相同步。对照组心肌细胞肌小节收缩和胞内钙瞬变随时间未发生变化。
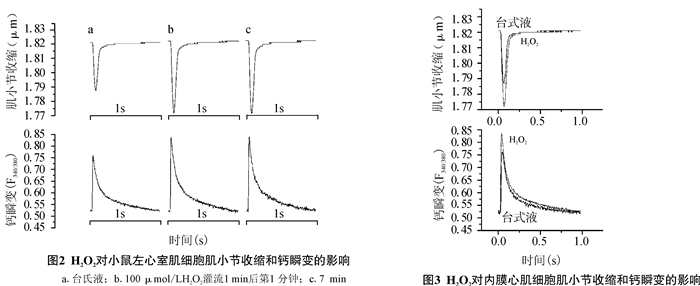
|
图 2 H2O2对小鼠左心室心肌细胞肌小节收缩和钙瞬变的影响 a.台式液; b.100 μmol/LH2O2灌流1 min后第1分钟; c.7 min |
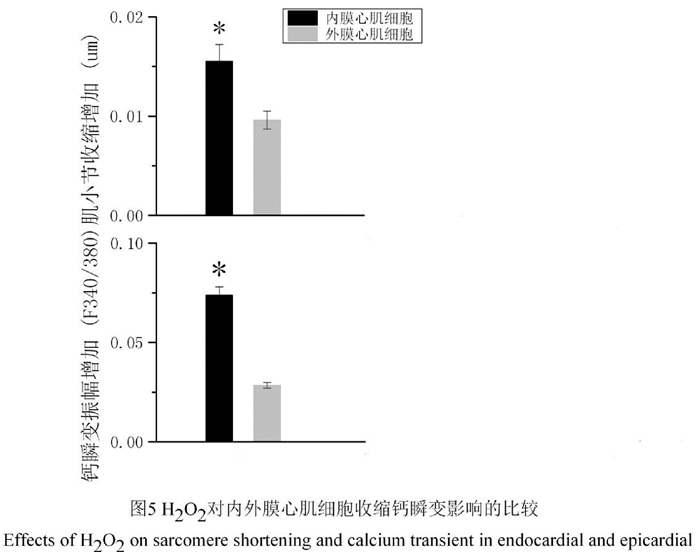
我们统计了来自3只C57/BL6小鼠左心室的10个内膜心肌细胞和12个外膜心肌细胞的数据。图 3和图 4分别展示了典型的内膜心肌细胞和外膜心肌细胞在H2O2灌流前和灌流1 min后肌小节收缩和胞内钙瞬变图形。统计分析显示,100 μmol/L H2O2暴露1 min可使内膜心肌细胞肌小节收缩幅度增加(0.015 5±0.001 7)μm, 显著大于外膜心肌细胞的增加幅度(0.009 6±0.000 9)μm (P<0.05)。与肌小节收缩幅度的增加相似,H2O2使内膜心肌细胞钙瞬变幅度(F340/380)增加了0.073 7±0.004 3,明显高于外膜心肌细胞的增加幅度0.028 4±0.001 4(P < 0.05,图 5)。
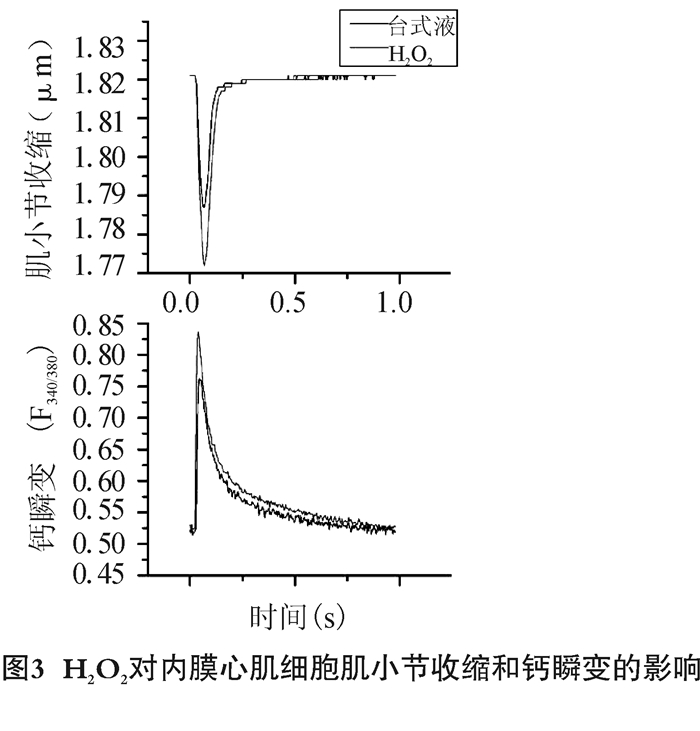
|
图 3 H2O2对内膜心肌细胞肌小节收缩和钙瞬变的影响 |
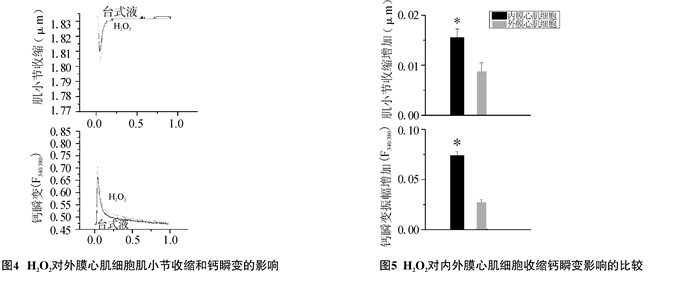
|
图 4 H2O2对外膜心肌细胞肌小节收缩和钙瞬变的影响 |
|
图 5 H2O2对内外膜心肌细胞收缩钙瞬变影响的比较 |
细胞特性的跨膜梯度在生物组织中很常见。低浓度的反应活性氧,可逆地与细胞内钙离子通道和泵结合,重建胞内钙稳态,使细胞对氧化压力的承受能力代偿性增强[3]。而高浓度的反应活性氧,可以引起细胞内蛋白质、DNA等各种生物大分子不可逆的氧化改变,甚至破坏脂质双分子层,损伤细胞的正常生物结构和功能。氧化应激对细胞功能影响的这种双向性取决于其浓度和作用时间[5],有关氧化应激影响心肌收缩和钙瞬变及引起心律失常的研究已有一些报道[6, 7]。而氧化应激对不同部位心室肌细胞作用的差异性还未见报道。本实验首次研究了内膜和外膜心室肌细胞的收缩功能及钙瞬变对氧化应激的不同反应。我们分离了小鼠左心室内、外膜心肌细胞,检测了台氏液灌流时内、外膜心肌细胞钙瞬变的跨膜梯度,发现内膜心肌细胞肌织网自发的钙释放和钙触发的钙释放都大于外膜心肌细胞,这与内膜心肌细胞比外膜心肌细胞有更多的肌浆网雷诺丁受体的报道相一致[8]。同时,我们观察了100 μmol/L H2O2暴露1 min心肌细胞肌小节收缩和胞内钙浓度的变化,发现肌小节收缩幅度和胞内钙瞬变振幅均增加,并且这种增加幅度在H2O2被撤销后的很长一段时间仍保持。这种H2O2撤除后钙瞬变增加仍维持的现象,可能是由于瞬间的H2O2暴露引起了细胞线粒体内活性氧释放增加[9]。我们首次发现,低浓度H2O2使内膜心肌细胞胞内钙瞬变幅度的增加显著大于外膜心肌细胞,即内膜心肌细胞收缩期肌浆网的钙释放大于外膜心肌细胞。同时,H2O2引起的内膜心肌细胞肌小节收缩幅度增加同样也大于外膜心肌细胞,而且肌小节收缩幅度的增加与钙瞬变的幅度的增加相一致。提示,H2O2引起的细胞胞内钙瞬变的增加可能是导致心肌收缩力增强的主要原因。H2O2通过氧化修饰肌浆网雷诺丁受体增强其钙释放[10],而内膜心肌细胞肌浆网上的雷诺丁受体是外膜心肌细胞的2倍[8],这可能是内膜心肌细胞胞内钙的增加大于外膜心肌细胞的原因。但是本实验中H2O2只引起了收缩期钙瞬变振幅的增加,而舒张期钙浓度并未增加,说明100 μmol/L H2O2只引起了钙触发的收缩期钙释放增加,而不引起舒张期肌浆网自发的钙释放增加。
从我们的研究结果中可以得出结论:正常心室内膜心肌细胞较外膜心肌细胞对氧化应激有更高的反应性;在氧化应激时心肌细胞肌浆网钙释放增加使心肌收缩力增强,而内膜心肌细胞在心室肌的这一正性变力反应中起到关键性作用。
| [1] | Lüscher TF. Ageing, inflammation, and oxidative stress: final common pathways of cardiovascular disease[J]. Eur Heart J, 2015, 36(48): 3381-3383. DOI: 10.1093/eurheartj/ehv679. |
| [2] | Tsutsui H, Kinugawa S, Matsushima S. Oxidative stress and heart failure[J]. Am J Physiol Heart Circ Physiol, 2011, 301(6): H2181-H2190. DOI: 10.1152/ajpheart.00554.2011. |
| [3] | Sharov VS, Schöeneich C. Oxidative Modification of Ca2+ Channels, Ryanodine Receptors, and the Sarco/Endoplasmic Reticulum Ca2+-ATPase[J]. Free Radical Effects on Membranes, 2008, 61: 113-130. DOI: 10.1016/S1063-5823(08)00206-8. |
| [4] | Liao R, Podesser BK, Lim CC. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping[J]. Am J Physiol Heart Circ Physiol, 2012, 303(2): H156-H167. DOI: 10.1152/ajpheart.00333.2012. |
| [5] | Yan Y, Liu J, Wei CL. Bidirectional regulation of Ca2+ sparks by mitochondria-derived reactive oxygen species in cardiac myocytes[J]. Cardiovasc Res, 2008, 77(2): 432-441. |
| [6] | Kuster GM, Lancel S, Zhang J. Redox-mediated reciprocal regulation of SERCA and Na+-Ca2+ exchanger contributes to sarcoplasmic reticulum Ca2+ depletion in cardiac myocytes[J]. Free Radic Biol Med, 2010, 48(9): 1182-1187. DOI: 10.1016/j.freeradbiomed.2010.01.038. |
| [7] | Li W, Wang Y, Gao L. Resveratrol protects rabbit ventricular myocytes against oxidative stress-induced arrhythmogenic activity and Ca2+ overload[J]. Acta Pharmacol Sin, 2013, 34: 1164-1173. DOI: 10.1038/aps.2013.82. |
| [8] | Dilly KW, Rossow CF, Votaw VS, et al. Mechanisms underlying variations in excitation-contraction coupling across the mouse left ventricular free wall[J]. J Physiol, 2006, 572: 227-241. DOI: 10.1113/jphysiol.2005.102020. |
| [9] | Viola HM, Hool LC. Qo site of mitochondrial complex III is the source of increased superoxide after transient exposure to hydrogen peroxide[J]. J Mol Cell Cardiol, 2010, 49(5): 875-885. DOI: 10.1016/j.yjmcc.2010.07.015. |
| [10] | Oda T, Yang Y, Uchinoumi H, et al. Oxidation of ryanodine receptor (RyR) and calmodulin enhance Ca release and pathologically alter, RyR structure and calmodulin affinity[J]. J Mol Cell Cardiol, 2015, 85: 240-248. DOI: 10.1016/j.yjmcc.2015.06.009. |
 2016, Vol. 37
2016, Vol. 37

