2. 武汉大学中南医院 呼吸内科 湖北 武汉 430071
2. Dept. of Respiratory Medicine, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
气道重塑是具有慢性持续性症状的哮喘患者的重要特征[1],其发生机制包括气道平滑肌细胞增生,上皮下纤维化[2]等过程。这些变化导致不可逆性气流受限,对支气管扩张剂和激素的治疗反应较差。上皮下纤维化主要与上皮下胶原纤维的沉积有关,这些胶原纤维主要由成纤维细胞分泌[2]。目前认为,成纤维细胞的来源主要包括肺成纤维细胞的增殖和上皮-间充质细胞的转化。近来研究发现,外周血循环纤维细胞募集至气道上皮下,并在此分化至成纤维细胞及肌成纤维细胞也是气道上皮下纤维化的重要机制[3]。
循环纤维细胞是骨髓来源的前体细胞,表达造血细胞前体标志物CD45和CD34,同时这些细胞也分泌Ⅰ型胶原[4]。因此,常用CD45+Col Ⅰ+细胞作为循环纤维细胞的分化标志[5]。近年来已有研究证实,循环纤维细胞参与了哮喘气道重塑过程。在慢性气流受限的哮喘患者外周血中循环纤维细胞的比例上调[6],且与哮喘严重程度及糖皮质激素敏感性下降相关[7, 8];同时,哮喘患者急性发作期循环纤维细胞的比例亦高于缓解期[9]。
血清淀粉样蛋白P(serum amyloid P, SAP)是五聚体蛋白家族成员,在体内作为循环纤维细胞的天然抑制因子,可以抑制纤维细胞的分化成熟[10]。在哮喘患者体内,SAP水平是否发生变化,其与循环纤维细胞的比例的相关性如何尚未见报道。本文收集哮喘患者和健康志愿者外周血,分析SAP水平和循环纤维细胞比例在两组间的差异,并分析哮喘患者体内两者的相关性。
1 材料与方法 1.1 研究对象哮喘患者招募自武汉大学中南医院呼吸内科门诊及住院患者,健康志愿者招募自武汉大学医学部。纳入标准参照我们既往研究[11]。所有研究对象均签署知情同意书,并按要求体描法测定肺功能,其中健康志愿者肺功能要求在正常范围内。哮喘患者在研究前4周容许使用吸入性而非全身性糖皮质激素。哮喘的诊断按照全球哮喘防治创议(GINA)标准,同时皮肤点刺试验阳性。2组患者均要求非吸烟,无其他过敏性疾病史,研究前2月内无上、下呼吸道感染史,过去5年内无慢性心肺疾患史,未接受过免疫治疗。
1.2 外周血单个核细胞(peripheral blood mononuclear cells, PBMC)的分离每个研究对象抽取外周血15 ml,肝素化后用等量PBS稀释,稀释的血液置于等体积淋巴细胞分离液(Lymphoprep,购自Nycomed)之上,2 000 r/min室温下离心20 min。收集PBMC, 并用PBS洗涤2次。收集血清,保存在-20 ℃,用于SAP检测。
1.3 流式细胞术检测PBMC循环纤维细胞比例PBMC中CD45+Col Ⅰ+细胞被认为是循环纤维细胞。分离的PBMC用PE标记的抗人CD45抗体(Abcam,美国)在4 ℃孵育40 min,洗涤后,细胞用固定液(eBioscience,美国)固定,并在室温下孵育20 min。细胞破膜,并与抗人Ⅰ型胶原抗体(Abcam,美国)4 ℃避光孵育过夜。洗涤后,细胞用FITC标记的抗IgG抗体(Abcam,美国)4 ℃避光孵育40 min。细胞用PBS重悬,并用流式细胞仪(Epics Altra,Beckman,美国)进行分析。结果以双染阳性细胞的百分比表示。
1.4 SAP检测健康志愿者和哮喘患者血清中SAP含量用ELISA试剂盒(Hycult Biotech,荷兰)进行检测,具体试验方法参照使用说明书。最小检测浓度是0.5 ng/ml。所有样本均设置复孔检测两次。
1.5 统计学分析所有数据均用SPSS 19.0软件进行分析。数据均以均数±标准差表示,用t检验或方差分析进行统计。P<0.05为差异有统计学意义。
2 结果 2.1 研究对象一般特征11例健康志愿者和15例哮喘患者入选。研究对象的一般资料(见表 1) 可见,哮喘患者的第1秒用力呼气量(FEV1占预计值的百分比)平均为(84±17)%,明显低于健康志愿者的(101±42)% (P<0.05)。
| 表 1 健康对照组和哮喘组临床特征比较 |
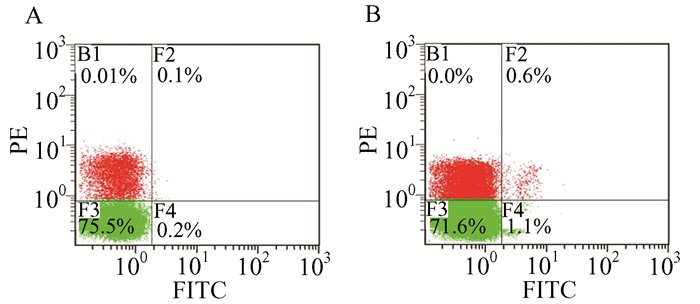
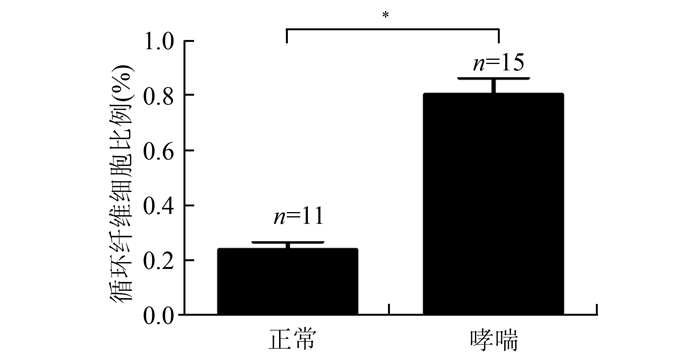
图 1为典型的流式细胞仪检测图,流式细胞仪分析结果显示,15例哮喘患者PBMC中CD45+ColⅠ+细胞的百分比是(0.8± 0.06)%,明显高于11例健康志愿者PBMC中CD45+ColⅠ+细胞百分比的平均值(0.23± 0.03)% (P<0.05)(见图 2)。
|
图 1 正常人和哮喘患者PBMC中循环纤维细胞的流式细胞仪检测结果 A:正常人;B:哮喘患者;PE标记的CD45抗体和FITC标记的ColⅠ抗体分别孵育,检测CD45+Col Ⅰ+细胞比例(%)。图示为代表性图 |
|
图 2 正常人和哮喘患者PBMC中循环纤维细胞比例 与正常组相比,*P<0.05 |
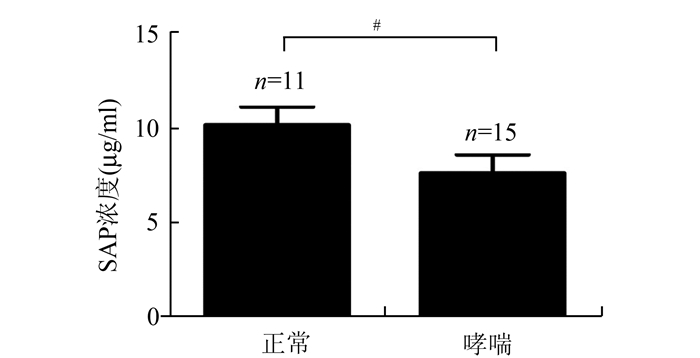
SAP是循环纤维细胞分化的天然抑制因子。ELISA检测结果显示,健康志愿者血清SAP含量平均为(10.10±0.97)μg/ml,显著高于哮喘患者的血清SAP平均浓度(7.60±0.98)μg/ml(P<0.05)。
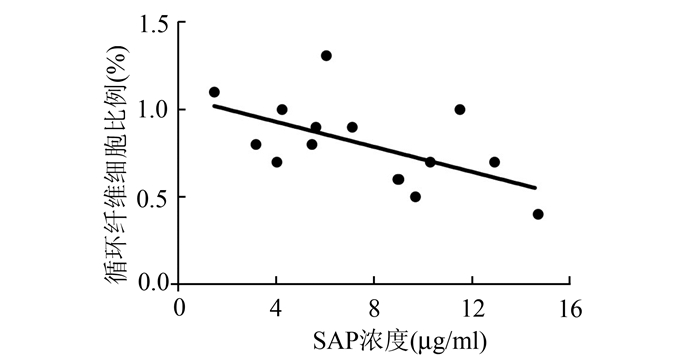
2.4 哮喘患者血清SAP浓度与循环纤维细胞比例的相关性对15例哮喘患者血清SAP浓度与外周血单个核细胞中CD45+Col Ⅰ+细胞的百分比进行相关分析,结果显示两者呈负相关(r=-0.566),具有统计学差异(P<0.05)(图 4)。这些数据表明,哮喘患者血清SAP浓度下降可能是循环纤维细胞比例增加的重要因素。
|
图 3 正常人和哮喘患者血清中SAP浓度 与正常组相比,#P<0.05 |
|
图 4 哮喘患者PBMC中循环纤维细胞比例与血清中SAP浓度的相关性分析 |
循环纤维细胞参与了哮喘的气道重塑过程,是肺内成纤维细胞的重要来源之一。既往研究已经证实,在有慢性气流受限的哮喘患者体内循环纤维细胞的比例上升[6],但在无气流受限的哮喘患者,其比例上升不显著;同时,在哮喘急性发作期循环纤维细胞的比例也较缓解期明显上升[9]。另有研究指出,循环纤维细胞可以通过趋化因子的募集作用进入肺内,通过介导纤维增生、分泌机基质蛋白、分化为成纤维细胞、浸润至气道平滑肌束[12]等多种途径参与哮喘上皮下纤维化过程,促进气道重塑。在本研究中,我们观察到哮喘患者体内循环纤维细胞的比例较正常人明显升高,与既往研究结果一致。尽管15例哮喘患者并未按气流受限可逆性进行分组,但依然发现外周血循环纤维细胞比例上升,我们推测与其中部分哮喘患者具有不可逆气流受限,且绝大部分患者因急性发作就诊而被纳入研究有关。
SAP是循环纤维细胞的天然抑制因子,可以抑制循环纤维细胞的分化。SAP浓度下降可见于多种纤维化性疾病,如肝脏、心脏、肾脏和肺纤维化[13, 14]。既往的研究证实,SAP能够通过FcgR信号途径,使胞内ITAM(immunoreceptor tyrosine activation motifs)区域磷酸化,进而抑制单核细胞向循环纤维细胞分化[15]。最近有研究证实,重组的外源性SAP可以有效改善肺纤维化的病理过程,延缓疾病进展[16]。据此,我们试图探讨在哮喘患者体内SAP浓度变化及其与循环纤维细胞比例上调的相关性。
我们的研究结果证实,哮喘患者体内循环纤维细胞比例上调,而血清SAP浓度下降,说明哮喘患者体内SAP水平的变化可能与循环纤维细胞含量增加相关;进一步的研究指出两者之间存在负相关性,提示SAP浓度下降很可能是造成哮喘患者体内循环纤维细胞增加的重要环节,与循环纤维细胞参与的上皮下纤维化及气道重塑过程密切相关,为进一步阐明哮喘气道重塑机制提供了重要依据。
但本研究纳入病例数有限,无法根据哮喘的严重程度分层分析SAP与循环纤维细胞的关系,这是本研究的局限性之一;另外,血清SAP浓度与气道上皮下纤维细胞比例和胶原含量之间的关系也需要进一步研究,将直接证实SAP是否抑制循环纤维细胞在气道上皮下的募集。另外,SAP浓度与哮喘急性发作的关系尚无文献报道;SAP能否作为哮喘急性发作及气道重塑的生物学标志需要进一步研究。补充外源性SAP能否减少哮喘循环纤维细胞比例,从而抑制上皮下纤维化和气道重塑过程也需要研究明确。
综上所述,哮喘患者体内循环纤维细胞比例上调,而SAP浓度下调,且两者之间呈负相关,提示SAP下调可能参与哮喘气道重塑过程,检查体内SAP浓度可能作为哮喘气道重塑的一个生物学标志。
| [1] | Holgate ST. Pathophysiology of asthma: what has our current understanding taught us about new therapeutic approaches[J]. J Allergy Clin Immunol, 2001, 128(3): 495-505. |
| [2] | Roche WR, Beasley R, Williams JH, et al. Subepithelial fibrosis in the bronchi of asthmatics[J]. Lancet, 1989, 1(8637): 520-524. |
| [3] | Bianchetti L, Marini MA, Isgro M, et al. IL-33 promotes the migration and proliferation of circulating fibrocytes from patients with allergen-exacerbated asthma[J]. Biochem Biophys Res Commun, 2012, 426(1): 116-121. DOI: 10.1016/j.bbrc.2012.08.047. |
| [4] | Reilkoff RA, Bucala R, Herzog EL. Fibrocytes: emerging effector cells in chronic inflammation[J]. Nat Rev Immunol, 2011, 11(6): 427-435. DOI: 10.1038/nri2990. |
| [5] | Bucala R, Spiegel LA, Chesney J, et al. Circulating fibrocytes define a new leukocyte subpopulation that mediates tissue repair[J]. Mol Med, 1994, 1(1): 71-81. |
| [6] | Wang CH, Huang CD, Lin HC, et al. Increased circulating fibrocytes in asthma with chronic airflow obstruction[J]. Am J Respir Crit Care Med, 2008, 178(6): 583-591. DOI: 10.1164/rccm.200710-1557OC. |
| [7] | Shipe R, Burdick MD, Strieter BA, et al. Number, activation, and differentiation of circulating fibrocytes correlate with asthma severity[J]. J Allergy Clin Immunol, 2016, 137(3): 750-757. DOI: 10.1016/j.jaci.2015.07.037. |
| [8] | Lo CY, Michaeloudes C, Bhavsar PK, et al. Increased phenotypic differentiation and reduced corticosteroid sensitivity of fibrocytes in severe asthma[J]. J Allergy Clin Immunol, 2015, 135(5): 1 186-1 195. DOI: 10.1016/j.jaci.2014.10.031. |
| [9] | Wang CH, Punde TH, Huang CD, et al. Fibrocyte trafficking in patients with chronic obstructive asthma and during an acute asthma exacerbation[J]. J Allergy Clin Immunol, 2015, 135(5): 1 154-1 162. DOI: 10.1016/j.jaci.2014.09.011. |
| [10] | Pilling D, Buckley CD, Salmon M, et al. Inhibition of fibrocyte differentiation by serum amyloid P[J]. J Immunol, 2003, 171(10): 5 537-5 546. DOI: 10.4049/jimmunol.171.10.5537. |
| [11] | Zhao Y, Yang J, Gao YD, et al. Th17 immunity in patients with allergic asthma[J]. Int Arch Allergy Immunol, 2010, 151(4): 297-307. DOI: 10.1159/000250438. |
| [12] | Saunders R, Siddiqui S, Kaur D, et al. Fibrocyte localization to the airway smooth muscle is a feature of asthma[J]. J Allergy Clin Immunol, 2009, 123(2): 376-384. DOI: 10.1016/j.jaci.2008.10.048. |
| [13] | Keeley EC, Mehrad B, Strieter RM. The role of fibrocytes in fibrotic diseases of the lungs and heart[J]. Fibrogenesis Tissue Repair, 2011, 4: 2. DOI: 10.1186/1755-1536-4-2. |
| [14] | Quan TE, Cowper SE, Bucala R. The role of circulating fibrocytes in fibrosis[J]. Curr Rheumatol Rep, 2006, 8(2): 145-150. DOI: 10.1007/s11926-006-0055-x. |
| [15] | Pilling D, Tucker NM, Gomer RH. Aggregated IgG inhibits the differentiation of human fibrocytes[J]. J Leukoc Biol, 2006, 79(6): 1 242-1 251. DOI: 10.1189/jlb.0805456. |
| [16] | van den Blink B, Dillingh MR, et al. Recombinant human pentraxin-2 therapy in patients with idiopathic pulmonary fibrosis: safety, pharmacokinetics and exploratory efficacy[J]. Eur Respir J, 2016, 47(3): 889-897. DOI: 10.1183/13993003.00850-2015. |
 2017, Vol. 38
2017, Vol. 38

