良性前列腺增生(benign prostatic hyperplasia,BPH)是指前列腺组织进行性增生压迫尿道、前列腺周围组织平滑肌张力增强致膀胱出口梗阻,出现尿频、尿急等排尿症状。BPH常见于老年男性,在60岁时发病率达50%,85岁时高达90%[1]。在中国,BPH患者已超过6 000万。目前,虽然BPH的一线治疗药物5α-还原酶抑制剂和α-受体阻滞剂能部分缓解BPH症状,但是它们仍有头晕、低血压、性功能障碍等副反应,并且约20%的患者仍需接受外科手术治疗。因此,阐明BPH的发病机制,寻找新的治疗靶点尤为重要。
上皮-间质转化(epithelial-mesenchymal transition,EMT)是指在特定细胞因子诱导下细胞由上皮细胞表型转化成间质细胞表型的过程,广泛地参与了多种生理和病理过程,包括胚胎发育、组织器官重塑、器官纤维化以及癌症的侵袭转移等。EMT的典型特征为上皮型钙黏蛋白(E-cadherin)等上皮细胞分子标记表达降低,而神经型钙黏蛋白(N-cadherin)、波形蛋白(vimentin)等间质细胞分子标记表达增高。近年来有研究发现[2],增生前列腺上皮细胞E-cadherin低表达,而N-cadherin和vimentin表达升高,提示EMT在BPH的发生中可能发挥着重要的作用。转化生长因子-β(transforming growth factor-β,TGF-β)可诱导EMT发生并且参与了BPH的发生。RhoA是Rho家族的重要成员,ROCK为RhoA的下游分子,有研究表明RhoA可能与TGF-β诱导的EMT发生有关。本实验拟了解RhoA/ROCK通路是否参与了增生前列腺上皮细胞的EMT发生,为治疗BPH提供新的靶点。
1 材料与方法 1.1 主要试剂及来源TGF-β1(R & D Systems,USA),ROCK特异性抑制剂Y-27632(Selleck Chemicals,USA),鼠抗RhoA单克隆抗体(Abcam,UK),兔抗E-cadherin单克隆抗体(CST,USA),兔抗N-cadherin单克隆抗体(CST,USA),兔抗vimentin单克隆抗体(CST,USA),鼠抗GAPDH单克隆抗体(Santa Cruz Biotechnology,USA),TRIzol总RNA提取试剂(Invitrogen,USA),cDNA第一链合成试剂盒(Thermo Scientific, China),SYBR荧光定量试剂盒(Takara Bio,China),RPMI-1640培养基(HyClone,China),胎牛血清(Gibco,Australia)
1.2 增生前列腺上皮细胞培养及给药BPH-1细胞的培养使用含有10%胎牛血清的RPMI-1640培养基,置于37 ℃含5%二氧化碳恒温培养箱。待细胞传2代后,0.25%胰酶消化,以3×105 /ml密度接种于6孔板中,次日待细胞贴壁后,换液,每孔加入2 ml培养基,其中一部分随机分为4组,均加入10 μg/L TGF-β1,分别于处理0,12,24,48 h后消化收取细胞。另一部分也随机分为4组:A组为对照组,B组加入10 μg/L TGF-β1,C组加入10 μg/L TGF-β1+10 μmol/L Y-27632,D组加入10 μmol/L Y-27632,处理48 h后消化收取细胞。
1.3 实时定量荧光PCR参照TRIzol试剂说明,提取所收集各组BPH-1细胞的总RNA,并置于-80 ℃冰箱保存。参照cDNA第一链合成试剂盒说明书,取1 μg总RNA用于逆转录cDNA,得到产物用于下一步的实时定量PCR反应。将1 μl cDNA,相应基因上下游引物(5 μmol/L)共2 μl,7 μl无菌水和10 μl SYBR荧光定量试剂混合,总体积20 μl置于Bio-Rad iCycler实时PCR系统中进行反应。PCR反应条件为95 ℃ 10 min(预变性);95 ℃ 30 s(变性),55 ℃ 30 s(退火),72 ℃ 30 s(延伸),共40个循环。2-ΔΔct法用于基因表达结果的分析,以GAPDH表达量作为内参。引物由上海生工有限公司合成,引物序列见表 1。
| 表 1 实时定量荧光PCR引物序列 |
提取所收集各组BPH-1细胞中的总蛋白,以BCA法进行蛋白定量。10% SDS-PAGE分离,电转印至聚偏二氟乙烯(PVDF)膜上,用含5%脱脂奶粉的TBST缓冲液室温封闭2 h,分别加入鼠抗RhoA单克隆抗体(1:2 000稀释),兔抗E-cadherin单克隆抗体(1:1 000稀释),兔抗N-cadherin单克隆抗体(1:1 000稀释),兔抗vimentin单克隆抗体(1:1 000稀释),鼠抗GAPDH单克隆抗体(1:2 000稀释),4 ℃孵育过夜;次日TBST漂洗3次,每次10 min,再加入相对应辣根过氧化物酶标记二抗,室温孵育2 h,TBST漂洗3次,每次10 min;用ECL化学发光试剂盒(Bio-Rad,USA)显影。Quantity One软件(Bio-Rad,USA)用于图像的定量分析。
1.5 统计学分析SPSS 19.0统计软件用于统计分析,各组实验数据以均数±标准差表示,采用独立样本t检验法,P<0.05为差异具有统计学意义。
2 结果 2.1 TGF-β诱导BPH-1细胞发生EMT随着TGF-β处理时间的延长,BPH-1细胞的上皮型分子标记E-cadherin的mRNA表达水平降低,而间质型分子标记N-cadherin和vimentin的mRNA表达水平逐渐升高。E-cadherin在给药12 h后表达即明显降低,处理48 h后表达降至0 h表达量一半。N-cadherin和vimentin的表达增高均在TGF-β处理24 h后较明显,处理48 h后达0 h表达量1.5倍以上(图 1)。
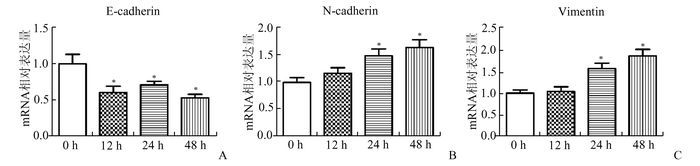
|
图 1 TGF-β诱导BPH-1细胞EMT相关分子标记mRNA表达 横坐标为TGF-β处理时间,纵坐标为相对表达量;A:E-cadherin;B:N-cadherin;C:vimentin;与0 h组相比,*P<0.05 |
伴随TGF-β诱导BPH-1细胞发生EMT,RhoA的表达逐渐升高。如图 2所示,RhoA的mRNA表达水平随TGF-β处理时间增加而逐渐升高,Western Blot的结果也在蛋白水平证实RhoA表达升高,与EMT相关分子标记的表达改变一致,提示RhoA可能参与了TGF-β诱导的BPH-1细胞的EMT发生。
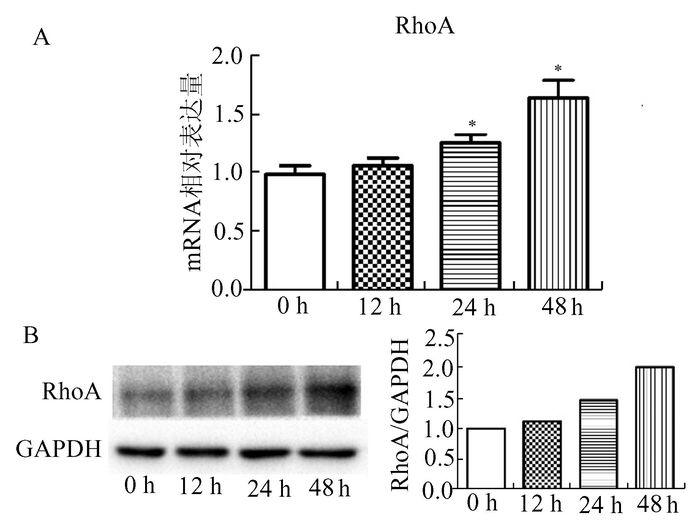
|
图 2 TGF-β处理不同时间BPH-1细胞RhoA的mRNA和蛋白表达 A:RhoA的mRNA表达,横坐标为TGF-β处理时间,纵坐标为相对表达量,与0 h组相比,*P<0.05;B:RhoA的蛋白表达,左图为Western Blot条带,右图为条带灰度分析 |
ROCK是RhoA的下游分子,特异性地受RhoA调控。Y-27632作为ROCK特异性的抑制剂能够阻断RhoA对下游通路的调控。如图 3、4所示,Y-27632能够不同程度地逆转TGF-β诱导的BPH-1细胞EMT相关分子标记mRNA和蛋白表达的改变。在mRNA水平,TGF-β和Y-27632共处理后E-cadherin表达较TGF-β处理后升高,而N-cadherin和vimentin的表达则呈现出相反的改变,但是三者的改变均未恢复至对照组水平,仅用Y-27632处理BPH-1细胞并未显著影响EMT相关分子标记的mRNA表达。Y-27632未能逆转TGF-β诱导的RhoA的mRNA表达升高。相关分子蛋白表达的改变与mRNA表达变化基本一致,Y-27632部分逆转了TGF-β引起的E-cadherin和N-cadherin的改变,但是并未能下调TGF-β诱导的vimentin表达升高。这些结果表明Y-27632能通过抑制RhoA下游分子部分逆转BPH-1细胞的EMT,进一步证实RhoA参与了TGF-β诱导的BPH-1细胞的EMT发生。
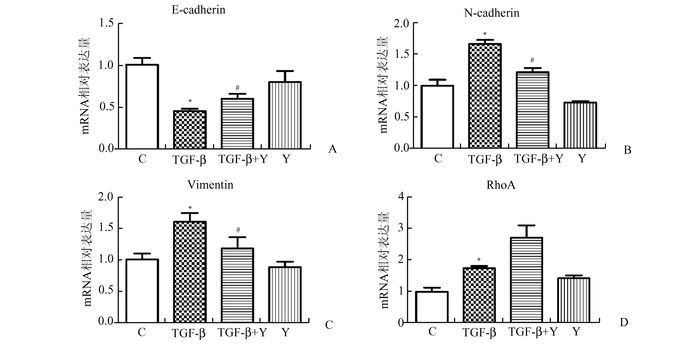
|
图 3 TGF-β和Y-27632处理BPH-1细胞后相关分子mRNA表达 横坐标为TGF-β相应处理组,纵坐标为相对表达量;C为对照组,TGF-β为TGF-β单独处理组,TGF-β+Y为TGF-β和Y27632共处理组,Y为Y27632单独处理组;A:E-cadherin;B:N-cadherin;C:vimentin;D:RhoA;与对照组相比,*P<0.05;与TGF-β单独处理组相比,# P<0.05 |
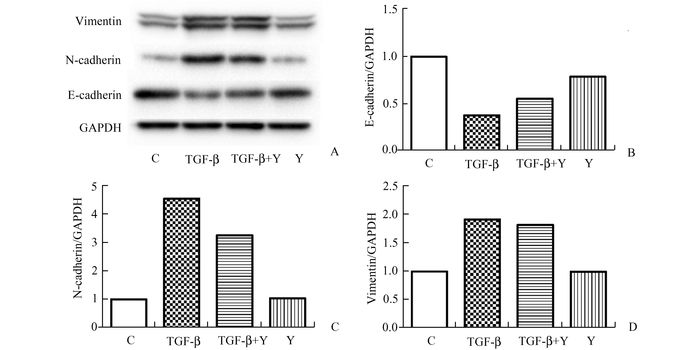
|
图 4 TGF-β和Y-27632处理BPH-1细胞后相关分子蛋白表达 C为对照组,TGF-β为TGF-β单独处理组,TGF-β+Y为TGF-β和Y27632共处理组,Y为Y27632单独处理组;A:各分子Western Blot条带;B,C,D:对应各分子条带灰度分析 |
虽然BPH在老年男性中有很高的发病率,但是其发生机制仍不清楚。目前认为年龄和有功能的睾丸与BPH的发生密切相关。此外,生长因子学说、上皮-间质相互作用学说、炎症学说、细胞凋亡与基因调控学说以及胚胎再唤醒学说等假说也从不同方面阐述了BPH的可能发生机制。近年来,有研究[3]指出EMT可能参与了BPH的发生。Alonso-Magdalena等[2]发现,手术切除的BPH组织腺上皮中,E-cadherin的表达明显减少而vimentin的表达增高,同时增生的腺上皮细胞失去极性呈纺锤型,提示BPH组织中存在EMT并且可能与TGF-β有关。Lu等[4]发现前列腺慢性炎症可导致前列腺发生EMT,进而导致前列腺间质细胞数量逐渐积累增多,导致以间质增生为特征的BPH发生。Alonso-Magdalena等[2]也认为BPH组织中间质细胞并无明显的细胞增殖,BPH组织中增生的间质主要来源于上皮细胞的转化。这些研究均提示EMT可能在BPH的发生中起重要作用。此外,有研究证实TGF-β可以诱导细胞发生EMT[5]。因此本研究使用TGF-β诱导增生前列腺上皮细胞系BPH-1发生EMT,用以研究其发生机制。本研究的结果表明,TGF-β诱导BPH-1细胞发生了EMT。且TGF-β处理时间越长,细胞的上皮表型逐渐丧失而间质表型越明显。
RhoA是Rho蛋白家族的一员,是一种具有GTP酶活性的小G蛋白分子,以结合GDP或GTP的方式发挥其功能。ROCK是RhoA代表性的下游分子,RhoA/ROCK通路广泛参与平滑肌收缩、组织纤维化以及细胞的迁移侵袭等病理生理过程。近期有研究指出[6],RhoA/ROCK通路可能参与了前列腺癌细胞EMT的发生与调控。除此之外,Zhang等[7]也观察到RhoA/ROCK通路参与了大鼠腹膜间皮细胞的EMT发生。本研究同样发现,在TGF-β诱导发生EMT的BPH-1细胞系中,伴随着E-cadherin的表达减少和N-cadherin、vimentin的表达增高,RhoA的表达升高。进一步的实验表明,ROCK特异性抑制剂Y-27632能够逆转TGF-β诱导的BPH-1细胞EMT。由于Y-27632仅能抑制ROCK及其下游分子,RhoA的表达升高并未被Y-27632逆转,相反出现反馈性的升高。Y-27632逆转了绝大部分TGF-β诱导的EMT相关分子表达的改变,仅vimentin的蛋白表达未受调控,提示TGF-β诱导的vimentin上调可能存在其他转录后调控机制。尽管有其他调控机制存在,本实验的结果表明RhoA/ROCK通路在TGF-β诱导的BPH-1细胞的EMT发生中起了重要作用。
综上所述,EMT在BPH的发生过程中可能有着重要作用,而RhoA/ROCK通路参与了TGF-β诱导的EMT的调控,因此RhoA/ROCK通路可能成为新的BPH治疗药物的作用靶点。
| [1] | Wein A, KavoussiL R, Novick A, et al. Campbell-Walsh Urology[M]. Philadelphia: Saunders, 2016: 2425-2462. |
| [2] | Alonso-Magdalena P, Brossner C, Reiner A, et al. A role for epithelial-mesenchymal transition in the etiology of benign prostatic hyperplasia[J]. Proc Natl Acad Sci USA, 2009, 106(8): 2859-2863. DOI: 10.1073/pnas.0812666106. |
| [3] | Broster SA, Kyprianou N. Epithelial-mesenchymal transition in prostatic disease[J]. Future Oncol, 2015, 11(23): 3197-3206. DOI: 10.2217/fon.15.253. |
| [4] | Lu T, Lin WJ, Izumi K, et al. Targeting androgen receptor to suppress macrophage-induced EMT and benign prostatic hyperplasia (BPH) development[J]. Mol Endocrinol, 2012, 26(10): 1707-1715. DOI: 10.1210/me.2012-1079. |
| [5] | Slabáková E, Pernicová Z, Slavíčková E, et al. TGF-β1-induced EMT of non-transformed prostate hyperplasia cells is characterized by early induction of SNAI2/Slug[J]. Prostate, 2011, 71(12): 1332-1343. |
| [6] | Chen X, Cheng H, Pan T, et al. mTOR regulate EMT through RhoA and Rac1 pathway in prostate cancer[J]. Mol Carcinog, 2015, 54(10): 1086-1095. DOI: 10.1002/mc.v54.10. |
| [7] | Zhang H, Liu X, Liu Y, et al. Epithelial-mesenchymal transition of rat peritoneal mesothelial cells via RhoA/Rock pathway[J]. In Vitro Cell Dev Biol Anim, 2011, 47(2): 165-172. DOI: 10.1007/s11626-010-9369-0. |
 2017, Vol. 38
2017, Vol. 38

