失血性休克在重症监护病房极为常见,病死率很高,急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是失血性休克的常见严重并发症[1],肺水肿是ARDS的重要病理特征。研究表明,肺微血管内皮细胞(pulmonary microvascular endothelial cell, PMVEC)在维护血管通透性方面发挥重要作用,Src抑制的蛋白激酶C的底物(SSeCKS)既是肺微血管内皮细胞的骨架蛋白,又与严重感染密切相关。肿瘤坏死因子-α(TNF-α)可上调SSeCKS的表达,并使SSeCKS在肺微血管内皮中重构,破坏内皮细胞的形态和功能[2]。最近研究表明,在神经系统和免疫系统之间,通过迷走神经及其递质乙酰胆碱(Ach)能显著抑制炎症因子释放,拮抗全身炎症反应,这一生理机制称为“胆碱能抗炎通路”(CAP)[3]。CAP在感染性休克、失血性休克、缺血再灌注损伤、胰腺炎等多种动物模型研究中均具有显著的抗炎作用,有研究表明CAP对脓毒症大鼠肺微血管内皮细胞有保护作用[4],但目前尚缺少CAP对失血性休克大鼠肺微血管内皮细胞是否有保护作用的研究。我们拟通过建立失血性休克大鼠模型,采用电刺激迷走神经激活CAP,探讨CAP对失血性休克大鼠肺微血管内皮是否有保护作用。
1 材料与方法 1.1 材料电镜(日本日立公司HT-7700),450 nm酶标仪(美国Bio-Rad公司),生物机能实验系统(成都泰盟科技BL-4201),生命体征监护仪(Agilent M1046B-Functi onboX美国), Bradfor蛋白浓度测定试剂盒(碧云天生物技术研究所),一抗兔抗GAPDH (甘油醛-3-磷酸脱氢酶)、一抗鼠抗SSeCKS (中国上海艾博抗贸易有限公司),二抗HRP-羊抗兔、二抗HRP-羊抗鼠(北京西美杰科技有限公司)、TNF-α酶联免疫吸附试验(ELISA)试剂盒(武汉伊莱瑞特生物科技有限公司)。
1.2 动物选择与分组无特定病原体(SPF)级雄性SD大鼠30只,体质量240-260 g,购自武汉大学动物实验中心,随机分为3组:假休克组(SS组)、失血性休克组(HS组)、迷走神经电刺激组(STM组),每组10只。
1.3 模型制备用浓度为10%的水合氯醛(40 mg/kg)腹腔注射麻醉后行全身肝素化(600 IU/kg)。分离颈总动脉并置管,通过压力传导系统与心电监护仪相连,测定平均动脉压(MAP)以便于观察抽血情况。分离右侧股动脉并插管以放血和采集标本,分离左侧股静脉用于液体回输。参照Wiggers改良法[5]复制失血性休克模型,以1 ml/min的速度快速放血, 10 min内使MAP下降至35-45 mmHg,稳定5 min不再回升即为放血终点,保存放出的血液。累计失血量约为总血量的30%-40%[按2.1 ml/(100 g)计算]。大鼠失血1 h后回输制备模型时放出的血液,并输注2倍失血量的林格氏液,待3 h后取材。假休克组只进行血管置管,不放血。
1.4 迷走神经分离、切断和电刺激术按文献[6]操作。动物麻醉后仰卧位固定备皮,在喉头与胸骨间沿颈腹正中线开一长约2.5-4.0 cm的切口,用止血钳将胸骨舌骨肌与胸骨甲状肌分开,暴露颈动脉鞘(内有颈动脉及颈部神经)。持玻璃分针顺血管走向钝性分离颈总动脉和迷走神经约3.0-4.0 cm, 用4-0丝线结扎迷走神经, 然后剪断,远端与双铂电极连接。失血性休克模型制备完毕即刻, 以5 V、2 ms和1 Hz的强度持续刺激迷走神经12 min。
1.5 观察指标与检测方法 1.5.1 肺组织病理学观察各组取4只大鼠,于液体复苏3 h后取左肺上叶,置于4%多聚甲醛溶液中固定,经经脱水、透明、浸蜡、包埋,制成5 μm连续冠状切片,苏木素-伊红(HE)染色,光镜下观察。取左肺上叶1 mm×1 mm×1 mm,用2%戊二醛固定,常规脱水,环氧树脂包埋,超薄切片,醋酸铅铀染色,透射电镜下观察[7]。
1.5.2 Western-blot法测肺组织中SSeCKS的表达按文献[4]操作。将冻存于-70 ℃液氮中的肺组织标本取出复温,冰浴匀浆,离心取上清液。Bradford蛋白浓度测定试剂盒对总蛋白进行定量,取40 μg蛋白样品用10%分离胶行SDS-PAGE电泳,转膜后用5%脱脂牛奶封闭1 h,加入已稀释好的一抗4 ℃孵育过夜,TBST洗膜(5 min×3),洗涤后对应二抗温孵育30 min,经TBST洗膜5 min×3后用ECL化学发光试剂盒检测成像。
1.5.3 血浆TNF-α测定各组取8只大鼠,于液体复苏3 h后由右侧股动脉置管取血3 ml,离心(1 000 g,4 ℃,15 min)后取上清。使用TNF-α酶联免疫吸附测定检测试剂盒检测血浆TNF-α水平。用酶标仪测得吸光度(A)值,采用Curve Expert 1.3曲线制作软件计算出样品浓度,结果以pg/ml表示。
1.6 统计学方法计量资料以均数±标准差(x±s)表示,应用SPSS 19.0统计软件分析,组间比较采用单因素方差分析。
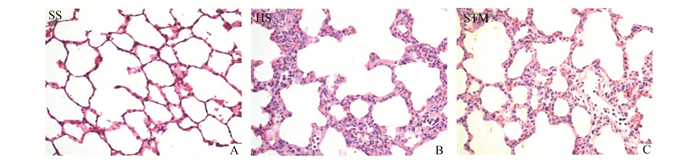
2 结果 2.1 光镜肺组织病理学观察SS组大鼠肺结构正常,形态及结构清晰;HS组光镜下可见肺泡充血、出血、肺间质水肿、白细胞浸润、肺泡壁增厚、透明膜形成;STM组肺损伤较HS组减轻,接近正常肺组织结构。结果见图 1。
|
图 1 肺组织病理学变化(HE×200) A:假休克(SS)组;B:失血性休克(HS)组;C:迷走神经电刺激(STM)组。失血性休克组肺组织损伤最重,迷走神经电刺激可减轻肺组织损伤 |
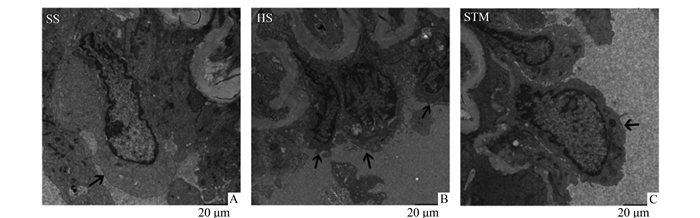
SS组肺微血管内皮细胞和基底膜正常;HS组肺微血管内皮细胞收缩、细胞核内染色体边集、凋亡、胞质内线粒体水肿;STM组损伤减轻,接近SS组。结果见图 2。
|
图 2 电镜观察PMVEC病理变化 A:假休克(SS)组;B:失血性休克(HS)组;C:迷走神经电刺激(STM)组,图下标尺单位是20 μm。箭头所指为微血管内皮细胞,如图所示:失血性休克组肺微血管内皮细胞损伤最重,细胞凋亡、线粒体水肿,迷走神经电刺激能减轻损伤,接近正常 |
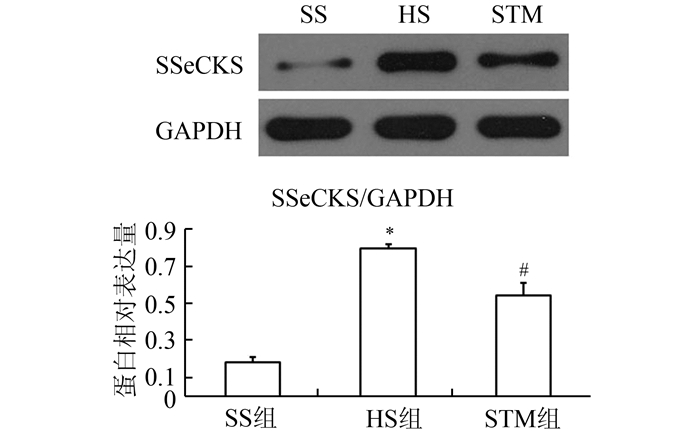
HS组表达水平是SS组4.35倍,是STM组1.47倍,其数值每两组之间都有统计学差异(P<0.05),见图 3。
|
图 3 Western blot结果显示SSeCKS蛋白表达变化 SSeCKS:Src抑制的蛋白激酶C的底物;GAPDH:甘油醛-3-磷酸脱氢酶。HS组与SS组比较,*P<0.05;STM组与HS组比较,#P<0.05 |
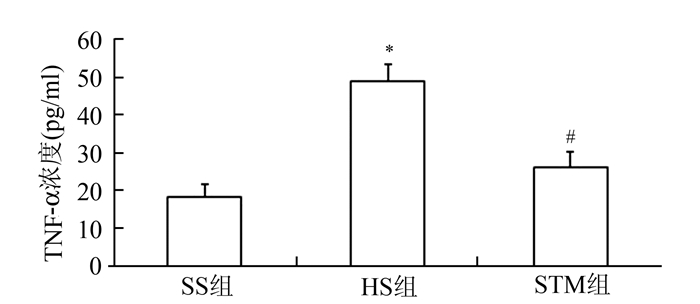
与SS组比较,HS组TNF-α表达明显增加(P<0.05);迷走神经电刺激后,在STM组,TNF-α的表达明显比HS组降低(P<0.05),见图 4。
|
图 4 各组血浆中TNF-α含量比较 TNF-α:肿瘤坏死因子-α。HS组与SS组比较,*P<0.05;STM组与HS比较,#P<0.05 |
失血性休克的基本病理生理学变化是失血造成的有效循环血量减少和组织低灌注。失血性休克和严重创伤导致的应激状态可以引起全身炎症反应广泛激活,大量炎症介质释放,触发全身炎症反应综合征(SIRS)。全身炎症反应可导致肺微血管内皮细胞结构破坏,使液体和白细胞进入肺泡,影响正常气-血交换,进一步导致ARDS的发生[6]。本实验结果表明,在失血性休克模型中,肺微血管内皮细胞结构遭到严重破坏,电刺激迷走神经对其结构具有保护作用。此外,在电镜及光镜下也进一步证实了这一现象。
完整的肺微血管内皮细胞可保护血管屏障功能,降低血管内皮细胞间渗透,减少炎性细胞浸润和白细胞黏附,进而减轻组织水肿[8]。SSeCKS主要分布在内皮细胞的周边和核周部位,对维持内皮细胞的形态和功能有重要作用,是血管内皮细胞重要的结构蛋白。SSeCKS过度表达可引起SSeCKS在细胞内的分布改变,细胞收缩,间隙增大,通透性增加,进而形成水肿[9]。失血性休克时,TNF-α大量生成,是其主要的炎性介质。有研究表明,TNF-α可通过激活蛋白激酶C (PKC)途径上调Src抑制的蛋白激酶C的底物(SSeCKS)[2],进而破坏血管内皮细胞结构和功能。本研究结果表明失血性休克时血浆TNF-α升高的同时,肺微血管内皮细胞结构遭到显著破坏,支持了以往研究。近期有研究称此现象可能与胆碱能抗炎通路密切相关。
近些年有学者称中枢神经系统中胆碱能神经核团活化后刺激迷走神经传出纤维释放乙酰胆碱(Ach), 巨噬细胞、内皮细胞、树突状细胞等细胞表面有n受体中α7亚单位(α7nAch), Ach通过α7-nAch拮抗全身系统炎性反应,这一抗炎通路称“胆碱能抗炎通路(CAP)”,CAP不仅对炎性疾病动物模型有保护作用,同时有强大的抗休克作用[3]。本实验结果指出电刺激迷走神经显著抑制失血性休克大鼠全身炎性反应,对肺微血管内皮细胞具有保护作用,进而可减少肺组织水肿,减轻ARDS。但迷走神经电刺激通过抗炎保护肺微血管内皮细胞的具体机制现仍不完全清楚,有待进一步研究。
综上所述,电刺激迷走神经对失血性休克大鼠肺微血管内皮细胞有保护作用,其机制可能与激活胆碱能抗炎通路抑制全身性炎症反应有关,为临床治疗失血性休克并发肺损伤提供新的思路。
| [1] | Sawant DA, Tharakan B, Hunter FA, et al. The Role of intrinsic apoptotic signaling in hemorrhagic shock-induced microvascular endothelial cell barrier dysfunction[J]. J Cardiovasc Transl Res, 2014, 7(8): 711-718. DOI: 10.1007/s12265-014-9589-x. |
| [2] | Cheng C, Liu H, Ge H, et al. Lipopolysaccharide induces expression of SSeCKS in rat lung microvascular endothelial cell[J]. Molecular and Cellular Biochemistry, 2007, 305(1-2): 1-8. DOI: 10.1007/s11010-007-9521-7. |
| [3] | Levy G, Fishman JE, Xu D, et al. Vagal nerve stimulation modulates gut injury and lung permeability in trauma-hemorrhagic shock[J]. Journal of Trauma and Acute Care Surgery, 2012, 73(2): 338-342. DOI: 10.1097/TA.0b013e31825debd3. |
| [4] | Chen C, Zhang Y, Du Z, et al. Vagal efferent fiber stimulation ameliorates pulmonary microvascular endothelial cell injury by downregulating inflammatory responses[J]. Inflammation, 2013, 36(6): 1 567-1 575. DOI: 10.1007/s10753-013-9701-4. |
| [5] | Reys LG, Ortiz-Pomales YT, Lopez N, et al. Uncovering the neuroenteric-pulmonary axis:Vagal nerve stimulation prevents acute lung injury following hemorrhagic shock[J]. Life Sciences, 2013, 92(13): 783-792. DOI: 10.1016/j.lfs.2013.02.009. |
| [6] | Zhou H, Liang H, Li Z, et al. Vagus nerve stimulation attenuates intestinal epithelial tight junctions disruption in endotoxemic mice through α7 nicotinic acetylcholine receptors[J]. Shock, 2013, 40(2): 144-151. DOI: 10.1097/SHK.0b013e318299e9c0. |
| [7] | Türker H. Histological and ultrastructural analyses of mole rats lung cells exposed to ultraviolet radiation[J]. Journal of Radiation Research and Applied Sciences, 2014, 7(4): 560-567. DOI: 10.1016/j.jrras.2014.09.003. |
| [8] | Zhang K, Wang P, Huang S, et al. Different mechanism of LPS-induced calcium increase in human lung epithelial cell and microvascular endothelial cell:a cell culture study in a model for ARDS[J]. Molecular Biology Reports, 2014, 41(7): 4 253-4 259. DOI: 10.1007/s11033-014-3296-1. |
| [9] | 刘海鸥, 沈爱国, 钱佶, 等. LPS和TNF-α对血管内皮细胞SSeCKS的表达影响[J]. 中国免疫学杂志, 2007(7): 580-585. |
 2016, Vol. 37
2016, Vol. 37

 ,
,