在梗阻性黄疸(obstructive jaundice, OJ)的病理过程中,肝脏是最容易受损害的器官。梗阻性黄疸致肝损害的机制复杂多样。Kupffer细胞作为肝脏内的巨噬细胞,具有吞噬外源性物质、分泌炎性因子、参与免疫调节与监视等功能,并且在肝细胞受损和修复中扮演重要角色[1]。Nrf2/ARE通路是目前已知的最重要的抗氧化应激通路。Kupffer细胞在肝炎、脂肪肝、酒精性肝病、肝纤维化、肝移植后排斥反应及肝癌的发展中都有重要作用[2]。但是,Kupffer细胞在梗阻性黄疸中的相关研究较少,特别是对肝损害中的氧化应激及抗氧化应激的影响机制。我们在大鼠梗阻性黄疸肝损害模型中观察了抑制Kupffer细胞功能对肝功能、氧化应激指标及抗氧化应激通路相关蛋白的影响。
1 材料与方法 1.1 实验动物和试剂SPF级雄性Wistar大鼠60只,体重200-220 g,购自北京维通利华实验动物技术有限公司。氯化钆(GdCl3)、兔抗大鼠Nrf2、HO-1抗体购于Sigma公司,丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒购于南京建成公司。
1.2 动物模型的建立和分组采用胆总管双重结扎及离断建立大鼠梗阻性黄疸的模型。实验大鼠术前12 h禁食水,采取异氟烷吸入麻醉,正中切口进腹,牵拉十二指肠分离出胆总管,双重结扎后离断。60只小鼠随机分为6个组(n=10),假手术组(SHAM组)、假手术+氯化钆处理组(SHAM+GdCl3组)、梗阻性黄疸7 d组(BDL-7D组)、梗阻性黄疸7 d+氯化钆处理组(BDL-7D+GdCl3组)、梗阻性黄疸14 d组(BDL-14D)、梗阻性黄疸14 d+氯化钆处理组(BDL-14D + GdCl3组)。干预组在梗阻性黄疸大鼠模型建立24 h后从大鼠尾静脉注射GdCl3(20 mg/kg),对照组的大鼠按体重等体积尾静脉注射0.9%NaCl溶液。在建模后的第7、14天处死大鼠,下腔静脉采血并统一取肝左叶组织标本备用。
1.3 血清学分析从大鼠下腔镜静脉收集血液标本静置30 min,然后3 000 r/min离心10 min,用全自动化学分析仪检测门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、总胆红素(TBIL)。
1.4 肝组织MDA含量、SOD活性检测① 肝组织上清液提取:取肝组织100 mg和1 mol/L HCl 1 ml混匀研磨,制备成10%肝组织匀浆,4 ℃下3 000 r/min离心10 min,取上清液。②MDA含量测定:MDA是过氧化脂质的降解产物,它可与硫代巴比妥酸(TBA)缩合,形成红色产物,在波长532 nm处有最大吸收峰。③SOD活性检测:通过黄嘌呤氧化酶反应系统产生超氧阴离子自由基,使氧化羟胺形成硝酸盐,在显色剂作用下呈现紫红色,再用可见分光光度计测其吸光度值,通过公式计算求出被测样品中的SOD活力。
1.5 蛋白印迹(Western Blot)法检测肝组织Nrf2及HO-1蛋白的表达① 肝组织蛋白提取:取出在-80 ℃深低温冰箱中保存的肝组织50-100 mg,于研钵内用液氮将肝组织磨成粉末,用RIPA蛋白裂解液提取总蛋白。②BCA法测蛋白浓度:取适量的标准蛋白(浓度为0.5 mg/ml),根据样品数量配置BCA工作液,各步骤按说明操作,根据标准曲线计算出样品的浓度。③电泳:取10 μg总蛋白上样、电泳。④转膜:将PVDF膜在甲醛中浸润约2 min,电流220 mA,转膜90 min。⑤封闭:用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温摇床封闭2 h。⑥孵育一抗和二抗:用封闭液稀释相应的一抗,使PVDF膜浸泡于一抗孵育液中,4 ℃孵育过夜。抗体稀释浓度如下:Nrf2 1:300、HO-1 1:200、GAPDH 1:1 000。用于封闭液稀释相应的HRP标记二抗(1:50 000稀释),室温摇床孵育2 h。⑦扫膜:扫描获得图片,用Quantity One软件进行分析。以GAPDH作为内参照,各组目的蛋白相对值除以GAPDH相对值,即各组目的蛋白的相对表达量。
1.6 免疫组织化学法检测肝脏组织Nrf2、HO-1蛋白表达情况将包埋的肝组织切片常规脱蜡,浸入新鲜配制的3%H2O2中将内源性氧化物酶灭活。用封闭血清封闭非特异性抗原位点,滴加Nrf2(1:100)和HO-1(1:100)一抗在室温下孵育2 h, 再加HRP-羊抗兔IgG室温下孵育20 min。二抗及DAB试剂盒按试剂盒说明书进行,脱水、透明、中性树胶封固。以显微镜下观察良好的组织结构以及清晰的背景细胞核内出现棕黄色颗粒反应物为阳性。
1.7 肝细胞的病理形态学变化切取的新鲜肝左叶组织10%的中性甲醛固定,常规石蜡包埋、切片、HE染色。光学显微镜下观察肝组织病理形态学变化。
1.8 统计学分析本研究所得数据均录入SPSS 20.0软件包分析处理。计量资料以x±s表示,组间差异进行t检验;计数资料以百分比表示,组间差异进行χ2检验,均以P<0.05为差异有统计学意义。
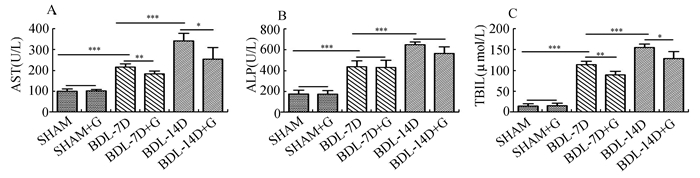
2 结果 2.1 肝功能及总胆红素除SHAM组外,其余各组血AST、ALP、TBIL均显著增高(P<0.05)。SHAM组和SHAM+GdCl3组比较,以上三个指标均未见明显差异(P>0.05),AST、TBIL在梗阻性黄疸7 d和14 d时,GdCl3干预组要明显低于相应的梗阻性黄胆组(P<0.05),AST、ALP、TBIL三个指标在SHAM组与BDL-7D组,BDL-14D组与BDL-7D组相比有显著差异(P<0.05)。ALP在GdCl3干预组未见明显差异(P>0.05)。见图 1。
|
图 1 6组大鼠血清生化指标 A:6组大鼠AST的变化情况;B:ALP的变化情况;C:TBIL的变化情况, ***P<0.01,**P<0.01,*P<0.05 |
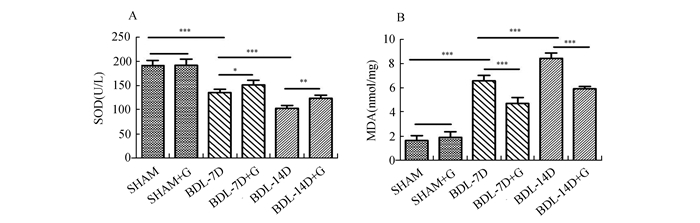
除SHAM组外,其余各组SOD含量均下降,GdCl3处理的各组SOD活力明显高于同时相的BDL组(P<0.05)。MDA含量均于梗阻性黄疸后开始升高,GdCl3处理的各组MDA的含量要低于对应的BDL组(P<0.05)。SOD、MDA两个指标在SHAM组与BDL-7D组,BDL-14D组与BDL-7D组相比有显著差异(P<0.05)。见图 2。
|
图 2 6组大鼠肝组织匀浆氧化应激指标 A:6组大鼠肝组织SOD的含量;B:6组大鼠肝组织MDA的变含量. ***P<0.01,**P<0.01,*P<0.05 |
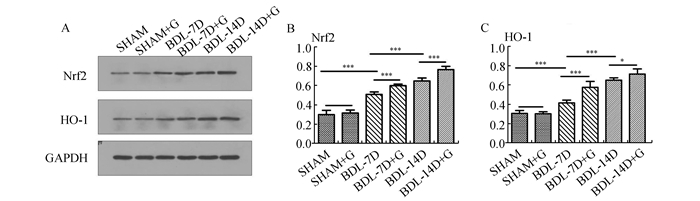
为评价抑制Kupffer细胞功能对梗阻性黄疸大鼠Nrf2/HO-1蛋白表达的影响,我们采用Western Blot法对各组大鼠肝组织Nrf2和HO-1蛋白表达情况进行检测,Nrf2和HO-1在SHAM组、BDL-7D组、BDL-14D组的表达依次增高,且差异明显(P<0.05)。用GdCl3干预的梗阻性黄疸组的Nrf2和HO-1的表达要增高更为明显(P<0.05),但在假手术组则未见差异(P>0.05)。见图 3。
|
图 3 6组大鼠肝组织Nrf2、HO-1蛋白表达情况 A: Western Blot;B、C:A图的定量分析,与相对应组比较,***P<0.01,*P<0.05 |
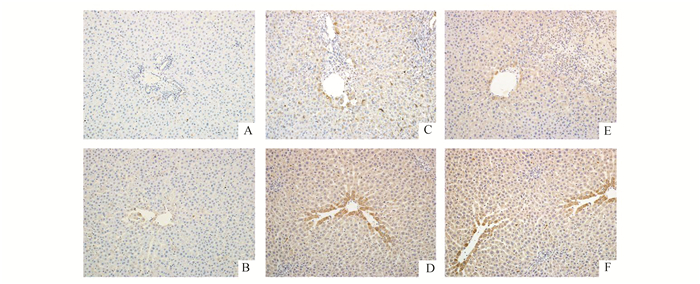
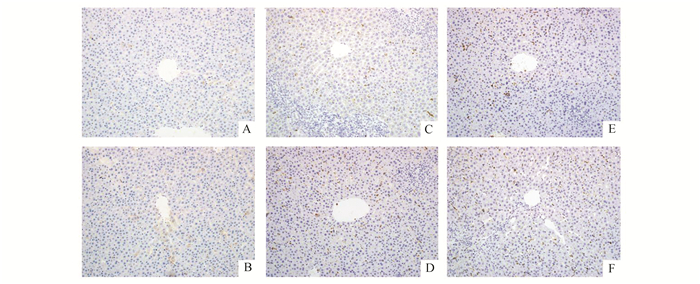
我们采用免疫组织化学方法进一步检测Nrf2、HO-1蛋白在肝脏组织的表达情况,蛋白主要表达于细胞质,胞质为褐黄色或黄色的细胞为阳性,随机选取视野计数阳性细胞数最后取平均值。见图 4和图 5。
|
图 4 6组大鼠肝组织Nrf2蛋白表达情况(免疫组化×200) A:SHAM组;B:SHAM+GdCl3组;C: BDL-7D组;D:BDL-7D+GdCl3组;E:BDL-14D组;F:BDL-14D+GdCl3组;A与B无明显差异;阳性细胞D多于C,F多于E |
|
图 5 6组大鼠肝组织HO-1蛋白表达情况(免疫组化×200) A:SHAM组;B:SHAM+GdCl3组;C: BDL-7D组;D:BDL-7D+GdCl3组;E:BDL-14D组;F:BDL-14D+GdCl3组;A与B无明显差异;阳性细胞D多于C,F多于E |
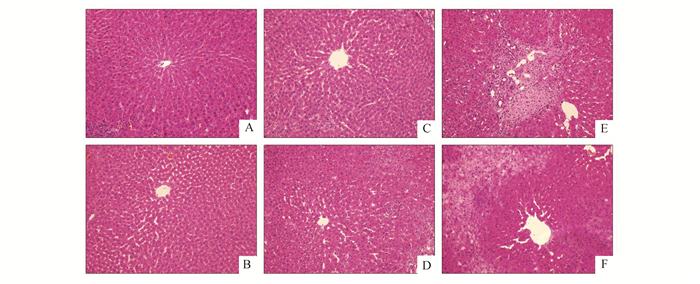
SHAM组小鼠肝脏大体标本无明显异常,BDL组大体标本可见肝脏组织明显肿大,呈淤胆表现,局部可见黄色坏死灶,结扎处胆管直径增粗。肝组织HE染色可见:SHAM组和SHAM+GdCl3组肝脏组织结构清晰,肝细胞索以肝小叶中央静脉为中心向四周放射排列整齐,无明显异常改变;BDL-7D组可见肝细胞水中,肝细胞索排列开始紊乱,汇管区有增生,胆管扩张;BDL-7D+ GdCl3组也可肝细胞水肿,肝细胞索排列紊乱,但程度较BDL-7D组要轻;BDL-14D组大鼠肝脏细胞肿胀,局部出现片状胆汁性梗死,空泡变性,汇管区边缘小管径小胆管增生,无明显假小叶形成。BDL-14D+ GdCl3组的大鼠在中央静脉周围有大量的肝细胞空泡样变性,未见梗死灶。见图 6。
|
图 6 6组大鼠肝脏组织病理变化(HE×200) A:SHAM组;B:SHAM+GdCl3组;C: BDL-7D组;D:BDL-7D+GdCl3组;E:BDL-14D组;F:BDL-14D+GdCl3组 |
梗阻性黄疸是临床上的常见病,先天性因素、结石、肿瘤等均可导致。肝脏是在梗阻性黄疸的发病过程中损伤最为严重的器官。胆汁淤积、肠源性内毒素血症、炎性因子、氧化应激等都是梗阻性黄疸肝损害的机制[3]。Kupffer细胞是肝内的巨噬细胞,是肝内最主要的巨噬细胞(占机体固有巨噬细胞的80%以上,占肝脏细胞的15%左右),而且具有吞噬外源性物质、分泌炎性因子、参与免疫调节与监视等功能[1]。Kupffer细胞分为M1和M2两种类型,参与不同状态下的病理生理过程。M1型表现为促炎反应,很容易被LPS激活,参与产生TNF-α、IL-6、IL-1β来介导炎性反应等[4],而M2型表现为抗炎反应,产生IL-4、IL-10、IL-13等减轻炎性反应[5]。IL-17可由中性粒细胞和辅助T细胞分泌,Kupffer细胞可通过IL-17的调节,产生炎性因子介导肝损害[6]。在梗阻性黄疸中,Kupffer细胞会被内毒素激活参与肝损害。氯化钆(GdCl3)抑制Kupffer细胞功能,可有效降低LPS的应激,抑制TNF-α、IL-β的分泌,减轻肝损害和纤维化[7]。
炎性反应是梗阻性黄疸的重要病理过程,许多研究已经显示核因子NF-E2相关因子(nuclear factor erythroid 2-related factor,Nrf2)是重要的内源性抗氧化应激蛋白[8]。Nrf2是外源性有毒物质和氧化应激的感受器,在参与细胞抗氧化应激和外源性有毒物质诱导的主要防御机制中发挥重要作用。血红素氧合酶-1(heme oxygenase,HO-1)是一个诱导相关蛋白分解的限速酶,可诱导亚铁血红素分解为CO(carbon monoxide)和游离铁,胆绿素分解为胆红素,还可以降解促炎因子,分泌抗炎因子来发挥保护作用[9]。我们此次研究的重要目的就是探讨抑制Kupffer细胞功能后,是否可以通过调节Nrf2/HO-1抗氧化应激通路来保护肝功能,并为研究Kupffer细胞在梗阻性黄疸介导肝细胞损害的机制奠定基础。
我们的研究显示,利用氯化钆抑制大鼠Kupffer细胞功能,可通过上调Nrf2/HO-1的表达来保护肝功能,该结论与Abrahám等[10]的研究抑制Kupffer细胞可保护梗阻性黄疸的肝细胞损害结论一致。根据对照组和实验组的结果表明,抑制Kupffer细胞功能对正常大鼠肝功能无影响。抑制Kupffer细胞功能后,可明显降低梗阻性黄疸大鼠的AST,TBIL,但是对ALP未见差异,其原因可能是Kupffer细胞位于肝血窦,与肝细胞存在广泛联系,而与胆管细胞则相反,所以在梗阻性黄疸时,抑制Kupffer细胞功能可保护肝细胞而对胆管细胞损害则没有。我们观察氧化应激指标表明,梗阻性黄疸后,各组肝脏组织MDA含量迅速升高,而SOD则明显下降,经GdCl3处理后的干预组与相应的梗阻性黄疸组大鼠的MDA的含量下降,而SOD的活力增高,减轻脂质氧化反应,通过抑制Kupffer细胞功能,可上调Nrf2/HO-1蛋白的表达来保护肝脏功能,但至于Kupffer细胞是如何影响Nrf2/HO-1蛋白表达的具体机制还得做更深入的研究。
| [1] | Nguyen-Lefebvre AT, Horuzsko A. Kupffer Cell Metabolism and Function[J]. J Enzymol Metab, 2015, 1(1): pii:101. |
| [2] | Merlin S, Bhargava KK, Ranaldo G, et al. Kupffer cell transplantation in mice for elucidating monocyte/macrophage biology and for potential in cell or gene therapy[J]. Am J Pathol, 2016, 186(3): 539-551. DOI: 10.1016/j.ajpath.2015.11.002. |
| [3] | Long Y, Dong X, Yuan Y, et al. etabolomics changes in a rat model of obstructive jaundice: mapping to metabolism of amino acids, carbohydrates and lipids as well as oxidative stress[J]. J Clin Biochem Nutr, 2015, 57(1): 50-59. DOI: 10.3164/jcbn.14-147. |
| [4] | Scott CL, Zheng F, De Baetselier P, et al. Bone marrow-derived monocytes give rise to self-renewing and fully differentiated Kupffer cells[J]. Nat Commun, 2016, 7: 10 321. DOI: 10.1038/ncomms10321. |
| [5] | Halaney DL, Zahedivash A, Phipps JE, et al. Differences in forward angular light scattering distributions between M1 and M2 macrophages[J]. J Biomed Opt, 2015, 20(11): 115 002. DOI: 10.1117/1.JBO.20.11.115002. |
| [6] | Hara M, Kono H, Furuya S, et al. Interleukin-17A plays a pivotal role in cholestatic liver fibrosis in mice[J]. J Surg Res, 2013, 183(2): 574-582. DOI: 10.1016/j.jss.2013.03.025. |
| [7] | Jones C, Badger SA, Hoper M, et al. Hepatic cytokine response can be modulated using the Kupffer cell blocker gadolinium chloride in obstructive jaundice[J]. Int J Surg, 2013, 11(1): 46-51. DOI: 10.1016/j.ijsu.2012.11.008. |
| [8] | Ahmed SM, Luo L, Namani A, et al. Nrf2 signaling pathway: Pivotal roles in inflammation[J]. Biochim Biophys Acta, 2017, 1863(2): 585-597. DOI: 10.1016/j.bbadis.2016.11.005. |
| [9] | Loboda A, Damulewicz M, Pyza E, et al. Role of Nrf2/HO-1 system in development, oxidative stress response and diseases: an evolutionarily conserved mechanism[J]. Cell Mol Life Sci, 2016, 73(17): 3 221-3 247. DOI: 10.1007/s00018-016-2223-0. |
| [10] | Abrahám S, Hermesz E, Szabó A, et al. Effects of Kupffer cell blockade on the hepatic expression of metallothionein and heme oxygenase genes in endotoxemic rats with obstructive jaundice[J]. Life Sci, 2012, 90(3-4): 140-146. DOI: 10.1016/j.lfs.2011.10.021. |
 2018, Vol. 39
2018, Vol. 39

 ,
,