木犀草素(Luteolin)是一种天然的黄酮类化合物,存在于多种草本植物中,以金银花、野菊花、芹菜、青辣椒、薄荷、迷迭香中含量较高。研究表明,木犀草素具有抗炎、抗过敏、抗肿瘤、抗纤维化、神经保护等多种作用[1-3]。随着对黄酮类化合物研究的深入,其抗糖尿病(diabetes mellitus, DM)作用被越来越多地报道[4],但木犀草素是否对胰腺有保护作用尚未清楚。研究表明Wnt/β-catenin信号通路与胰腺发育、胰岛β细胞增殖、胰岛素分泌调控密切相关[5, 6]。因此,本文通过研究木犀草素对DM大鼠胰腺Wnt/β-catenin信号通路表达的影响,探讨木犀草素对胰腺保护作用及其可能机制。
1 材料与方法 1.1 实验材料 1.1.1 动物SPF级6周龄雄性SD大鼠40只,体重160-180 g,由湖北省疾病预防控制中心实验动物研究中心提供,许可证号SYXK(鄂)2017-0065。在武汉大学中南医院动物实验中心饲养,环境温度18-22 ℃,空气湿度50%左右,12 h明暗交替一次。
1.1.2 试剂木犀草素(纯度≥98%)(南京泽朗医药科技有限公司),链脲佐菌素(streptozocin, STZ) (美国Sigma公司);总胆固醇(total cholesterol, TC)、三酰甘油(triglyceride, TG)、低密度脂蛋白(low density lipoprotein cholesterol, LDL)、高密度脂蛋白(high density lipoprotein cholesterol, HDL)检测试剂盒(南京建成生物工程研究所);wnt3a抗体(北京博奥森生物技术有限公司);β-catenin抗体(美国CST公司);cyclin D1抗体、c-myc抗体(英国Abcam公司)。
1.2 方法 1.2.1 动物模型建立及分组将40只SD大鼠随机分为正常对照组(NC)、正常对照+木犀草素组(NC+L)、糖尿病组(DM)和木犀草素治疗组(DM+L),每组各10只。DM组及DM+L组高脂饲料喂养3周后,禁食16 h,按40 mg/kg单次腹腔注射柠檬酸-柠檬酸钠缓冲液(0.1 mmol/L,pH 4.0)配置的STZ溶液,72 h后尾静脉采血,以空腹血糖≥16.7 mmol/L为2型糖尿病(T2DM)大鼠成模标准。4只大鼠(DM组3只,DM+L组1只)空腹血糖不达标予以剔除。NC组及NC+L组普通饲料喂养,腹腔注射等量的柠檬酸-柠檬酸钠缓冲液。造模成功后NC+L组和DM+L组给予木犀草素100 mg/(kg ·d)灌胃,NC组和DM组给予等量生理盐水。实验期间,NC+L组、DM+L组大鼠各死亡1只,不予统计。
1.2.2 标本收集干预6周后,禁食过夜12 h,按50%葡萄糖2 g/kg腹腔注射行糖耐量试验,尾静脉采血测空腹血糖(FPG)、餐后2 h血糖(2 h PBG)。第2天腹腔注射5%水合氯醛麻醉大鼠,心脏采血测胰岛素(INS)、TC、TG、LDL、HDL等生化指标。处死大鼠后快速摘除胰腺,将部分胰腺组织固定于4%多聚甲醛中,包埋后切片行苏木素-伊红(HE)染色;其余胰腺组织置于液氮中,转移至-80 ℃冰箱中保存,用于检测wnt3a、β-catenin、cyclin D1、c-myc蛋白。
1.2.3 胰腺病理组织学检查大鼠胰腺经4%多聚甲醛固定后,乙醇脱水组织透明,石蜡包埋,切片厚度4 μm,行HE染色,光镜下观察胰腺组织病理改变。
1.2.4 Western Blot测定胰腺组织wnt3a、β-catenin、cyclin D1、c-myc蛋白的表达提取胰腺组织蛋白,BCA法测蛋白浓度,变性后取样10 μl行SDS-PAGE凝胶电泳,湿法转入PVDF膜,5%脱脂奶粉封闭1 h。加入wnt3a(1:500)、β-catenin(1:3 000)、cyclin D1(1:2 000)、c-myc(1:2 000)和β-Actin(1:10 000)一抗,4 ℃过夜。次日回收一抗TBST洗膜3次,加入二抗(1:10 000)室温孵育30 min,TBST洗膜4次,ECL化学发光法曝光。以β-actin为内参,通过计算目标蛋白与β-Actin蛋白的灰度比进行半定量分析。
1.3 统计学处理采用SPSS 20.0统计软件,符合正态分布的计量资料采用均数±标准差(x±s)表示,多组比较采用单因素方差分析,组间比较采用LSD检验(方差齐)或Tamhane’s T2检验(方差不齐),P<0.05表示差异有统计学意义。
2 结果 2.1 体重、血糖、血清胰岛素、血脂等指标的比较给药6周后,4组大鼠体重无明显差异(P>0.05)。与NC组相比,DM组FPG、2 h PBG明显升高(均P<0.01);DM+L组FPG、2 h PBG较DM组明显下降(均P<0.05),但仍比NC组高(均P<0.05)。与NC相比,DM组INS明显升高(P<0.01),DM+L组INS较DM组明显下降(P<0.01),与NC组无明显差异(P>0.05)。与NC组相比,DM组TC、TG、LDL明显升高(均P<0.01),而木犀草素治疗组这些指标均有所下降(均P<0.01),且与NC组无差异(均P>0.05)。4组HDL水平无明显差异(P>0.05)(见表 1)。
| 表 1 各组大鼠体重、血糖、血清胰岛素、血脂的比较(x±s) |
正常大鼠胰岛形态完整规则,与外分泌腺界限清晰,胰岛细胞数量丰富,排列规则,着色良好。与NC组相比,DM组胰岛形态极不规则,与外分泌腺界限不清,胰岛细胞数量减少且排列紊乱,部分细胞胞质内出现空泡,细胞核着色不清。木犀草素治疗组,大鼠胰岛形态明显规则,与外分泌腺界限清晰,胰岛细胞数量增多,排列较规则紧密,胞质内空泡减少,细胞核着色清晰(见图 1)。
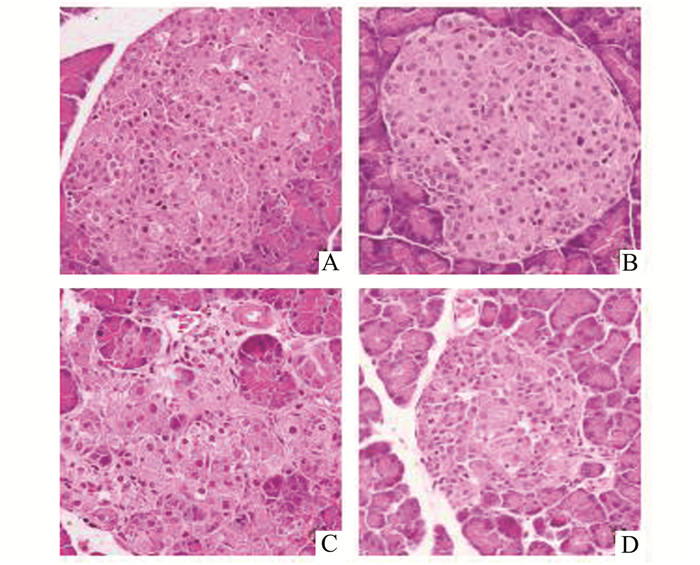
|
图 1 各组大鼠胰腺组织病理改变(HE×400) A:NC组;B:NC+L;C:DM组;D:DM+L组 |
与NC组相比,DM组wnt3a、β-catenin、cyclin D1、c-myc蛋白表达水平明显下降(均P<0.01),木犀草素治疗组wnt3a、β-catenin、cyclin D1、c-myc蛋白表达水平均有所升高(均P<0.05),但与NC组和NC+L组蛋白表达水平仍有差距(均P<0.05)(见图 2)。
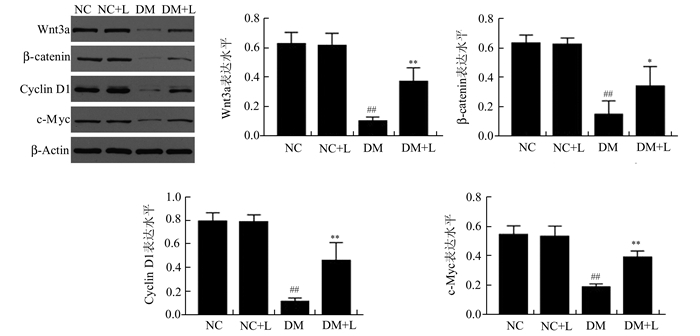
|
图 2 各组大鼠wnt3a、β-catenin、cyclin D1、c-myc蛋白表达的比较 与NC组比较,##P<0.01;与DM组比较,*P<0.05, **P<0.01 |
长期的高糖刺激,不仅直接损伤胰岛β细胞,还会加重外周胰岛素抵抗,使葡萄糖刺激的胰岛素分泌(glucose-stimulated insulin secretion, GSIS)减少,血糖进一步升高,形成恶性循环[7]。因此,解除高糖毒性对保护胰岛功能,延缓糖尿病的发生发展至关重要。在本研究中,DM大鼠的FPG、2 h PBG、INS升高,表现出明显的胰岛素抵抗,木犀草素治疗组FPG、2 h PBG、INS均明显下降,胰腺的病理损伤也在一定程度上得到恢复,证明了木犀草素对T2DM大鼠胰腺具有保护作用,能在一定程度上修复胰岛功能和逆转胰岛细胞损伤。有研究表明,木犀草素能增加胰岛素介导的葡萄糖摄取,增强胰岛素的敏感性[8]。近来还有研究指出,木犀草素能够抑制DM诱导的白细胞介素-1β(interleukin-1β, L-1β)、血管内皮生长因子(vascular endothelial growth factor, VEGF)和核转录因子(nuclear factor-κB, NF-κB)水平的升高[9]。这都提示木犀草素解除高糖毒性、改善胰岛素抵抗作用可能与其增强胰岛素的敏感性、提高抗氧化应激能力有关。但木犀草素是否能调控胰岛β细胞增殖、凋亡及其具体机制尚未清楚。
长期的高血糖还会影响β细胞内脂质代谢,大量葡萄糖进入三羧酸循环产生的有害中间产物会造成丙二酸单酰辅酶A(Malonyl-CoA)的增加,Malonyl-CoA通过抑制线粒体膜上肉碱棕榈酰基转移酶1(CPT-1),阻断脂肪酸进入线粒体内进行β-氧化,造成长链脂酰辅酶A(LC-CoA)在细胞内的堆积,而LC-CoA的堆积又反过来造成β细胞功能损害和胰岛素抵抗[10]。在本研究中,糖尿病大鼠表现出TC、TG、LDL水平的升高,而木犀草素治疗组,TC、TG、LDL水平明显下降,证明木犀草素降在降低血糖同时还能其改善脂代谢紊乱,为β细胞功能恢复创造良好的环境。在HepG2细胞中,木犀草素能上调CPT-1基因的表达,下调脂肪酸合酶(fatty acid synthase,FAS)基因的表达,还能减少活性氧(reactive oxygen species,ROS)的生成,减少脂质的堆积,这提示木犀草素发挥脂代谢调节作用可能与纠正自由基代谢、增加CPT-1和抑制FAS有关[11]。
Wnt/β-catenin通路活化源于wnt配体和受体的结合,当没有配体时,胞质中的AXIN蛋白结合糖原合成酶激酶3(glycogen synthase kinase 3,GSK3)、腺瘤性息肉蛋白(adenomatous polyposis coli,APC),形成AXIN/GSK3/APC复合体,当有配体时,AXIN/GSK3/APC复合体解聚,导致胞质内β-catenin不断积累,进入细胞核中与T细胞因子(T cell factor/lymphoid enhancer factor,TCF/LEF)相互作用,从而启动下游的靶基因如c-myc、cyclin D1的转录。研究发现,在体外下调Wnt/β-catenin信号通路会抑制β细胞增殖,从而导致β细胞正常和补偿性增长的改变,通过抑制GSK-3β上调Wnt/β-catenin信号通路可以显著刺激DM大鼠β细胞再生[5]。早期DM大鼠心肌组织中Wnt2、β-catenin和c-myc的表达增加,而Wnt/β-catenin信号通路的负性调控因子DKK1无明显改变,说明在早期DM心肌损伤中Wnt/β-catenin信号通路被异常激活[12],而在糖尿病肾病(diabetic nephropathy,DN)大鼠肾小球中wnt5a、β-catenin的表达显著降低[13]。还有一项研究指出,在绝经后女性T2DM患者体内β-catenin的表达明显低于健康对照者[14]。在本研究中,DM大鼠胰腺组织wnt3a、β-catenin、cyclin D1、c-myc蛋白表达水平下降,而木犀草素能够提高wnt3a、β-catenin、cyclin D1、c-myc蛋白表达,说明DM时Wnt/β-catenin信号通路被抑制,木犀草素可以减轻Wnt/β-catenin信号通路的抑制状态,改善糖脂代谢,减轻胰岛素抵抗,从而对胰腺起保护作用。
| [1] | Nabavi SF, Braidy N, Gortzi O, et al. Luteolin as an anti-inflammatory and neuroprotective agent: A brief review[J]. Brain Research Bulletin, 2015, 119(Pt A): 1-11. |
| [2] | Xie F, Lang Q, Zhou M, et al. The dietary flavonoid luteolin inhibits Aurora B kinase activity and blocks proliferation of cancer cells[J]. European Journal of Pharmaceutical Sciences, 2012, 46(5): 388-396. DOI: 10.1016/j.ejps.2012.03.002. |
| [3] | Li J, Li X, Xu W, et al. Antifibrotic effects of luteolin on hepatic stellate cells and liver fibrosis by targeting AKT/mTOR/p70S6K and TGFβ/Smad signalling pathways[J]. Liver International, 2015, 35(4): 1222-1233. DOI: 10.1111/liv.2015.35.issue-4. |
| [4] | Zang Y, Igarashi K, Li Y. Anti-diabetic effects of luteolin and luteolin-7-O-glucoside on KK-Ay mice[J]. Biosci Biotechnol Biochem, 2016, 80(8): 1580-1586. DOI: 10.1080/09168451.2015.1116928. |
| [5] | Figeac F, Uzan B, Faro M, et al. Neonatal growth and regeneration ofbeta-cells are regulated by the Wnt/beta-catenin signaling in normal and diabetic rats[J]. American Journal of Physiology Endocrinology & Metabolism, 2010, 298(2): E245. |
| [6] | Wang X, Lei X G, Wang J. Malondialdehyde regulates glucose-stimulated insulin secretion in murine islets via TCF7L2-dependent Wnt signaling pathway[J]. Molecular & Cellular Endocrinology, 2014, 382(1): 8-16. |
| [7] | Kaneto H. Pancreatic β-cell glucose toxicity in type 2 diabetes mellitus[J]. Current Diabetes Reviews, 2015, 11(1): 2. DOI: 10.2174/1573399811666141216160217. |
| [8] | Ding L, Jin DZ, Chen XL. Luteolin enhances insulin sensitivity via activation of PPARγ transcriptional activity in adipocytes[J]. Journal of Nutritional Biochemistry, 2010, 21(10): 941-947. DOI: 10.1016/j.jnutbio.2009.07.009. |
| [9] | Lu HE, Chen Y, Sun XB, et al. Effects of luteolin on retinal oxidative stress and inflammation in diabetes[J]. Rsc Advances, 2014, 5(7): 4898-4904. |
| [10] |
刘振平. 糖脂毒性与胰岛β细胞功能衰竭[J].
中华老年多器官疾病杂志, 2010, 9(4): 377-380.
Liu ZP. Glucolipotoxicity withislet beta-cell failure[J]. Chinese Journal of Multiple Organ Diseases in the Elderly, 2010, 9(4): 377-380. DOI: 10.3969/j.issn.1671-5403.2010.04.028. |
| [11] | Liu JF, Ma Y, Wang Y, et al. Reduction of lipid accumulation in HepG2 cells by luteolin is associated with activation of AMPK and mitigation of oxidative stress[J]. Phytotherapy Research, 2011, 25(4): 588-596. DOI: 10.1002/ptr.3305. |
| [12] | Xi XH, Wang FW, Yan W, et al. Alteration of Wnt/β-catenin signaling pathway in early diabetic rat myocardium[J]. Chinese Pharmacological Bulletin, 2015, 31(3): 363-366. |
| [13] | Hsu YC, Lee PH, Lei CC, et al. Nitric oxide donors rescue diabetic nephropathy through oxidative-stress-and nitrosative-stress-mediated Wnt signaling pathways[J]. Journal of Diabetes Investigation, 2015, 6(1): 24-34. DOI: 10.1111/jdi.12244. |
| [14] | Gaudio A, Privitera F, Battaglia K, et al. Sclerostin levels associated with inhibition of the Wnt/β-catenin signaling and reduced bone turnover in type 2 diabetes mellitus[J]. J Clin Endocrinol Metab, 2012, 97(10): 3744-3750. DOI: 10.1210/jc.2012-1901. |
 2018, Vol. 39
2018, Vol. 39


