头颈部恶性肿瘤在亚洲东部较常见,特别好发于我国南方[1, 2]。放射治疗是主要的治疗手段[3, 4]。但放射治疗后正常组织晚期并发症多,造成患者的诸多困扰。其中最常见的是晚期皮肤纤维化,严重影响患者生活质量[5-7]。为减少其放疗后晚期皮肤反应,提高患者生活质量,有必要探索其细胞分子机制。
晚期皮肤反应主要是真皮发生的迟发不可逆反应,血管结构损伤及功能变化起重要作用。放射治疗后,血管内皮细胞分泌肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)、转化生长因子β1(transforming growth factor beta 1, TGF-β1)、环氧化酶2(cyclooxygenase-2, COX-2)[8],趋化因子4型受体(chemokine receptor type 4, CXCR4)[9]等,促进真皮内成纤维细胞聚集及产生胶原纤维及弹性纤维。过量的细胞外基质蛋白的产生及活化成纤维细胞的积累最终导致放疗后皮肤纤维化的发生发展[10]。但放疗后晚期血管损伤及皮肤纤维化的分子机制尚未阐明。
本研究拟建立内皮细胞EA.Hy926持续分泌炎症因子模型,为探讨放疗后血管损伤及晚期皮肤纤维化机制研究奠定基础。
1 材料与方法 1.1 主要试剂与仪器人脐静脉细胞融合细胞系EA.Hy926(中国科学院上海生命科学研究院细胞资源中心,目录号GNHu39),人非小细胞肺癌细胞系A549(中国科学院上海生命科学研究院细胞资源中心,目录号TCHu150);澳洲胎牛血清(美国GIBCO公司);Trizol裂解液(美国Invitrogen公司);RT real-time PCR试剂盒(中国TaKaRa公司);全细胞RIPA裂解液(江苏碧云天公司);PMSF蛋白酶抑制剂(瑞士罗氏);TGF-β1兔单克隆抗体(英国Abcam公司);COX2兔单克隆抗体(英国Abcam公司);TNFα鼠单克隆抗体(美国Santa Cruz公司);Tubilin β兔多克隆抗体(武汉三鹰公司);羊抗兔二抗(武汉三鹰公司);羊抗鼠二抗(武汉三鹰公司);荧光定量PCR仪(美国BIO-RAD公司);电泳仪(美国BIO-RAD公司);化学发光凝胶成像分析仪(美国BIO-RAD公司);Primus M医用直线加速器(德国Siemens公司)。
1.2 实验分组及处理人脐静脉融合细胞系EA.Hy926分实验组(2 Gy分割剂量的6 MV-X线2 Gy/F,5 F/W,总计40 Gy)和对照组(不进行照射,余与实验组EA.Hy926处理一样);人非小细胞肺癌细胞系A549分实验组(2 Gy分割剂量的6 MV-X线2 Gy/F,5 F/W,总计40 Gy)和对照组(不进行照射,余与实验组A549处理一样)。分别于照射期间及达到累计照射剂量40 Gy后1月,2月,3月,4月,5月提取细胞总RNA、总蛋白,置于-80 ℃冰箱保存。
1.3 细胞形态观察光镜下观察处理期间及处理结束后观察期间细胞形态变化。
1.4 荧光定量反转录多聚酶链反应(real-time RT PCR)检测TNF-α, TGF-β1, COX2, CXCR4 mRNA表达水平Trizol法提取细胞总RNA,参照逆转录试剂盒说明书进行逆转录,使用mRNA荧光定量试剂盒,将逆转录的cDNA进行Real time-PCR。设计引物序列
β-Actin: F 5′-GAA GAT CAA GAT CAT TGC TCC T-3′, β-Actin: R 5′-TAC TCC TGC TTG CTG ATC CA-3′; TGF-β1:F 5′-CAG CAA CAA TTC CTG GCG ATA-3′, TGF-β1: R 5′-AAG GCG AAA GCC CTC AAT TT-3′; TNF-α:F 5′-TCT TCT CGA ACC CCG AGT GA-3′, TNF-α: R 5′-CCT CTG ATG GCA CCA CCA G-3′; COX2:F 5′-TGA GCA TCT ACG GTT TGC TG-3′, COX2:R 5′-AAC TGC TCA TCA CCC CAT TC-3′; CXCR4:F 5′-ACT ACA CCG AGG AAA TGG GCT-3′, CXCR4:R 5′-CCC ACA ATG CCA GTT AAG AAGA-3′。
1.5 Western Blot法检测TNF-α, TGF-β1, COX2蛋白表达RIPA裂解液及PMSF蛋白酶抑制剂(罗氏)提取细胞总蛋白。Nanodrop 2000微量紫外分光光度计检测蛋白浓度。电泳条件:浓缩胶电压80 V,分离胶电压120 V;转膜条件(湿转):恒流200 mA 90 min;5%脱脂奶粉封闭90 min,一抗(适当比例稀释)4 ℃孵育过夜,TBST缓冲盐溶液(1×TBS+0.1%Tween 20) 洗膜10 min×3次,二抗(1:1 000倍稀释)室温作用2 h,TBST洗膜10 min×3次。ECL化学显色试剂盒显影,化学发光凝胶成像分析仪曝光成像。本实验设Tubulin β为内参照。
1.6 统计学处理数据以x±s表示。采用SPSS 17.0软件分析,组间比较采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结果 2.1 放射性血管损伤模型细胞形态学变化结果见图 1。200倍光学显微镜下观察,2 Gy分割剂量的X线(2 Gy/F,5 F/W,共40 Gy)作用于内皮细胞EA.Hy926及对照细胞A549后,细胞水肿明显,突触增多(光镜200倍);累计照射40 Gy后观察5月,细胞形态恢复正常。单纯培养1、3、5月后内皮细胞EA.Hy926及对照细胞A549形态,相较于未处理细胞无明显变化(光镜200倍)。

|
图 1 各组细胞镜下图片(×200) a.未处理的细胞形态;b. 2 Gy分割剂量的X线(2 Gy/F,5 F/W,共40 Gy)处理后细胞形态,细胞水肿明显,突触增多;c.X线累计照射40 Gy后观察5月,细胞形态恢复正常; d、e、f分别是单纯培养1、3、5月后细胞形态,与a图比较无明显变化 |
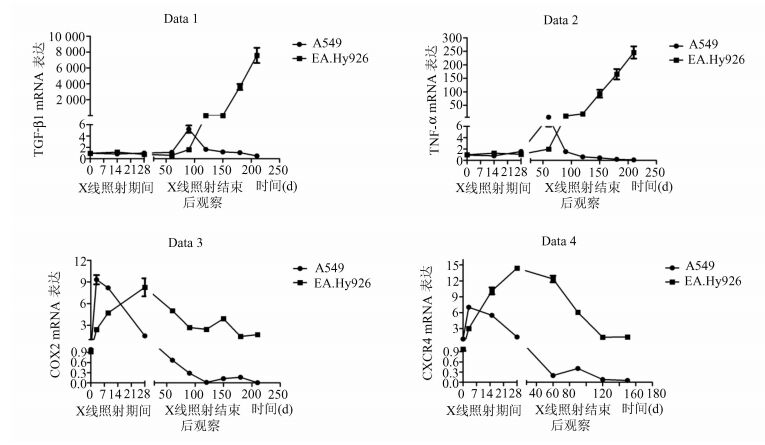
结果见图 2。接受2 Gy分割剂量的X线(2 Gy/F,5 F/W,共40 Gy)照射的EA.Hy926较未处理EA.Hy926,在X线照射期间分泌TGF-β1、TNF-α无变化,累计照射40 Gy后数月持续升高(P<0.05);接受同样X线照射的对照细胞A549较未处理A549,分泌TGF-β1、TNF-α仅在累计照射40 Gy后1-2月升高(P<0.05);重复测量方差分析提示时间因素与分组有交互作用(P<0.05)。故排除A549的影响,内皮细胞在40 Gy射线作用结束后3、4、5月,分泌TGF-β1、TNF-α升高。接受2 Gy分割剂量的X线(2 Gy/F,5 F/W,共40 Gy)照射的EA.Hy926较未处理EA.Hy926,在X线处理期间分泌COX2、CXCR4缓慢升高(P<0.05),累计照射40 Gy时达峰值,X线照射结束后数月缓慢降低,最终稳定于低水平升高状态(P<0.05);接受同样X线照射的对照细胞A549较未处理A549,在X线处理数天后分泌COX2、CXCR4升高(P<0.05),后持续降低(P<0.05);重复测量方差分析提示时间因素与分组有交互作用(P<0.05)。故排除A549的影响,内皮细胞分泌COX2、CXCR4在射线作用期间及结束后均升高。
|
图 2 放射性血管损伤模型炎症相关因子基因表达 内皮细胞EA.Hy926接受2 Gy分割剂量的X线(2 Gy/F,5F/W,共40 Gy)照射,TGF-β1、TNF-α、COX2、CXCR4基因水平相较未处理内皮细胞升高(P<0.05) |
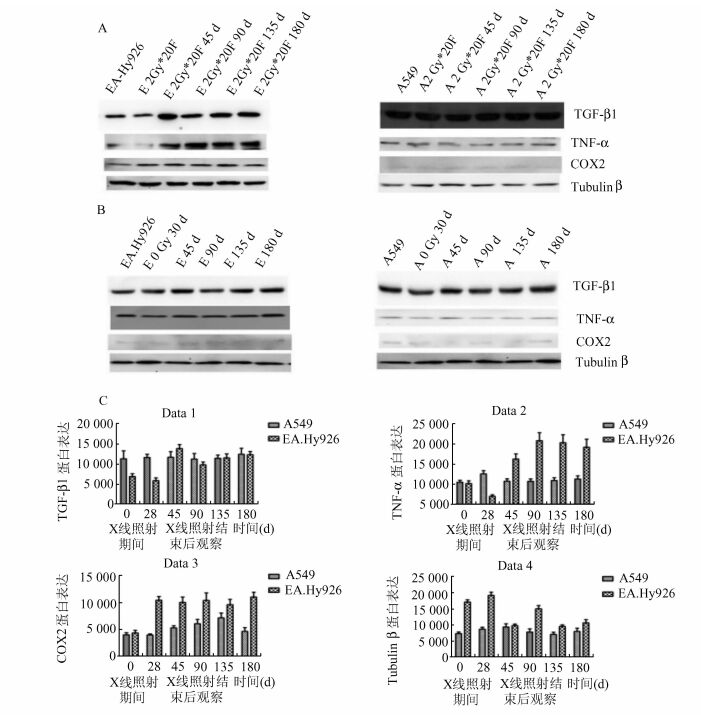
结果见图 3。内皮细胞EA.Hy926在累计照射40 Gy及X线照射结束后数月,炎症相关因子TGF-β1、TNF-α、COX2相较未处理内皮细胞均升高(P<0.05)。累计照射40 Gy后的对照细胞A549及未进行任何处理,单纯观察数月的内皮细胞EA.Hy926、对照细胞A549,炎症相关因子TGF-β1、TNF-α、COX2相较未处理细胞无明显变化。
|
图 3 放射性血管损伤模型炎症相关蛋白表达 A、C.内皮细胞EA.Hy926接受2 Gy分割剂量的X线(2 Gy/F,5 F/W,共40 Gy)照射,TGF-β1、TNF-α、COX2蛋白水平相较未处理内皮细胞升高(P<0.05);B.单纯观察数月的内皮细胞EA.Hy926、对照细胞A549,炎症相关因子TGF-β1、TNF-α、COX2蛋白水平相较未处理细胞无明显变化 |
放疗后晚期皮肤反应是真皮内过量的细胞外基质蛋白的产生及活化成纤维细胞的积累,最终导致放疗后皮肤纤维化的不可逆过程[10]。血管结构损伤及功能变化起重要作用[11]。EA.Hy926细胞是人脐静脉内皮细胞融合肺腺癌细胞A549形成的无限细胞系,具有血管生成、体内平衡/血栓形成、血压和炎症等分化的内皮细胞功能。本研究采用EA.Hy926细胞作为血管内皮细胞研究对象,A549细胞作为对照细胞排除其对血管内皮细胞特性的影响。
结果发现X线照射期间及照射结束后数月,血管内皮细胞分泌TNF-α、TGF-β1、COX-2以及CXCR4,初步表明X射线致EA.Hy926内皮细胞血管损伤模型可能构建成功。因血管内皮细胞衰老可产生促炎因子,影响内皮细胞黏附和招募炎性细胞[12, 13],故本研究对照组细胞单纯行传代培养,结果显示炎症相关因子较未处理内皮细胞无明显变化,排除了细胞老化对血管损伤模型构建的影响。X射线致EA.Hy926内皮细胞血管损伤模型构建成功。体外细胞实验表明,4 Gy 6 MV-X线照射微血管和大血管内皮细胞,导致细胞凋亡[14]。体内动物实验表明成年Wistar大鼠全脑在接受单次25 Gy照射后26周,内皮细胞数相较于对照组降低30%-40%;65周后血管密度显著减少[15]。本研究模拟常规分割剂量血管内皮细胞损伤,故采用2 Gy分割剂量的6 MV-X线(2 Gy/F,5F/W,总计40 Gy)照射人脐静脉融合细胞系EA.Hy926。
TGF-β超家族中的一种多功能蛋白,TGF-β1在血小板生成素诱导骨髓纤维化小鼠模型中起突出作用[16]。TGF-β1可通过与TGFβ R Ⅱ结合,启动smad通路促进纤维化的发生[17]。人类硬皮病小鼠模型中,局部使用P144阻断TGFβ R Ⅱ,可改善皮肤纤维化[18]。本研究血管损伤模型中内皮细胞持续分泌TGF-β1,促进皮肤纤维化的发生;同时TGFβ R Ⅱ持续升高,提示TGF-β1作用于TGFβ R Ⅱ,正反馈进一步加重皮肤纤维化的发生发展。
TNF-α是Carswell等人在1975年首先明确的内毒素致可使肿瘤坏死的血清因子[19]。它主要由巨噬细胞分泌,与TNFRSF1A/TNFR1、TNFRSF1B/TNFBR结合,诱导某些肿瘤细胞株的细胞死亡,一定条件下,它可以刺激细胞增殖、诱导细胞分化。动脉硬化致房颤的细胞质内TNF-α较窦性心律明显升高[20]。本研究血管损伤模型中内皮细胞持续分泌TNF-α,可能促进皮肤纤维化的发生。
COX-2是一种诱导型表达蛋白,主要表达于核膜,在正常生理状态下表达很少,当细胞受到相应刺激时表达增加。在慢性炎症的发生中起重要作用[21]。本研究血管损伤模型中内皮细胞持续分泌COX-2,促进皮肤慢性炎症及纤维化的发生。
CXCR4是目前已知的18个G蛋白偶联受体趋化因子之一,G蛋白偶联受体属于七个跨膜蛋白大家族之一,通过激活异三聚体G蛋白信号通路发挥作用[22]。CXCR4/SDF1α在有炎症成分的过敏性气道疾病中起重要作用[23]。上调基质细胞衍生因子1(SDF-1) 与CXCR4的相互作用,促进严重翼状胬肉病的发生[24]。敲除CXCR4基因小鼠,关节炎症发生减少[25]。本研究血管损伤模型中内皮细胞持续分泌CXCR4,可能促进皮肤纤维化的发生。
综上所述,放射性血管损伤细胞模型中,内皮细胞EA.Hy926在放疗结束后数月仍持续分泌炎症相关因子,且排除细胞衰老分泌炎症因子的可能,放疗后血管损伤模型构建成功。为后期研究放射性血管损伤及晚期皮肤纤维化的分子机制奠定基础。
| [1] | Gupta B, Johnson NW, Kumar N. Global epidemiology of head and neck cancers:A continuing challenge[J]. Oncology, 2016, 91(1): 13-23. DOI: 10.1159/000446117. |
| [2] | Zhang LF, Li YH, Xie SH, et al. Incidence trend of nasopharyngeal carcinoma from 1987 to 2011 in Sihui County, Guangdong Province, South China:an age-period-cohort analysis[J]. Chinese Journal of Cancer, 2015, 34(8): 350-357. |
| [3] | Bourhis J, Overgaard J, Audry H, et al. Hyperfractionated or accelerated radiotherapy in head and neck cancer:a meta-analysis[J]. Lancet, 2006, 368(9538): 843-854. DOI: 10.1016/S0140-6736(06)69121-6. |
| [4] | Nutting CM, Morden JP, Harrington KJ, et al. Parotid-sparing intensity modulated versus conventional radiotherapy in head and neck cancer(PARSPORT):a phase 3 multicentre randomised controlled trial[J]. Lancet Oncol, 2011, 12(2): 127-136. DOI: 10.1016/S1470-2045(10)70290-4. |
| [5] | Lockney NA, Friedman DN, Wexler LH, et al. Late Toxicities of intensity-modulated radiation therapy for head and neck rhabdomyosarcoma[J]. Pediatric Blood and Cancer, 2016, 63(9): 1608-1614. DOI: 10.1002/pbc.v63.9. |
| [6] | Zheng Y, Han F, Xiao W, et al. Analysis of late toxicity in nasopharyngeal carcinoma patients treated with intensity modulated radiation therapy[J]. Radiation Oncology, 2015, 10(10): 17. |
| [7] | Jagsi R, Griffith KA, Koelling T, et al. Stroke rates and risk factors in patients treated with radiation therapy for early-stage breast cancer[J]. J Clin Oncol, 2006, 24(18): 2779-2785. DOI: 10.1200/JCO.2005.04.0014. |
| [8] | Sun Q, Liu L, Roth M, et al. PRMT1 upregulated by epithelial proinflammatory cytokines participates in COX2 expression in fibroblasts and Chronic Antigen-Induced Pulmonary Inflammation[J]. J Immunol, 2015, 195(1): 298-306. DOI: 10.4049/jimmunol.1402465. |
| [9] | Furuse, Nonoguchi N, Kawabata S, et al. Delayed brain radiation necrosis: pathological review and new molecular targets for treatment[J]. Medical Molecular Morphology, 2015, 48(4): 183-190. DOI: 10.1007/s00795-015-0123-2. |
| [10] | Wynn TA, Ramalingam TR. Mechanisms of fibrosis: therapeutic translation for fibrotic disease[J]. Nature Medicine, , 18(7): 1028-1040. DOI: 10.1038/nm.2807. |
| [11] | Piera-Velazquez S, Mendoza FA, Jimenez SA. Endothelial to Mesenchymal Transition (EndoMT) in the Pathogenesis of Human Fibrotic Diseases[J]. Journal of Clinical Medicine, 2016, 5(4): 45. DOI: 10.3390/jcm5040045. |
| [12] | Garfinkel S, Brown S, Wessendorf JH, et al. Post-transcriptional regulation of interleukin la in various strains of young and senescent human umbilical vein endothelial cells[J]. Proc Natl Acad Sci USA, 1994, 91(4): 1559-1563. DOI: 10.1073/pnas.91.4.1559. |
| [13] | Mun GI, Boo YC. Identification of CD44 as a senescence-induced cell adhesion gene responsible for the enhanced monocyte recruitment to senescent endothelial cells[J]. Heart and Circulatory Physiology, 2010, 298(6): 2102-2111. DOI: 10.1152/ajpheart.00835.2009. |
| [14] | Eissner G, Kohlhuber F, Grell M. Critical Involvement of Transmembrane Tumor Necrosis Factor-cu in Endothelial Programmed Cell Death Mediated By Ionizing Radiation and Bacterial Endotoxin[J]. Blood, 1995, 86(11): 4184-4193. |
| [15] | Ljubimova NV, Levitman MK, Plotnikova ED, et al. Endothelial cell population dynamics in rat brain after local irradiation[J]. British Journal of Radiology, 1991, 64(766): 934-940. DOI: 10.1259/0007-1285-64-766-934. |
| [16] | Vannucchi AM, Bianchi L, Paoletti F, et al. A pathobiologic pathway linking thrombopoietin, GATA-1, and TGF-1 in the development of myelofibrosis[J]. Blood, 2005, 105(9): 3493-3501. DOI: 10.1182/blood-2004-04-1320. |
| [17] | Atfi A, Dumont E, Colland F, et al. The disintegrin and metalloproteinase ADAM12 contributes to TGF-β signaling through interaction with the type Ⅱ receptor[J]. J Cell Biol, 2007, 178(2): 201-208. DOI: 10.1083/jcb.200612046. |
| [18] | Santiago B, Gutierrez-Ca as I, Dotor J, et al. Topical application of a peptide inhibitor of transforming growth factor-b1 ameliorates bleomycin-induced skin fibrosis[J]. J Invest Dermatol, 2005, 125(3): 450-455. DOI: 10.1111/j.0022-202X.2005.23859.x. |
| [19] | Carswell EA, Old LJ, Kassel RL, et al. An endotoxin-induced serum factor that causes necrosis of tumors[J]. Proc Natl Acad Sci USA, 1975, 72(9): 3666-3670. DOI: 10.1073/pnas.72.9.3666. |
| [20] | Fu HY, Li G, Liu C, et al. Probucol prevents atrial remodeling by inhibiting oxidative stress and TNF-α/NF-κB/TGF-β signal transduction pathway in alloxan-induced diabetic rabbits[J]. J Cardiovasc Electrophysiol, 2015, 26(2): 211-222. DOI: 10.1111/jce.2015.26.issue-2. |
| [21] | Kam PC, See AU. Cyclo-oxygenase isoenzymes: physiological and pharmacological role[J]. Anaesthesia, 2000, 55(5): 442-449. DOI: 10.1046/j.1365-2044.2000.01271.x. |
| [22] | Bachelerie F, Ben-Baruch A, Burkhardt AM, et al. International Union of Pharmacology. LXXXIX. Update on the Extended Family of Chemokine Receptors and Introducing a New Nomenclature for Atypical Chemokine Receptors[J]. Pharmacological Reviews, 2013, 66(1): 1-79. DOI: 10.1124/pr.113.007724. |
| [23] | Gonzalo JA, Lloyd CM, Peled A, et al. Critical involvement of the chemotactic axis CXCR4/stromal cell-derived factor-1α in the inflammatory component of allergic airway disease[J]. J Immunol, 2000, 165(1): 499-508. DOI: 10.4049/jimmunol.165.1.499. |
| [24] | Kim KW, Park SH, Lee SH, et al. Upregulated stromal cell-derived factor 1 (SDF-1) expression and its interaction with CXCR4 contribute to the pathogenesis of severe pterygia[J]. Invest Ophthalmol Vis Sci, 2013, 54(12): 7198-7206. DOI: 10.1167/iovs.13-13044. |
| [25] | Chung SH, Seki K, Choi BI, et al. CXC chemokine receptor 4 expressed in T cells plays an important role in the development of collagen-induced arthritis[J]. Arthritis Res Ther, 2010, 12(5): R188. DOI: 10.1186/ar3158. |
 2017, Vol. 38
2017, Vol. 38

