特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是最常见的弥漫性肺纤维化疾病[1],是一种持续性进展、不可逆的并且致命的慢性肺部疾病。至今病因未明,中位生存期仅2.5-3.5年,目前缺乏有效的治疗手段及治疗药物[2]。据流行病学资料统计,近年来其发病率有上升趋势[3]。上皮-间质转化(epithelial-mesenchymal transition,EMT)是IPF重要的发病机制,肺泡上皮细胞受到各种致病因素的刺激,获得间质细胞的表型,是成纤维细胞及肌成纤维细胞的重要来源[4]。白细胞介素(interleukin, IL)-17是一种具有多效性的细胞因子,与心[5]、肝[6]、肾[7]、肠[8]等器官及组织的纤维化相关,最近研究表明IL-17与肺纤维化的发病机制有关[9],具有促进肺成纤维细胞增殖、转化及诱导EMT发生的作用,其作用机制是通过转化生长因子(trforming growth factor, TGF)-β1来调节EMT[9, 10]。TGF-β1在肺纤维化中起重要作用[11],是EMT中的关键因子。Smad2信号通路是TGF-β1作用的经典通路之一,在细胞内TGF-β1与其受体形成复合物,进而作用于Smad2,使TGF-β1发挥重要的生物学效应作用[12]。因此我们推测IL-17可能通过TGF-β1/Smad2信号通路调节EMT,进而导致肺纤维化。
本研究通过体外培养人肺泡上皮细胞来源的A549细胞,给予IL-17刺激,证实IL-17致EMT的作用,并探讨其信号转导通路,为进一步研究IPF的分子生物学机制及寻找抗纤维化治疗新靶点提供实验基础。
1 材料与方法 1.1 主要实验材料和试剂A549细胞株购自中国科学院上海细胞库;RMPI-1640培养基购自美国Hyclone公司;胎牛血清购自浙江四季青公司;0.25%胰酶、PBS均购自杭州吉诺公司;BCA蛋白浓度测定试剂盒购自美国Thermo公司;单克隆兔抗人E-钙黏蛋白(E-cadherin, E-cad),E-cad抗体、α-平滑肌肌动蛋白(SMA)抗体、TGF-β1抗体均购自英国Abcam公司;单克隆兔抗人p-Smad2、Smad2抗体均购自美国Cell Signaling Technology公司;HRP标记羊抗兔二抗购自武汉博士德生物工程有限公司;重组人IL-17购自美国Peprotech公司;TGF-β1受体抑制剂SB431542购自美国Selleckchem公司;EASYspin组织/细胞RNA快速提取试剂盒购自北京艾德莱公司;逆转录试剂盒、SYBR Premix Ex TaqTMⅡ均购自日本TaKaRa公司。
1.2 细胞的培养及分组A549细胞于含10%胎牛血清、100 U/ml青霉素及100 mg/L链霉素的RMPI-1640完全培养基中,37 ℃、5% CO2及饱和湿度条件下常规培养,隔天换液,至细胞融合度达到75%-80%时,用0.25%胰酶消化传代。
将传代的A549细胞接种于6孔板中,分为5组,待细胞融合度达到70%后分别加入终浓度为0, 10, 25, 50, 100 ng/ml IL-17处理,作用48 h,观察不同浓度IL-17诱导的E-cad、α-SMA和TGF-β1的mRNA表达的影响。
将传代的A549细胞分为:对照组(RMPI-1640培养液)、IL-17组(RMPI-1640培养液中加入100 ng/ml IL-17)、IL-17+SB431542组(RMPI-1640培养液中加入10 μmo/L SB431542处理1 h后,加入100 ng/ml IL-17)。作用48 h后观察IL-17组及IL-17+SB431542组对E-cad和α-SMA的mRNA和蛋白表达的影响,IL-17组及IL-17+SB431542组对TGF-β1、p-Smad2、Smad2蛋白表达的变化。
1.3 RT-PCR法检测E-cad、α-SMA和TGF-β1的mRNA表达收集处理好的细胞,按照RNA试剂盒说明书提取总RNA,紫外分光光度法检测含量和纯度,1.5%琼脂糖电泳检测RNA完整性。根据TaKaRa逆转录试剂盒采用两步法将样品逆转录成cDNA。按照SYBR Premix Ex TaqTMⅡ (TaKaRa)试剂盒说明书操作,特异性引物序列见表 1,由天一辉远生物工程(北京)股份有限公司合成。在PCR仪(Bio-Rad)上进行实时定量PCR反应,反应条件为:95 ℃预变性2 min,95 ℃变性5 s,60 ℃退火30 s,40个循环。采用2-ΔΔct法,以GAPDH为参照,定量E-cad、α-SMA和TGF-β1的mRNA变化。
| 表 1 引物的序列 |
收集处理后的细胞,加入细胞裂解液于冰上裂解细胞并提取总蛋白,用BCA试剂盒测定蛋白浓度,SDS-PAGE凝胶电泳分离蛋白质。将凝胶上的蛋白转到PVDF膜,5%脱脂奶粉室温下封闭2 h。采用单克隆兔抗人E-cad、α-SMA、TGF-β1等4 ℃孵育过夜。TBST溶液漂洗3次,每次10 min。分别加入HRP标记羊抗兔二抗常温孵育2 h。TBST溶液漂洗如前,ECL显影,应用AlphaEaseFC成像分析系统分析各条带并记录光密度强度,分析实验结果。
1.5 统计学分析采用SPSS 20.0统计分析软件分析数据,多组间比较采用单因素方差分析,两组间比较用t检验,检验结果以P<0.05为差异有统计学意义。
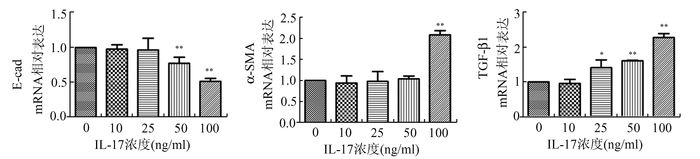
2 结果 2.1 不同浓度IL-17对A549细胞E-cad、α-SMA、TGF-β1的mRNA的影响与对照组比较,E-cad的表达在IL-17浓度为50 ng/ml时开始下调(P<0.01),处理组随着IL-17浓度的增加E-cad表达下调,与浓度呈负相关;而α-SMA的表达在IL-17浓度为100 ng/ml时表达上调(P<0.01);同时TGF-β1的表达在IL-17浓度为25 ng/ml时开始上升(P<0.05),随着IL-17浓度的增加TGF-β1表达上调,与浓度呈正相关,与对照组比较差异有统计学意义(P<0.01)。结果表明,IL-17能调节EMT相关mRNA的变化,并且浓度为100 ng/ml时EMT变化最明显,故后续试验IL-17选用100 ng/ml作为工作浓度;随着IL-17浓度的增加,TGF-β1的表达上调,提示IL-17诱导EMT可能与TGF-β1的表达上调有关。
|
图 1 不同浓度IL-17对A549细胞E-cad、α-SMA、TGF-β1的mRNA的影响 与对照组比较, *P<0.05,与对照组比较, **P<0.01 |
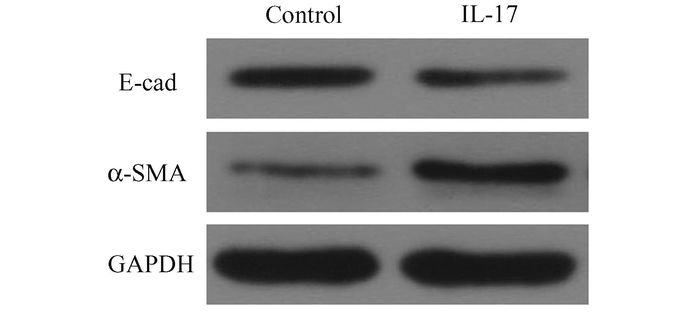
用100 ng/ml IL-17作用A549细胞48 h后,检测E-cad、α-SMA蛋白表达。与对照组相比,IL-17组E-cad表达下调,α-SMA表达上调。结果表明,IL-17能调节EMT相关蛋白的变化,能诱导EMT发生(图 2)。
|
图 2 IL-17对A549细胞E-cad、α-SMA蛋白的影响 Control:对照组;IL-17:IL-17诱导干预组 |
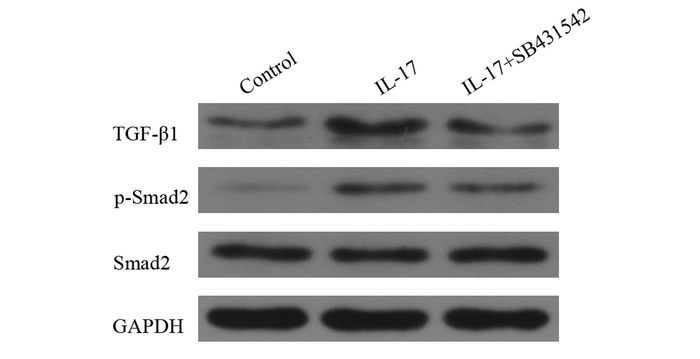
与对照组比较,IL-17组TGF-β1、p-Smad2表达增加,Smad2表达无明显变化;结果表明IL-17能激活A549细胞中的TGF-β1/Smad2信号通路;为进一步论证TGF-β1/Smad2信号通路在其中的作用,加入TGF-β1受体抑制剂(SB431542) 后,与IL-17组相比,TGF-β1、p-Smad2表达下调,Smad2表达无明显变化,证实SB431542能抑制TGF-β1/Smad2信号通路,见图 3。
|
图 3 IL-17对A549细胞TGF-β1/Smad2信号通路蛋白的影响 Control:对照组;IL-17:IL-17诱导干预组;IL-17+SB431542: IL-17+TGF-β1受体抑制剂组(SB431542) |
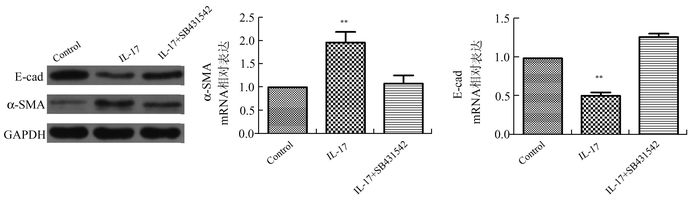
为进一步研究TGF-β1/Smad2信号通路对IL-17诱导A549细胞的作用,我们用TGF-β1受体抑制剂(SB431542) 将TGF-β1/Smad2信号通路抑制后,观察IL-17诱导A549细胞EMT相关mRNA和蛋白表达的影响。结果显示,与IL-17组比较,加入抑制剂后E-cad的mRNA和蛋白表达均增加,α-SMA的mRNA和蛋白表达均下降(P<0.01),表明SB431542能部分抑制IL-17诱导A549细胞EMT相关的表达,说明IL-17可以通过激活TGF-β1/Smad2信号通路诱导A549细胞发生EMT,见图 4。
|
图 4 抑制TGF-β1/Smad2信号通路后,观察IL-17对EMT相关mRNA和蛋白的影响 与其他组比较, **P<0.01 |
IPF的发病机制非常复杂,至今尚未完全明确[13, 14],成纤维细胞在IPF病因中发挥重要作用,EMT是肺成纤维细胞重要的来源之一[15, 16],并且在IPF的发病机制研究中,EMT也越来越受到重视[17]。
研究表明IL-17参与调控EMT相关基因的表达[18]。IL-17细胞因子家族包括IL-17A、IL-17B、IL-17C、IL-17D、IL-17E、IL-17F 6个成员, 其中IL-17A是该家族的标志性细胞因子,简称IL-17。IL-17是一种具有多效性的细胞因子,可以作用于多种细胞增强炎性分子的表达,并且与多种器官的纤维化相关。IL-17通过促进心肌成纤维细胞增殖和迁移而加速心肌纤维化的发展[5];同时可以通过诱导炎性细胞因子和TGF-β1的表达促进肝纤维化[6]。有研究发现在IPF患者的支气管肺泡灌洗液体中,IL-17有所增加,表明IL-17与肺纤维化的发病机制有关[19]。博来霉素诱导IL-17产生高度依赖于TGF-β1的信号。重组IL-17诱导的纤维化依赖于TGF-β1途径,证实了IL-17和TGF-β1在肺纤维化的发展中是相互依赖的[20]。Mi等[9]研究发现IL-17促进成纤维细胞大量合成细胞外基质,阻断IL-17可以显著降低肺纤维化的严重程度,其机制是通过TGF-β1依赖的信号通路而减轻EMT过程。因此,我们推测IL-17可能通过上调TGF-β1的表达诱导EMT。
培养肺泡Ⅱ型上皮细胞是研究其特性的重要手段,由于它培养后表型丧失快,基本不传代,并且培养难度较大,不易获得较高纯度、理想的肺泡Ⅱ型上皮细胞,而A549细胞具有肺泡Ⅱ型上皮细胞的重要特性,因此本研究使用A549细胞系代替肺泡Ⅱ型上皮细胞。预实验中,为摸索IL-17诱导A549细胞发生EMT的最适浓度,我们设置了0,10,25,50,100 ng/ml 5个组,用RT-PCR检测,结果显示IL-17浓度为50 ng/ml时,E-cad表达开始下调,浓度为100 ng/ml时α-SMA表达上调,通过Western Blot检测也证实了浓度为100 ng/ml时IL-17可以有效的诱导A549细胞发生EMT,与Gu等[21]研究一致。因此本实验采用100 ng/ml IL-17建模。实验还发现IL-17上调TGF-β1的表达,且TGF-β1的表达与IL-17浓度正相关,表明IL-17可能通过上调TGF-β1的表达诱导EMT,与Meng等[6]得出的结论一致。此外我们发现IL-17能激活Smad2磷酸化,为进一步论证TGF-β1/Smad2信号通路在IL-17诱导EMT中的作用,我们通过TGF-β1特异性受体抑制剂SB431542抑制TGF-β1/Smad2通路,发现抑制该通路能抑制IL-17对EMT相关mRNA和蛋白的表达。
本研究明确了IL-17能诱导A549细胞发生EMT的作用。同时证明了TGF-β1/Smad2信号通路在该过程中发挥了重要作用,我们可以考虑以此作为抑制IPF的新靶点。本实验中使用了通路抑制剂来证明研究假设,提示通路抑制剂具有减弱A549细胞发生EMT的作用,对于IPF的特异性治疗药物的开发和研究具有重要的意义。
| [1] | Borensztajn K, Crestani B, Kolb M. Idiopathic pulmonary fibrosis: from epithelial injury to biomarkers--insights from the bench side[J]. Respiration, 2013, 86(6): 441-452. DOI: 10.1159/000357598. |
| [2] | King TE, Pardo A, Selman M. Idiopathic pulmonary fibrosis[J]. Lancet, 2011, 378(9807): 1949-1961. DOI: 10.1016/S0140-6736(11)60052-4. |
| [3] | Navaratnam V, Fogarty AW, Glendening R, et al. The increasing secondary care burden of idiopathic pulmonary fibrosis: hospital admission trends in England from 1998 to 2010[J]. Chest, 2013, 143(4): 1078-1084. DOI: 10.1378/chest.12-0803. |
| [4] | Kalluri R. EMT: when epithelial cells decide to become mesenchymal-like cells[J]. J Clin Invest, 2009, 119(6): 1417-1419. DOI: 10.1172/JCI39675. |
| [5] | Valente AJ, Yoshida T, Gardner JD, et al. Interleukin-17A stimulates cardiac fibroblast proliferation and migration via negative regulation of the dual-specificity phosphatase MKP-1/DUSP-1[J]. Cell Signal, 2012, 24(2): 560-568. DOI: 10.1016/j.cellsig.2011.10.010. |
| [6] | Meng F, Wang K, Aoyama T, et al. Interleukin-17 signaling in inflammatory, Kupffer cells, and hepatic stellate cells exacerbates liver fibrosis in mice[J]. Gastroenterology, 2012, 143(3): 765-776. DOI: 10.1053/j.gastro.2012.05.049. |
| [7] | Liu L, Li FG, Yang M, et al. Effect of pro-inflammatory interleukin-17A on epithelial cell phenotype inversion in HK-2 cells in vitro[J]. Eur Cytokine Netw, 2016, 27(2): 27-33. |
| [8] | Biancheri P, Pender SL, Ammoscato F, et al. The role of interleukin 17 in Crohn's disease-associated intestinal fibrosis[J]. Fibrogenesis Tissue Repair, 2013, 6(1): 13. DOI: 10.1186/1755-1536-6-13. |
| [9] | Mi S, Li Z, Yang HZ, et al. Blocking IL-17A promotes the resolution of pulmonary inflammation and fibrosis via TGF-beta1-dependent and -independent mechanisms[J]. J Immunol, 2011, 187(6): 3003-3014. DOI: 10.4049/jimmunol.1004081. |
| [10] | Vittal R, Fan L, Greenspan DS, et al. IL-17 induces type V collagen overexpression and EMT via TGF-beta-dependent pathways in obliterative bronchiolitis[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 304(6): L401-L414. DOI: 10.1152/ajplung.00080.2012. |
| [11] | Wolters PJ, Collard HR, Jones KD. Pathogenesis of idiopathic pulmonary fibrosis[J]. Annu Rev Pathol, 2014, 9: 157-179. DOI: 10.1146/annurev-pathol-012513-104706. |
| [12] | Heldin CH, Moustakas A. Role of Smads in TGFbeta signaling[J]. Cell Tissue Res, 2012, 347(1): 21-36. DOI: 10.1007/s00441-011-1190-x. |
| [13] | Castriotta RJ, Eldadah BA, Foster WM, et al. Workshop on idiopathic pulmonary fibrosis in older adults[J]. Chest, 2010, 138(3): 693-703. DOI: 10.1378/chest.09-3006. |
| [14] | Collard HR, Loyd JE, King TE Jr., et al. Current diagnosis and management of idiopathic pulmonary fibrosis: a survey of academic physicians[J]. Respir Med, 2007, 101(9): 2011-2016. DOI: 10.1016/j.rmed.2007.03.012. |
| [15] | Hinz B, Phan SH, Thannickal VJ, et al. The myofibroblast: one function, multiple origins[J]. Am J Pathol, 2007, 170(6): 1807-1816. DOI: 10.2353/ajpath.2007.070112. |
| [16] | Bartis D, Mise N, Mahida RY, et al. Epithelial-mesenchymal transition in lung development and disease: does it exist and is it important[J]. ? Thorax, 2014, 69(8): 760-765. DOI: 10.1136/thoraxjnl-2013-204608. |
| [17] | Kage H, Borok Z. EMT and interstitial lung disease: a mysterious relationship[J]. Curr Opin Pulm Med, 2012, 18(5): 517-523. |
| [18] | Dudas PL, Sague SL, Elloso MM, et al. Proinflammatory/profibrotic effects of interleukin-17A on human proximal tubule epithelium[J]. Nephron Exp Nephrol, 2011, 117(4): e114-e123. DOI: 10.1159/000320177. |
| [19] | Simonian PL, Roark CL, Wehrmann F, et al. Th17-polarized immune response in a murine model of hypersensitivity pneumonitis and lung fibrosis[J]. J Immunol, 2009, 182(1): 657-665. DOI: 10.4049/jimmunol.182.1.657. |
| [20] | Wilson MS, Madala SK, Ramalingam TR, et al. Bleomycin and IL-1beta-mediated pulmonary fibrosis is IL-17A dependent[J]. J Exp Med, 2010, 207(3): 535-552. DOI: 10.1084/jem.20092121. |
| [21] | Gu K, Li MM, Shen J, et al. Interleukin-17-induced EMT promotes lung cancer cell migration and invasion via NF-kappaB/ZEB1 signal pathway[J]. Am J Cancer Res, 2015, 5(3): 1169-1179. |
 2017, Vol. 38
2017, Vol. 38

 ,
,