骨肉瘤是青少年和儿童期常见的原发恶性骨肿瘤,侵袭转移能力强,最常见的转移部位为肺,致死率高[1]。尽管新辅助化疗使骨肉瘤患者的5年生存率提高到60%-70%,但是,随着化疗的耐药和毒副作用等问题出现,骨肉瘤传统治疗方法已进入平台期[2]。研究表明,骨肉瘤患者一旦出现复发或者转移,其远期生存率将小于20%[3]。miRNA(miR)在骨肉瘤发生发展中的机制研究已经成为热点之一,有报道显示,miR-99a在肝癌[4]、乳腺癌[5]、卵巢癌[6]和膀胱癌[7]等癌细胞中均低表达,上调miR-99a水平,这些肿瘤细胞的生物学特性被不同程度的抑制。
本课题组前期研究已发现,miR-99a在骨肉瘤细胞中表达量比正常成骨细胞高16倍[[8],本研究拟进一步检测miR-99a在肿瘤组织及正常组织中的表达差异,观察下调miR-99a水平对骨肉瘤的生物行为学特点的影响,以期能为诊断骨肉瘤和发现肿瘤转移提供新的理论依据。
1 方法与材料 1.1 材料与试剂人骨肉瘤143B、MG-63和U2OS细胞株, 由本实验室提供;has-miR-99a-inhibitor和miRNA阴性对照物(negative control)购自广州锐博生物科技有限公司(Ribobio),Lipofectamine 2000TM(Invitrogen公司);DEPC水,75%乙醇,异丙醇,氯仿,DMEM培养基,胎牛血清,0.25%胰蛋白酶-EDTA消化液,PBS缓冲液,二甲基亚砜,移液器,去RNA酶EP管,离心管,培养板,BD transwell小室,Matrigel基质胶,Opti-MEMI无血清培养基、CCK8试剂盒,AnnexinV-FITC细胞凋亡检测试剂盒等均由华联科生物有限公司提供;细胞培养箱,倒置显微镜,超速离心机,酶标仪器,水浴锅和流式细胞仪等均由武汉大学中南医院科研中心提供。
1.2 方法 1.2.1 细胞培养及瞬时转染将人骨肉瘤细胞系143B、MG-63、U2OS、肝癌细胞系hepG2、结肠癌细胞系lovo用含10%FBS的DMEM培养基,hFOB1.19采用含10%FBS DMEM-F12(Hams)培养基,乳腺癌细胞系MCF-7和肺癌细胞系A549采用含10%FBS的RPMI 1640培养基,在37 ℃、5%CO2的细胞培养箱内培养。调整143B细胞为合适浓度,向孔板中加入细胞悬液,置于培养箱中培养,待贴壁细胞达到70%-90%时进行瞬时转染实验。实验分组:实验组(骨肉瘤143B细胞转染miR-99a inhibitor)、阴性对照组(转染inhibitor NC)和空白对照组(加入PBS作为对照),miR-99a inhibitor转染浓度为150 nmol/L。
1.2.2 实时荧光定量PCR检测miRNA143B细胞在转染48 h后,按照Trizol一步法提取各组细胞总RNA量,琼脂糖凝胶电泳检测RNA的质量和浓度。引物序列为:miR-99a(F):5′-AACCCGTAGATCCGATCTTGTG-3′, miR-99a(R):3′-TGGTGTCGTGGAGTC G-3′ [5]。以U6作为内参,按照逆转录试剂盒说明书进行逆转录,取逆转录产物进行PCR扩增,每个样本均进行miR-99a和U6的RT-PCR反应,计算各样本的miR-99a表达量。
1.2.3 CCK-8检测细胞增殖实验分组:实验组(转染miR-99a inhibitor)、阴性对照组(转染inhibitor NC),空白对照组,并设置只含培养基而无细胞的调零组,miR-99a inhibitor转染浓度为150 nmol/L,调整细胞浓度为1×104/L,在96孔板每孔加入100 μl细胞悬液,置于37 ℃,5% CO2培养箱预培养,转染miR-99a inhibitor及阴性对照物,待转染1, 2, 3, 4 d后分别检测增殖,向每孔中加入10 μl CCK8溶液,注意不要生成气泡,将培养板置于培养箱内继续孵育1-4 h,用酶标仪测定各孔450 nm处吸光度值(OD值)。
1.2.4 流式细胞仪检测细胞凋亡将各组转染48 h后细胞用不含EDTA的胰酶消化,用PBS重悬,调整细胞浓度为1×106个/ml,用PBS洗涤、离心2遍,弃上清,加缓冲液重悬细胞,然后依次加入加入10 μl Annexin V-FITC和10 μl碘化丙啶染色液,轻轻混匀,室温避光孵育20 min,置于冰水浴中,随即流式细胞仪检测。
1.2.5 划痕试验检测细胞迁移用记号笔在6孔板背后划横线,每0.5-1.0 cm一道,共5条,按上述方法进行铺板、转染,转染24 h后用枪头比着直尺,垂直于背后横线划痕,用PBS洗涤3次,保证划痕下无细胞,加入无血清培养基,置于培养箱继续培养,按0, 12 h取出拍照。
1.2.6 Transwell小室法检测细胞侵袭将基质胶用Opti-MEMI无血清培养基按1:8稀释,试验前1 d铺胶。细胞转染48 h后,用无血清培养基重悬,调整细胞密度为1×105个/ml,取200 μl加入Transwell小室上室中,在下室中加入600 μl完全培养基。在37 ℃,5%CO2的培养箱中孵育12 h,取出小室,用棉签抹去上层细胞,用95%乙醇固定15 min,结晶紫染色10 min,在显微镜下观察,随机取6个视野,统计各组穿过基质膜的细胞个数。
1.2.7 Western Blotting实验① 制备蛋白样品:弃掉培养基,并用预冷的PBS洗涤,胰蛋白酶消化收集细胞,4 ℃,1 000 g离心5 min,用预冷PBS液重悬细胞,室温、1 000 r/min离心5 min,弃净PBS液后EP管置于冰上;在蛋白裂解液中加入PMSF,裂解30 min,4 ℃、12 000 r/min离心15 min,弃掉上清液,-20 ℃保存。②测定蛋白样品浓度,采用BCA蛋白浓度检测试剂盒测定样品蛋白的浓度;③样品蛋白含量检测:取96孔板,3孔为一组,作为复孔,在每孔中加入2 μl蛋白样品和18 μl的裂解液,用移液器吹打,充分混合均匀,加配制好的BCA工作液,酶标仪检测A570值,取复孔读数值的平均,根据标准曲线计算真实蛋白浓度。④SDS-PAGE电泳;⑤转膜;⑥免疫反应;⑦化学发光、显影、定影;⑧凝胶图像分析。
1.2.8 统计学处理采用SPSS 18.0软件处理和分析数据,计量资料以均数±标准差(x±s)形式表示,采用非参数检验分析qRT-PCR实验结果,χ2检验分析流式细胞数据,采用单因素方差分析多个样本均数,组间比较采用t检验,以P<0.05为差异有统计学意义。采用Graphpad Prism 5.0软件绘制图表。
2 结果 2.1 miR-99a在骨肉瘤组织中表达明显上调为研究miR-99a在骨肉瘤中的作用,本课题首先探索miR-99a在骨肉瘤中的表达情况,本研究采用RT-PCR技术检测了miR-99a在骨肉瘤组织与瘤旁骨组织中的相对表达量,miR-99a在7例骨肉瘤组织中的相对表达量(0.81±0.06)要明显高于瘤旁骨组织(0.48±0.06) (P<0.01, 见图 1)。
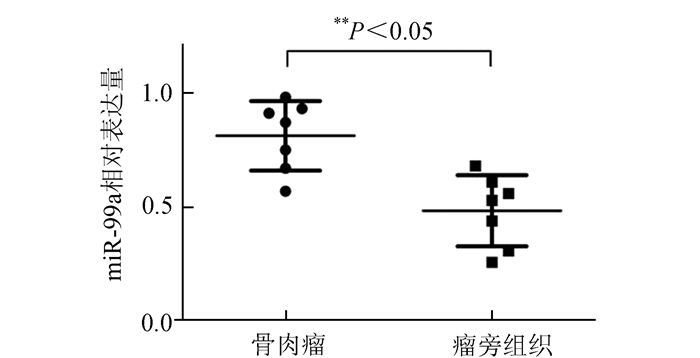
|
图 1 miR-99a在骨肉瘤组织与瘤旁骨组织中的表达 |
3组骨肉瘤细胞系miR-99a表达量均高于人成骨细胞hFOB1.19,差异有显著统计学意义(P<0.01,见图 2),miR-99a在三组骨肉瘤细胞系表达差异无统计学意义。
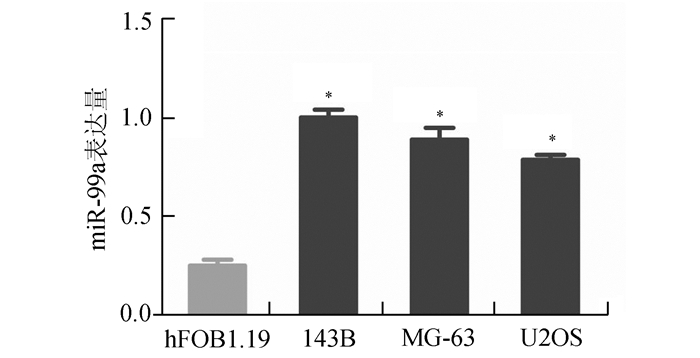
|
图 2 miR-99a在骨肉瘤细胞系中相对表达量高于成骨细胞系 4组细胞系miR-99a相对表达量分别为,hFOB1.19(0.26±0.01)、143B(1.01±0.02)、MG-63(0.91±0.03)和U2OS(0.80±0.01);与hFOB1.19相比, *P<0.05 |
本课题取miR-99a相对表达量最高的143B作为研究对象,再以其他非骨肉瘤肿瘤细胞系作为对照研究,检测结果显示骨肉瘤细胞系143B中miR-99a相对表达明显高于四种非骨肉瘤细胞系(P<0.05,见图 3)。
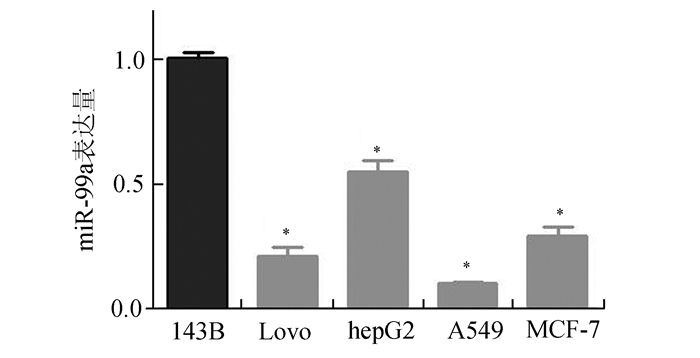
|
图 3 miR-99a在骨肉瘤细胞系中相对表达高于其他肿瘤细胞系 143B (1.00±0.01, n=3)、Lovo(0.21±0.03)、hepG2(0.55±0.03)、A549(0.10±0.01)和MCF-7(0.29±0.02);与143B细胞系组相比, *P<0.05 |
骨肉瘤143B细胞转染miR-99a inhibitor 48 h后,RT-PCR结果显示,miR-99a inhibitor的瞬时转染效率83%。流式细胞术分析显示,与空白对照组、阴性对照组相比,miR-99a inhibitor转染组早期凋亡和晚期凋亡均未明显增加(P>0.05)。
2.5 miR-99a抑制物对骨肉瘤143B细胞迁移能力影响划痕试验结果表明,0, 24 h时间点细胞迁移能力对比显示,瞬时转染miR-99a inhibitor的143B细胞迁移能力明显低于阴性对照组和空白对照组(P<0.05),实验组的迁移抑制率为35.8%(图 4)。

|
图 4 下调miR-99a后,划痕实验检测骨肉瘤143B细胞迁移能力 |
Transwell小室结果表明,miR-99a inhibitor转染组143B细胞穿过小室底膜的数目明显低于阴性对照组和空白对照组,这提示,下调miR-99a表达后,143B细胞的侵袭能力得到抑制。见图 5。
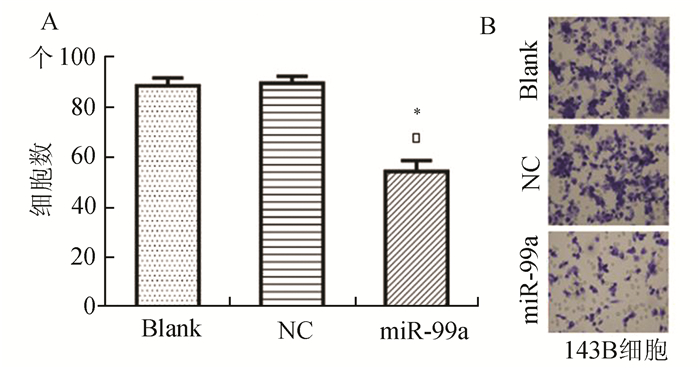
|
图 5 3组143B细胞侵袭能力实验结果 A: miR-99a inhibitor转染组143B细胞穿过小室底膜的数目明显低于NC组和Blank组,*P<0.05; B:×400 |
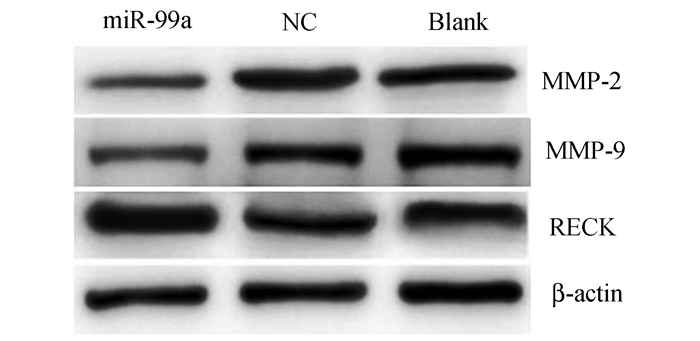
将miR-99a inhibitor(150 nnmol/L)瞬时转染至骨肉瘤143B细胞48 h后,Western Blotting检测蛋白RECK、MMP-2和MMP-9蛋白的表达,与阴性对照组和空白对照组相比,miR-99a inhibitor组RECK蛋白明显上调,MMP-2和MMP-9蛋白分别下调,差异有统计学意义(P<0.05,图 6)。
|
图 6 miR-99a抑制物转染对骨肉瘤143B细胞RECK、MMP-2和MMP-9蛋白表达的影响 miR-99a:miR-99a inhibitor组; NC:阴性对照组; Blank:空白对照组 |
同大多数恶性肿瘤转移机制类似,骨肉瘤细胞的转移需从细胞脱离原发病灶开始,然后进入血液及淋巴系统,逃避体内清除机制,最终进入特定的组织器官,逐渐增殖并形成转移病灶。miRNA是一种内源性、非编码的小片段RNA,近年来研究发现,miRNA可能作为诊断肿瘤以及评估骨肉瘤细胞转移的一个新的指标[9]。
本研究首先采用RT-PCR技术检测了miR-99a在骨肉瘤组织与瘤旁骨组织中的相对表达量,miR-99a在骨肉瘤组织中的相对表达量要明显高于瘤旁骨组织,从临床病理学角度发现miR-99a与骨肉瘤存在一定联系;采用RT-PCR技术检测miR-99a在骨肉瘤细胞系143B、MG-63和U2OS中的相对表达量,以人成骨细胞系hFOB1.19作为对照,结果显示,3组骨肉瘤细胞系miR-99a表达量均高于人成骨细胞hFOB1.19。2014年波士顿召开的第十届关于miRNA的大会,专门讨论miRNA在肿瘤早期诊断和预后估计中的应用前景,多项研究表明相关miRNA对胰腺癌[10]、结直肠癌[11]和骨肉瘤具有早期诊断价值[12]。Mishra等[13]认为,在恶性肿瘤组织中,致癌miRNA呈高表达,抑癌miRNA呈低表达,而且miRNA具有组织特异性,可以作为鉴别原发肿瘤和类型的重要标志物。越来越多的临床研究报道显示[10],某些miRNA在人血清和瘤体组织中的特异性表达。Ma等[14]采用RT-PCR检测89个骨肉瘤患者血液循环中miR-148a表达水平,与健康人群相比显著升高,而且,miR-148a表达水平越高,骨肉瘤患者5年生存率越低。Xu等[15]研究发现miR-9在骨肉瘤组织中表达水平高于瘤旁组织,miR-9的高表达与骨肉瘤患者的生存率呈负相关,与肿瘤转移和临床分级呈正相关。此外,Challagundla等[16]研究显示,在肿瘤微环境中,瘤旁组织能以外泌体(exosomes)的形式分泌miRNA,这些外泌体肿瘤细胞周围的免疫细胞吞噬,然后与Toll样受体结合,激活IL-6和TNF-α,从而促进肿瘤的增殖和转移。
本课题研究还发现,下调骨肉瘤细胞miR-99a水平后,骨肉瘤细胞的侵袭转移能力得到显著抑制,而凋亡未得到明显抑制,这提示,骨肉瘤细胞中的miR-99a高表达水平与其侵袭转移密切相关。下调miR-99a后,143B细胞中的RECK蛋白上调,而MMP-2和MMP-9蛋白表达下调。RECK(reversion-inducing cysteine-rich protein with kazal motifs)基因是一种恶性肿瘤转移抑制剂,也是一种转录后水平的基质金属蛋白抑制剂,可以通过抑制多种MMPs表达,阻碍肿瘤细胞的发生和发展。关于调控miRNA后对肿瘤细胞抑制作用机制研究已经有很多文献报道。基因学分析结果显示,miRNA-99a可显著的抑制乳腺癌细胞的增生、转移及浸润。而且生物信息学分析提示HOXA1 mRNA是miRNA-99a行使功能的直接靶基因,并通过荧光素酶标记试验得到证实。Li[4]等研究表明,miR-99a在肝癌细胞中呈现低表达,这种低表达现象与肝癌患者预后密切相关,Jiang等[6]证实卵巢癌细胞株FGFR3中miR-99a呈现低表达,且其低表达促进了FGFR3侵袭转移能力,本研究发现miR-99a在骨肉瘤细胞中的生物学作用与这些研究的结果相似,均证实miR-99a具有促进肿瘤细胞侵袭转移的作用,且与患者预后密切相关,当反向调控其表达后,肿瘤细胞生物学作用得到抑制。
结合以上研究及本课题组研究,不难发现,miR-99a在骨肉瘤细胞中高表达,在其他癌症细胞株中呈现低表达。并且RECK及MMP-2、MMP-3等通路蛋白可能在miR99a-inhibitor抑制骨肉瘤侵袭转移机制中起到重要作用。但是,miR-99a在骨肉瘤组织中是否为特异性高表达仍需进一步实验研究证实。
| [1] | Nedelcu D, Andreescu N, Boeriu E, et al. Retrospective study on osteosarcoma and ewing sarcoma-our experience[J]. Maedica (Buchar), 2014, 9(2): 151-156. |
| [2] | Zhou W, Hao M, Du X, et al. Advances in targeted therapy for osteosarcoma[J]. Discov Med, 2014, 17(96): 301-307. |
| [3] | Luetke A, Meyers PA, Lewis I, et al. Osteosarcoma treatment-where do we stand? A state of the art review[J]. Cancer Treat Rev, 2014, 40(4): 523-532. DOI: 10.1016/j.ctrv.2013.11.006. |
| [4] | Li D, Liu X, Lin L, et al. MicroRNA-99a inhibits hepatocellular carcinoma growth and correlates with prognosis of patients with hepatocellular carcinoma[J]. J Biol Chem, 2011, 286(42): 36677-36785. DOI: 10.1074/jbc.M111.270561. |
| [5] | Hu Y, Zhu Q, Tang L. MiR-99a antitumor activity in human breast cancer cells through targeting of mTOR expression[J]. PLoS One, 2014, 9(3): e92099. DOI: 10.1371/journal.pone.0092099. |
| [6] | Jiang H, Qu L, Wang Y, et al. miR-99a promotes proliferation targeting FGFR3 in human epithelial ovarian cancer cells[J]. Biomed Pharmacother, 2014, 68(2): 163-169. DOI: 10.1016/j.biopha.2013.12.001. |
| [7] | Feng Y, Kang Y, He Y, et al. microRNA-99a acts as a tumor suppressor and is down-regulated in bladder cancer[J]. BMC Urol, 2014, 14: 50. DOI: 10.1186/1471-2490-14-50. |
| [8] | Hu H, Zhang Y, Cai XH, et al. Changes in microRNA expression in the MG-63 osteosarcoma cell line compared with osteoblasts[J]. Oncol Lett, 2012, 4(5): 1037-1042. |
| [9] | Calin GA, Croce CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006, 6(11): 857-866. DOI: 10.1038/nrc1997. |
| [10] | Sempere LF, Korc M. A method for conducting highly sensitive microRNA in situ hybridization and immunohistochemical analysis in pancreatic cancer[J]. Methods Mol Biol, 2013, 980: 43-59. DOI: 10.1007/978-1-62703-287-2. |
| [11] | Karaayvaz M, Pal T, Song B, et al. Prognostic significance of miR-215 in colon cancer[J]. Clin Colorectal Cancer, 2011, 10(4): 340-347. DOI: 10.1016/j.clcc.2011.06.002. |
| [12] | Mishra PJ. MicroRNAs as promising biomarkers in cancer diagnostics[J]. Biomark Res, 2014, 2: 19. DOI: 10.1186/2050-7771-2-19. |
| [13] | Mishra PJ, Merlino G. MicroRNA reexpression as differentiation therapy in cancer[J]. J Clin Invest, 2009, 119(8): 2119-2123. |
| [14] | Ma W, Zhang X, Chai J, et al. Circulating miR-148a is a significant diagnostic and prognostic biomarker for patients with osteosarcoma[J]. Tumour Biol, 2014, 35(12): 12467-12472. DOI: 10.1007/s13277-014-2565-x. |
| [15] | Xu SH, Yang YL, Han SM, et al. MicroRNA-9 expression is a prognostic biomarker in patients with osteosarcoma[J]. World J Surg Oncol, 2014, 12: 195. DOI: 10.1186/1477-7819-12-195. |
| [16] | Challagundla KB, Fanini F, Vannini I, et al. microRNAs in the tumor microenvironment: solving the riddle for a better diagnostics[J]. Expert Rev Mol Diagn, 2014, 14(5): 565-574. DOI: 10.1586/14737159.2014.922879. |
| [17] | Chen C, Zhao Z, Liu Y, et al. microRNA-99a is downregulated and promotes proliferation, migration and invasion in non-small cell lung cancer A549 and H1299 cells[J]. Oncol Lett, 2015, 9(3): 1128-1134. |
| [18] | Yu SH, Zhang CL, Dong FS, et al. miR-99a suppresses the metastasis of human non-small cell lung cancer cells by targeting AKT1signaling pathway[J]. J Cell Biochem, 2015, 116(2): 268-276. DOI: 10.1002/jcb.24965. |
 2018, Vol. 39
2018, Vol. 39


