乳腺癌是影响女性健康的最常见的恶性肿瘤之一,影响乳腺癌治疗效果及预后的最重要因素是在肿瘤早期就发生了转移,近年研究发现,上皮-间质转化(epithelial-mesenchymal transition, EMT)在恶性肿瘤侵袭和转移的过程发挥重要作用。EMT指上皮来源的肿瘤细胞在形态上由多边形上皮表型转变为梭形间叶表型的过程,癌细胞发生EMT后癌细胞迁移和侵袭能力增强,更易于突破细胞基底膜(epithelial basement membrane, EBM)、侵入细胞及细胞外基质发生转移。
Jin[1]研究认为,发生EMT与上皮细胞上的钙黏蛋白(E-cadherin,E-cad)表达密切相关,EMT使E-cad表达下调,波形蛋白(Vimentin,Vim)表达上调,研究显示EMT被认为是乳腺癌发生浸润转移的第一步[2, 3]。
研究表明多个信号通路参与肿瘤EMT信号调控,其中包括核内转录因子(NF-κB、Snail及Twist)介导的信号通路等均可参与肿瘤EMT过程[4, 5]。NF-κB是近年来研究发现较为重要的转录因子,大量研究证明NF-κB参与EMT过程,NF-κB激活可促进EMT[6]。而Snail作为NF-κB信号通路的下游核转录因子,是众多信号转导通路的节点或调控点,同样在肿瘤细胞增殖、分化及凋亡进程中发挥重要作用[7]。研究发现Snail的表达可下调E-cad的表达[8]。Snail作为关键信号分子参与了EMT过程[9],因此NF-κB-Snail信号通路参与调控肿瘤细胞EMT过程。
较多研究证实乳腺癌细胞在外界因素下,包括细胞生长因子如转化生长因子、脂多糖(lipopolysaccharide, LPS)、炎症介质等诱导下可以发生EMT[10],LPS为内毒素,可以诱导炎症细胞产生细胞因子进而影响肿瘤生长,研究发现LPS可以通过NF-κB信号通路发挥作用[11]参与EMT。
青蒿素是一种在天然植物中提取的植物药,最早发现其是治疗疟疾的重要药物,随着研究的深入,近年来发现青蒿素及衍生物具有抑制癌细胞增殖、阻滞细胞周期、促进癌细胞凋亡等抗癌活性,然而,双氢青蒿素(dihydroarte-temisinin, DHA)能否参与抑制或逆转癌细胞EMT发生,进而抑制肿瘤侵袭转移,文献报道较少,本研究主要在细胞水平上探讨DHA可能通过影响NF-κB-Snail信号通路参与逆转EMT过程,对于在动物水平及临床上探讨DHA可能作为抗肿瘤药物新的作用靶点具有较重要的临床指导意义。
1 材料与方法 1.1 材料实验用细胞:人类乳腺癌细胞株MCF-7,购自美国CCTCC;脂多糖(LPS)(Sigma-L2880, 批号:11070116,配置浓度5 μg/ml);鼠抗人单克隆抗体E-cadherin (ZM-0092, 批号:10032507, Santa Cruz公司);兔抗人单克隆抗体vimentin (ZM-0260,批号:1118705, Santa Cruz公司);鼠抗人β-actin (SC-47778, 批号:12050511, Santa Cruz公司);NF-κB P65(ab7970, 批号:12J28601, Abcam公司);Anti-Snail抗体(ab53519, 批号:12J28704, Abcam公司);二抗(HRP标记):羊抗鼠IgG、羊抗兔IgG,购自美国Santa Cruz公司;DHA (Dihydroartemisnin,批号:20071001,配置浓度25 μmol/L,四川三奇制药厂);Transwell小室,美国Corning公司;RT-PCR试剂盒购自日本TaKaRa公司。
1.2 实验方法LPS处理MCF-7细胞后,光学显微镜下观察其形态变化。
经LPS诱导后,免疫荧光法检测其转化后乳腺癌细胞E-cad的表达:细胞在37 ℃培养箱培养后,待细胞生长至单层约70%-80%面积时,用0.25%胰酶消化成细胞悬液后,接种到6孔板中培养,6孔板中放有盖玻片,温箱中培养2-3 d,待细胞生长覆盖盖玻片约70%-80%时,取出盖玻片,经过PBS漂洗、95%乙醇固定后,用镊子小心取出玻片风干,加一抗抗体(均按抗体说明书配置对应浓度),放在湿盒内,然后置于4 ℃冰箱,次日取出,复温、漂洗、风干后加二抗,HRP标记的二抗浓度按说明书配置,室温下孵育60 min,用50%浓度甘油封片,在荧光显微镜下观察。
1.2.3 Western blot检测E-cad、Vimentin以及Snail、P65蛋白的表达取培养瓶细胞用PBS漂洗后冰上预冷10 min,加细胞裂解液0.5-1 ml置于冰上裂解30 min,用细胞刮子刮出裂解液后,高速离心30 min后取上清液,测定蛋白浓度,加入等体积上样缓冲液,电泳,转膜,目的蛋白转到的PVDF膜上,脱脂牛奶轻微振荡下封闭1 h,加对应一抗常温孵育2 h后,4 ℃冰箱孵育过夜。次日用相应浓度(1:3 000-1:1 000)的标记辣根过氧化物酶(HRP)的二抗室温孵育2 h,TTBS洗膜,漂洗、暗室内曝光后,凝胶成像系统下观察电泳结果,用Image J图像软件分析。
1.2.4 Transwell体外侵袭实验预先在4 ℃下融化ECM胶并过夜,ECM胶用预冷的无血清培养基按1:9稀释(稀释至1 mg/ml),每个小孔中加入已经稀释好的ECM胶40 μl,放入培养箱中孵育5 h;吸出小室中残余液体,每孔加入70 μl含无血清培养基,水化基底膜,细胞首先以3×105个/每孔接种到12孔板,LPS (5 μg/ml)处理48 h后消化并混匀于无血清DMEM培养基中,将细胞悬液混匀后均匀接种于Transwell上室中,Transwell下室加趋化因子,37 ℃培养24 h同组细胞设5个副孔,细胞运动后取出Transwel小室,用棉签擦拭后,常温干燥分钟。待膜干燥后结晶紫染色20 h,PBS洗膜、风干。每组细胞在光学显微镜计数,复孔取5个视野进行细胞计数,重复3次,取均数进行统计。
1.2.5 RT-PCR检测E-cad及Vimentin在mRNA水平的表达用Trizol试剂说明书提取MCF-7细胞的总RNA。在紫外分光光度仪上测定RNA纯度,OD260/OD280的比值控制在1.8-2.0之间,取2 μg RNA用逆转录试剂盒合成制备cDNA链。
| 表 1 E-cad mRNA及Vimentin mRNA PCR反应参数 |
PCR反应条件:首先94 ℃变性10 min, 后进行33个循环:94 ℃ 30 s, 最终72 ℃ 10 min。β-actin作内参。PCR产物经过2%琼脂糖凝胶电泳后,用图像软件Image J分析各样本目的基因及内参β-actin的PCR产物条带光密度,计算目的基因/β-actin的比值,其比值即为E-cad和Vimentin基因的相对灰度。
1.2.6 统计学处理每组实验至少重复3次以上,统计数据以x±s表示,采用SPSS 17.0软件进行数据统计分析处理,各组之间比较采用t检验,P < 0.05表示差异有统计学意义。
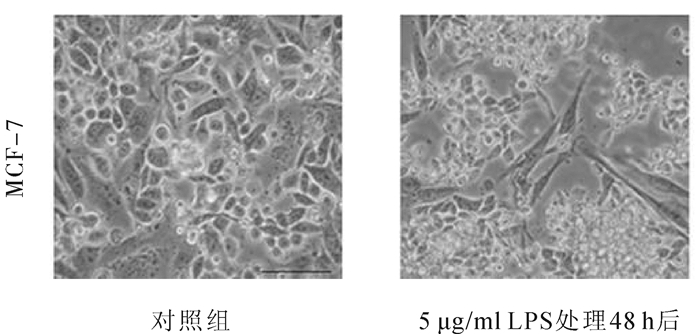
2 结果 2.1 LPS诱导乳腺癌细胞株MCF-7后细胞形态变化正常细胞培养液中培养的MCF-7细胞类似于多边形,细胞之间连接紧密,给予5 μg/ml LPS诱导48 h后,MCF-7细胞形态由多边形变为梭形,细胞连接变得松散(图 1)。
|
图 1 5 μg/ml LPS诱导乳腺癌细胞发生形态改变(×300) |
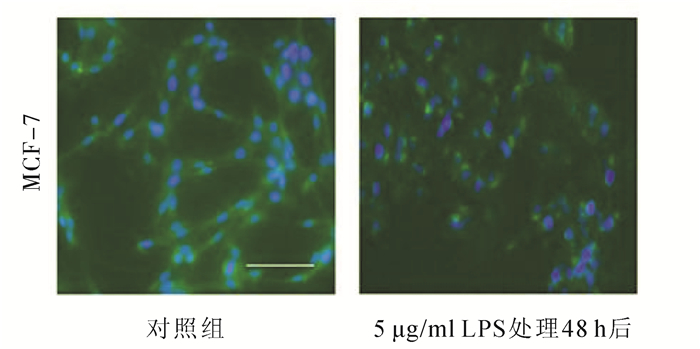
未处理的MCF-7细胞,E-cad呈黄绿色,定位在细胞膜,细胞连接紧密;LPS处理后,MCF-7细胞中上皮E-cad的表达减少(图 2)。
|
图 2 免疫荧光检测EMT后乳腺癌细胞MCF-7中E-cad的表达(×300) E-cad:FITC染色:黄绿色;核染色Hoechst 33258:蓝色 |
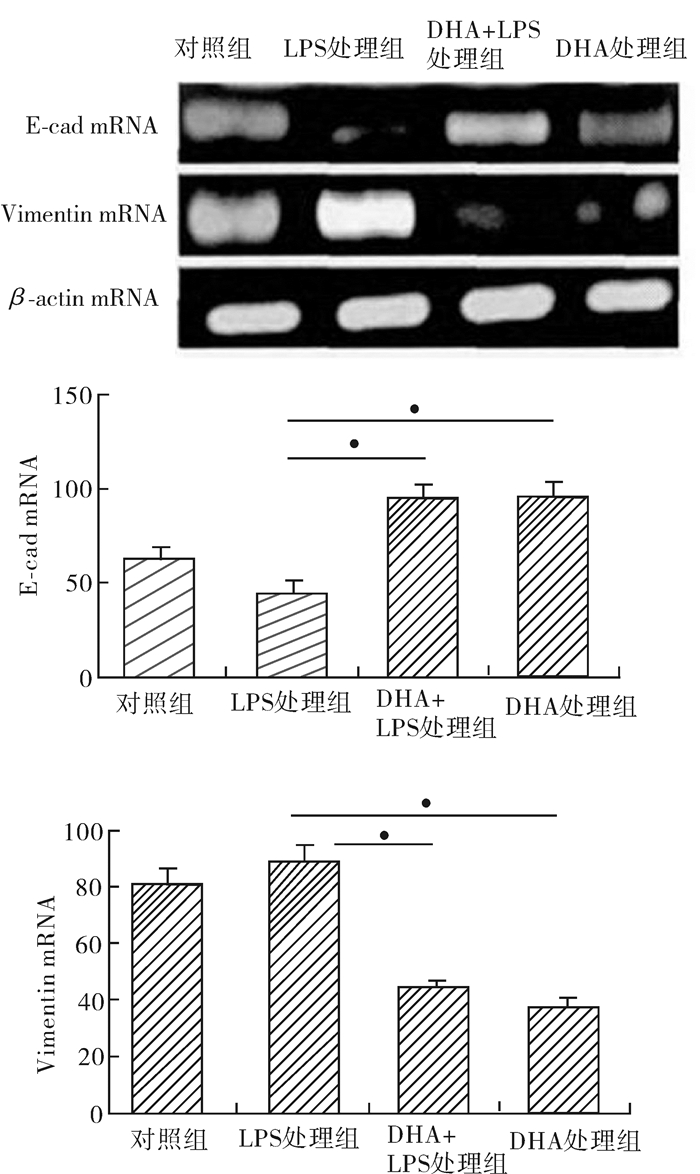
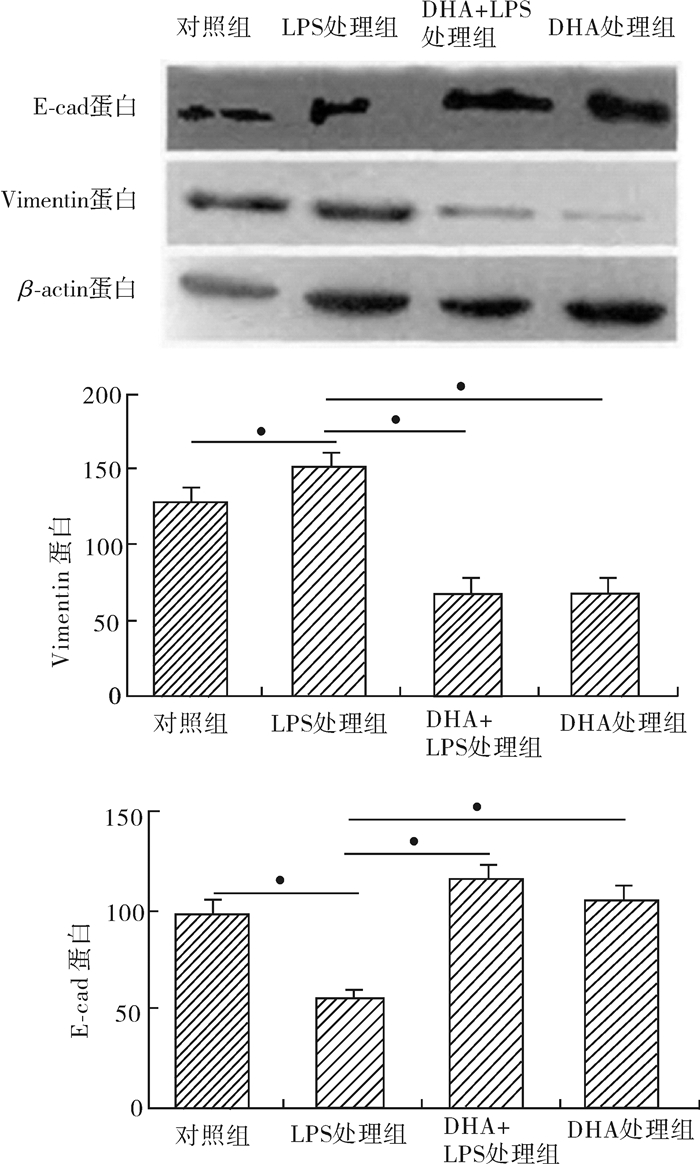
E-cad及Vimentin在蛋白水平和mRNA的表达经5 μg/ml LPS诱导癌细胞MCF-7 48 h后,E-cad mRNA及蛋白表达水平降低;而Vimentin mRNA及蛋白表达增加,而加入DHA 25 μmol/L处理后,E-cad mRNA及蛋白被上调,Vimentin mRNA及蛋白被下调(图 3,图 4)。
|
图 3 DHA处理LPS诱导的乳腺癌细胞株后E-cad及Vimentin mRNA表达水平的影响 *P < 0.05 |
|
图 4 DHA可上调LPS诱导的乳腺癌细胞株MCF-7中E-cad表达,下调Vimentin蛋白表达 *P < 0.05 |
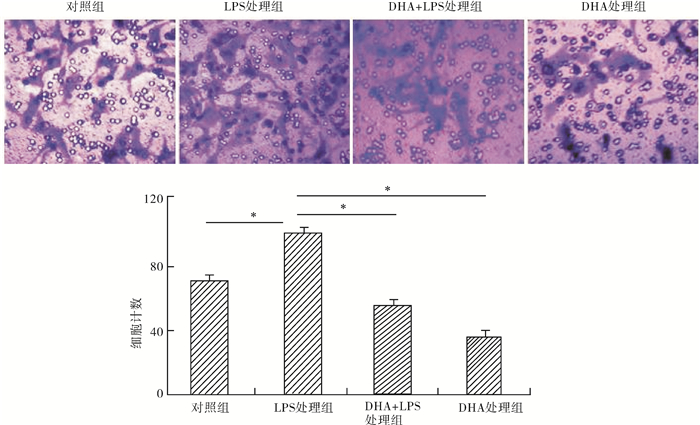
共设4组:用5 μg/ml LPS 48 h诱导乳腺癌细胞发生EMT,然后设LPS+DHA共同处理组及DHA处理组,从Transwell实验中看出,共同处理组穿过Transwel膜细胞数较单纯LPS处理组显著减少,P < 0.05(图 5)。
|
图 5 DHA抑制MCF-7侵袭能力,LPS可诱导增强细胞侵袭能力;然而DHA可以逆转这一过程(*P < 0.05) |
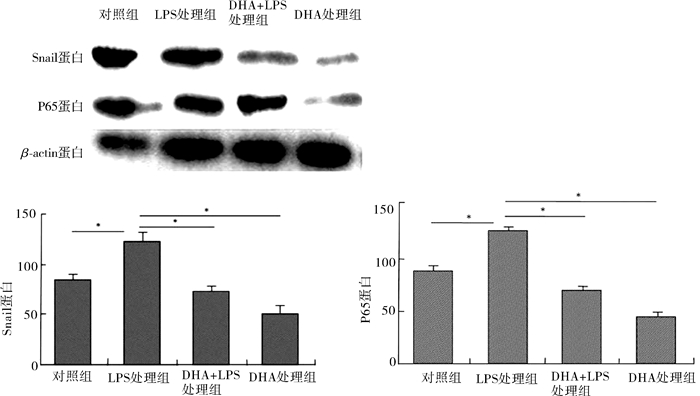
通过Western Blot和RT-PCR实验检测NF-κB-Snail信号通路蛋白Snail蛋白及P65蛋白的表达水平,结果提示,LPS诱导乳腺癌细胞时,Snail蛋白及NF-κB P65表达增加,DHA (25 μmol/L)干预后48 h,DHA下调Snail蛋白及蛋白P65的表达(图 6)。
|
图 6 DHA能够下调LPS诱导后乳腺癌细胞株MCF-7核转录因子Snail及P65的表达(*P < 0.05) |
如前言所述,上皮-间质转化(EMT)改变细胞表型,调节细胞运动侵袭能力,在上皮恶性肿瘤细胞侵袭及转移中发挥着重要作用。因此阻断或逆转上皮间质转化的过程或抑制其信号通路对抑制肿瘤侵袭转移可能成为新的抗肿瘤治疗方式。
目前大多认为肿瘤细胞是在肿瘤微环境中,包括自身环境及外界因素的影响下启动EMT,多种细胞生长因子(包括TGF-β、EGF[12-14])、酶蛋白及细胞和细胞基质的相互作用参与EMT过程。EMT的信号调控机制涉及多个信号转导通路,构成了复杂的细胞转导信号网络,其中主要包括TGF-β启动信号[15, 16]、Notch信号通路、Wnt信号通路、核内转录因子(如Snail及Twist)等均参与肿瘤EMT;近年来的研究发现NF-κB介导的信号通路参与调控肿瘤EMT过程。Barbera等[17]研究发现NF-κB可以结合Snail的启动-194和-78 bp增加的Snail转录,Snail表达增强直接参与EMT。Julien、Zhang等[18, 19]研究发现NF-κB激活后上调Snail的表达,抑制肿瘤细胞中E-cad的表达,上调间质相关蛋白的表达,促进癌细胞发生EMT。细胞实验发现乳腺癌细胞发生EMT后,细胞的运动侵袭能力增强,乳腺癌动物模型[20]也证实乳腺癌周围细胞发生了细胞形态及功能改变,易侵入基质,较多研究证实LPS可以改变肿瘤微环境中的细胞因子,在肿瘤增殖、侵袭、转移中发挥重要作用,较多研究用LPS诱导肿瘤细胞发生EMT,NF-κB信号通路是LPS发挥作用的重要细胞通路[19]。大量研究提示乳腺癌可以在外界条件诱导下可发生EMT,经多重信号激活核转录因子,导致癌细胞发生EMT,并参与乳腺癌侵袭、转移过程。
乳腺癌细胞经EMT后,相关标记蛋白的表达发生变化,如E-Cad[21]和新的间质蛋白(N-Cad)标记的表达增加,本实验用Western Blot技术检测其EMT前后标记性蛋白的表达情况。LPS诱导乳腺癌细胞MCF-7后,E-cad mRNA及蛋白表达降低;而vimentin mRNA及蛋白表达上调;而加入DHA处理后,E-cad及Vimentin在分子及蛋白水平表达逆转,从细胞功能上研究发现,给予DHA干预LPS诱导的乳腺癌细胞EMT;其运动能力下降;给予5 μg/ml LPS处理48 h诱导MCF-7细胞发生EMT,细胞的侵袭能力提高;而给予DHA处理LPS诱导后乳腺癌细胞后,细胞侵袭能力下降,这个结果证实EMT参与细胞侵袭、转移过程,是乳腺癌细胞在生长、转化进程中增强侵袭能力的重要步骤。
在多个研究中[22, 23]中通过基因敲除、基因沉默可以逆转EMT表型,或者改变癌细胞对抗肿瘤药物的耐药性、化疗敏感性等;有学者研究发现认为天然植物提取物可能通过调控microRNA逆转肿瘤干细胞和发生EMT后肿瘤细胞对化疗不敏感的状态[24], 然而,大多数研究仍局限于基础研究或临床前研究阶段,尚需要更深入的研究探索。
青蒿素主要衍生物有双氢青蒿素(Dihydroartemisinin)、青蒿琥酯(Artesunate)、蒿甲醚(Artemether)。青蒿素具疏水性,能穿过细胞膜进入细胞内发挥药效,在肿瘤、免疫调节等多方面具重要价值,通过抑制肿瘤细胞增殖、诱导凋亡、抑制肿瘤细胞的侵袭及转移以及调控血管生成相关因子表达来抗肿瘤血管形成[25, 26]。
探讨DHA抗肿瘤的分子机制,对于开发新的抗癌药、寻找新的抗癌作用靶点具有重要指导意义。本研究应用DHA作为逆转录药物,证实DHA对乳腺癌EMT的逆转作用DHA可能参与调节NF-κB-Snail信号通路,进而逆转乳腺癌细胞EMT。本研究中NF-κB-Snail信号调通路中的下游核转录因子Snail可能作为逆转信号通路中的逆转靶点,对抗癌药物开发具有重要指示意义。
| [1] | Jin L, Chen J, Li L, et al. CRH suppressed TGFbeta1-induced Epithelial-Mesenchymal Transition via induction of E-cadherin in breast cancer cells[J]. Cell Signal, 2014, 26(4): 757-765. DOI: 10.1016/j.cellsig.2013.12.017. |
| [2] | Zhang X, Liu G, Kang Y, et al. N-cadherin expression is associated with acquisition of EMT phenotype and with enhanced invasion in erlotinib-resistant lung cancer cell lines[J]. PLoS One, 2013, 8(3): e57692. DOI: 10.1371/journal.pone.0057692. |
| [3] | Beach JR, Hussey GS, Miller TE, et al. Myosin Ⅱ isoform switching mediates invasiveness after TGF-beta-induced epithelial-mesenchymal transition[J]. Proc Natl Acad Sci USA, 2011, 108(44): 17991-17996. DOI: 10.1073/pnas.1106499108. |
| [4] | Papageorgis P, Lambert AW, Ozturk S, et al. Smad signaling is required to maintain epigenetic silencing during breast cancer progression[J]. Cancer Res, 2010, 70(3): 968-978. DOI: 10.1158/0008-5472.CAN-09-1872. |
| [5] | Fuxe J, Vincent T, Garcia de Herreros A. Transcriptional crosstalk between TGF-beta and stem cell pathways in tumor cell invasion: role of EMT promoting Smad complexes[J]. Cell Cycle, 2010, 9(12): 2363-2374. DOI: 10.4161/cc.9.12.12050. |
| [6] | Huber MA, Azoitei N, Baumann B, et al. NF-kappa B is essential for epithelial-mesenchymal Transition and metastasis in a model of breast cancer progression[J]. J Clin Invest, 2004, 114(4): 569-581. DOI: 10.1172/JCI200421358. |
| [7] | Blanco MA. Correlation of snail expression with histological grade and lymph node status in breast carcinomas[J]. Oncogene, 2002, 21(20): 3241-3246. DOI: 10.1038/sj.onc.1205416. |
| [8] | Colleran A, Ryan A, O'Gorman A, et al. Autophagosomal IκBα degradation play a role in the long term control of tumor necrosis factor-α-induced NF-κB activity[J]. J Biol Chen, 2011, 286(26): 22886-22893. DOI: 10.1074/jbc.M110.199950. |
| [9] | Chua HL, Bhat-Nakshatri P, Clare SE, et al. NF-kappaB represses E-cadherin expression and enhances epithelial to mesenchymal transition of mammary epithelial cells: potential involvement of ZEB-1 and ZEB-2[J]. Oncogene, 2007, 26(5): 711-712. DOI: 10.1038/sj.onc.1209808. |
| [10] | Chaw SY, Majeed AA, Dalley AJ, et al. Epithelial to mesenchymal transition (EMT) biomarkers-E-cadherin, betacatenin APC and Vimentin-in oral squamous cell carcinogenesis and transformation[J]. Oral Oncol, 2012, 48(10): 997-1. DOI: 10.1016/j.oraloncology.2012.05.011. |
| [11] | Barbera MJ, Puig I, DominguezD, et al. Regulation of Snail transcription during epithelial tomesenchymal transition of tumor cells[J]. Oncogene, 2004, 23(44): 7435-7354. |
| [12] | Luo Y, Jiang YG, He DL, et al. Knockdown of beta-Catenin through shRNA cause a reversal of EMT and metastatic phenotypes induced by HIF-1alpha[J]. Cancer Invest, 2011, 29(6): 377-382. DOI: 10.3109/07357907.2010.512595. |
| [13] | Zhuo W, Wang Y, Zhuo X, et al. Knockdown of Snail, a novel zincfinger transcription factor, via RNA interference increases A549 cell sensitivity to cisplatin via JNK/mitochondrial pathway[J]. Lung Cancer, 2008, 62(1): 8-14. DOI: 10.1016/j.lungcan.2008.02.007. |
| [14] | Cochrane DR, Spoelstra NS, Howe EN, et al. MicroRNA-200c mitigates invasiveness and restores sensitivity to microtubule-targeting chemotherapeutic agents[J]. Mol Cancer Ther, 2009, 8(5): 1055-1066. DOI: 10.1158/1535-7163.MCT-08-1046. |
| [15] | Lu JJ, Dang YY, Huang M, et al. Anti-cancer properties of terpenoids isolated from Rhizoma Curcumae-A review[J]. J Ethnopharmacol, 2012, 143(2): 406-411. DOI: 10.1016/j.jep.2012.07.009. |
| [16] | Zhao YS, Zhu TZ, Chen YW. Beta-elemene inhibits Hsp90/Raf-1 molecular complex inducing apoptosis of glioblastoma cells[J]. J Neurooncol, 2012, 107(2): 307-314. DOI: 10.1007/s11060-011-0770-7. |
| [17] | Barbera MJ, Puig I, Dominguez D, et al. Regulation of Snail transcription during epithelial tomesenchymal transition of tumor cells[J]. Oncogene, 2004, 23(44): 7435-7354. |
| [18] | Julien S, Puig I, Caretti E, et al. Activation of NF-kappa B by Akt upregulates Snail expression and induces epitheli-ummesenchyme transition[J]. Oncogene, 2007, 26(53): 7445-7456. DOI: 10.1038/sj.onc.1210546. |
| [19] | Zhang K, Zhaos J, Liu X, et al. Activation of NF-κ B up-regulates Snail and consequent Repressionof E-codherinin cholangiocarcinoma cell invasion[J]. Hepatogastroenterology, 2011, 58(105): 1-7. |
| [20] | Larriba MJ, Martin-Villar E, Garcia JM, et al. Snail2 cooperates with Snail1 in the repression of vitamin D receptor in colon cancer[J]. Carcinogenesis, 2009, 30(8): 1459-1468. DOI: 10.1093/carcin/bgp140. |
| [21] | Larriba MJ, Martin-Villar E, Garcia JM, et al. Snail2 cooperates with Snail1 in the repression of vitamin Dreceptor in colon cancer[J]. Carcinogenesis, 2009, 30(8): 1459-1468. DOI: 10.1093/carcin/bgp140. |
| [22] | Fujita N, Jaye DL, Kajita M, et al. MTA3, a Mi-2/NuRD complex subunit, regulates an invasive growth pathway in breast cancer[J]. Cell, 2003, 113(2): 207-219. DOI: 10.1016/S0092-8674(03)00234-4. |
| [23] | Zhao JH, Luo Y, Jiang YG, et al. Knockdown of beta-Catenin through shRNA cause a reversal of EMT and metastatic phenotypes induced by HIF-1alpha[J]. Cancer Invest, 2011, 29(6): 377-382. DOI: 10.3109/07357907.2010.512595. |
| [24] | Melkamu T, Zhang X, Tan J, et al. Alteration of microRNA expression in vinyl carbamate-induced mouse lung tumors and modulation by the chemopreventive agent indole-3-carbinol[J]. Carcinogenesis, 2010, 31(2): 252-258. DOI: 10.1093/carcin/bgp208. |
| [25] |
汪溪, 李建业, 夏春咸. 双氢青蒿素抗肿瘤作用研究进展[J].
海南医学, 2010, 21 (13): 119-121.
Wang X, Li JY, Xia CX. The mechanism of inhibitting cancer research progress review by Dihydroartemisinin[J]. Journal of Hainan Medical, 2010, 21(13): 119-121. |
| [26] |
何艺磊, 李卫东. 双氢青蒿素抗肿瘤作用机制的研究进展[J].
中国医药指南, 2014, 12 (24): 64-67.
He YL, Li WD. The Dihydroartemisinin research progress of antitumor mechanism[J]. China Medical Guide, 2014, 12(24): 64-67. |
 2016, Vol. 37
2016, Vol. 37

