2. 中南大学湘雅医院普通外科 湖南 长沙 410008;
3. 武汉大学中南医院普通外科 湖北 武汉 430071
2. Dept. of General Surgery, Xiangya Hospital of Central South University, Changsha 410008, China;
3. Dept. of General Surgery, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
WD40重复包含蛋白1(WD repeat domain 1,WDR1)是一种纤维肌动蛋白结合蛋白,具有产生与维持发育中的表皮皮质张力,调节表皮平面细胞极性(planar cell polarity, PCP)的建立、调节细胞形态与平面方向的改变,具有调节细胞黏附、促进细胞迁徙的功能[1]。肿瘤细胞迁徙能力增强是癌细胞侵袭转移的重要环节。本研究目的在于检测WDR1在肝细胞癌(hepatocellular carcinoma, HCC)组织以及癌旁组织中的表达情况,并探究其与HCC患者生存预后的关系。
1 资料与方法 1.1 一般资料收集中南大学湘雅医院2004年2月-2011年12月接受肝癌切除术治疗的106例HCC患者的HCC组织标本、病历资料以及术后随访资料。随访方式包括邮件、患者及亲属电话、门诊复查和登门随访等方式;随访时间:治疗后3年内平均4个月随访一次,3至5年期间平均6个月随访一次;随访截止时间为2016年12月[2]。失访病例数共5例。患者术后组织均经病理送检确诊为HCC。所有组织均送病理科进行石蜡包埋切片。本次研究获得湘雅医院医学伦理审查委员会的审核和批准。总体生存时间为HCC患者肝癌切除术后至因肝癌死亡或随访截止日期这一时间段;无瘤生存时间为肝癌切除术后至HCC复发或转移灶被发现时这一时间段。生物信息学分析:从数据库Oncomine (https://www.oncomine.org/resource/login.html)中, 我们收集Mas liver和Roessler Liver两个统计数据,并分析HCC和正常组织之间WDR1表达水平的差异。
1.2 免疫组织化学采用2-step Plus©免疫组化检测试剂盒(GBI,Washington DC,Washington)对HCC组织中的WDR1表达情况进行检测。石蜡包埋后切成4 μm厚的组织切片进行检测。①石蜡切片烤片、脱蜡、水化;②使用柠檬酸钠缓冲溶液进行抗原修复,洗PBS;③用3%的H2O2室温下孵育20 min来阻断内源性过氧化物酶;④泡蒸馏水与PBS液后,用5%BSA封闭液(每张片子滴加60 μl)孵育30 min;⑤加一抗后置湿盒中4 ℃过夜;第二日,先于室温中复温30 min,PBS洗去一抗;⑥滴加聚合物辅助剂(中杉二抗试剂盒试剂1)于室温下孵育30 min,洗PBS后滴加二抗(中杉二抗试剂盒试剂2)于室温下孵育30 min,然后浸泡在PBS中准备显色;⑦依据说明书配置好显色剂后将其滴加于切片上,低倍镜下控色,当非特异性染色还没有出现而阳性染色明显时为佳,记录控色时间并保证各切片的显色时间一致,完成后置于自来水中轻柔冲洗5 min;⑧滴加适量新鲜苏木素于切片上,复染时间15 min左右,然后自来水冲洗10 min;⑨返蓝、脱水、透明;⑩封片;将切片放于LEICA DM5000B显微镜(Leica,Solms,Germany)观察[3]。
1.3 免疫组织化学结果评定标准免疫反应积分(IRS)=染色强度(SI)×阳性细胞百分比(PP);其中SI可分为4级, 即0级为阴性, 1级弱阳性, 2级中等阳性, 3级强阳性;PP可分为5级, 即0级为<5%, 1级为5%-25%, 2级为26%-50%, 3级为51%-75%, 4级>75%;当IRS≤2为低表达,3-12为高表达[4]。免疫组化结果的评定由两位病理科医师独立进行。
1.4 统计学方法本次研究的所有数据均使用SPSS 19.0进行统计分析。计数资料采用χ2检验进行统计分析,WDR1表达水平与肝癌患者临床病理特征的相关性采用Spearman秩相关分析。患者的总体生存与无瘤生存曲线采用Kaplan-meier绘制,高表达WDR1与低表达WDR1患者总体生存或无瘤生存率之间的差别采用Log-rank检验统计。Cox比例风险回归模型用于统计肝癌患者各临床病理特征与预后之间的相关性,Cox比例风险回归模型中仅有单因素统计分析P<0.05的因素才纳入多因素再次进行分析。Oncomine数据库中的数据分析采用Shapiro-Wilk检验,测试WDR1的表达情况在统计上是否呈正态分布;Levene’s检验WDR1在HCC组织和正常肝组织中的表达差异。将P<0.05设定为比较各组之间是否具有统计学差异的临界值。
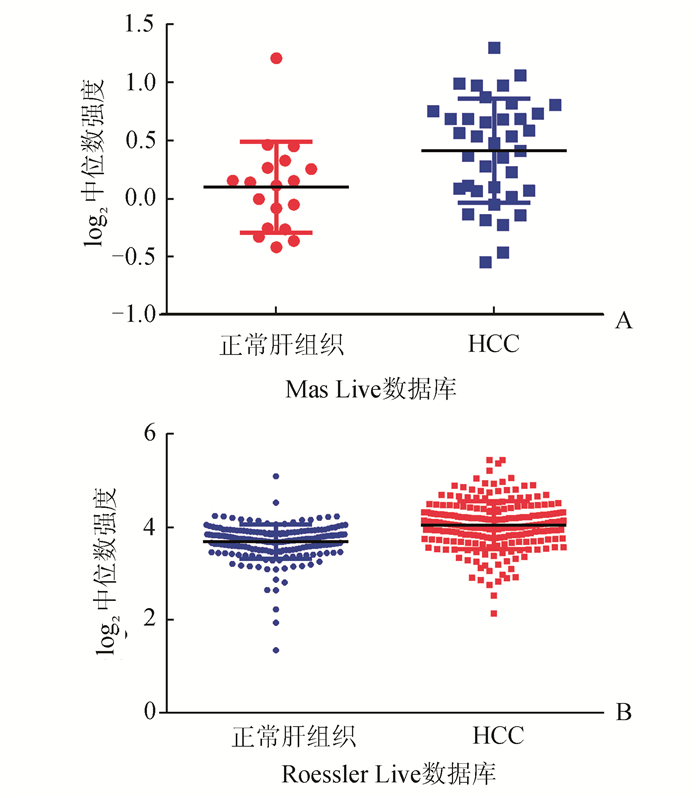
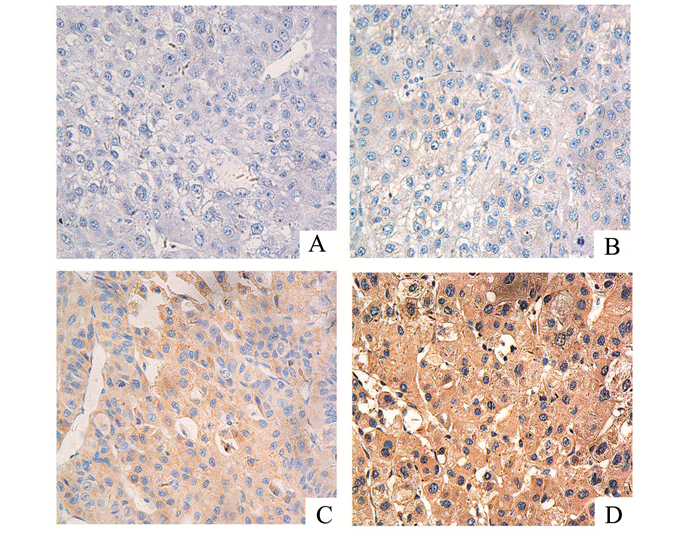
2 结果 2.1经Oncomine数据库统计分析显示,相对于正常肝组织,WDR1在HCC组织中的表达水平显著提升,这表明WDR1可能是HCC的一种癌基因(图 1A、B)。按照免疫组化评分标准归类WDR1在肝癌组织中的表达(图 2A、B、C、D)。据统计结果显示,WDR1与HCC组患者相关临床病理特征之间具有相关性。较之于癌旁组织,HCC中WDR1的高低表达情况与甲胎蛋白(AFP)、肝硬化、微血管侵犯、Child-Pugh分级、TNM分期等临床病理特征存在显著的相关性(P<0.05),而和性别等其余临床病理特征的相关性不明显(P>0.05),见表 1。
|
图 1 Oncomine生物信息学数据库分析 A: RNA-Seq分析WDR1在HCC以及正常组织中的表达(Mas Liver数据库)(P=0.004);B: RNA-Seq分析WDR1在HCC以及正常组织中的表达(Roessler Liver数据库)(P<0.001) |
|
图 2 使用免疫组织化学检测106例HCC及癌旁组织中WDR1的表达情况(×400) A, B:组织中的WDR1表达水平为阴性;C, D; 组织中的WDR1表达水平为阳性 |
| 表 1 WDR1与HCC组患者相关临床病理特征之间的关系(n) |
考虑上述特征与肿瘤侵袭转移相关,据此我们推测WDR1可能影响预后生存,据此我们进行单多因素分析及生存预后分析。HCC患者整体生存预后及无瘤生存危险因素的单多因素分析:单因素分析显示AFP、HBsAg、肝硬化、微血管侵犯、Child-Pugh分级、TNM分期及WDR1表达高低是影响HCC患者总体生存以及无瘤生存预后的因素,见表 2。
| 表 2 HCC患者整体预后危险因素的单多因素分析 |
多因素分析显示微血管侵犯、Child-Pugh分级、TNM分期及WDR1表达高低是影响HCC患者总体生存的独立预后因子(P<0.05);同时,微血管侵犯、Child-Pugh分级、TNM分期及WDR1表达高低是影响HCC患者无瘤生存的独立预后因子(P<0.05),见表 3。
| 表 3 HCC患者无瘤生存预后危险因素的单多因素分析 |
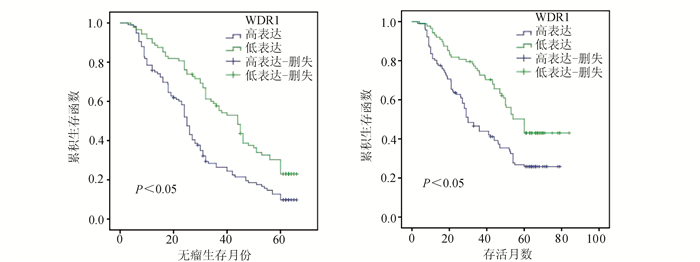
WDR1高表达组与低表达组患者的生存分析WDR1高表达组的1、3、5年总体生存率81.2%、45.8%、24.4%与低表达组91.9%、72.9%、43.6%比较,差异显著,具有统计学意义(P<0.05);WDR1高表达组的1、3、5年无瘤生存率76.8%、29.5%、9.3%与低表达组89.2%、59.5%、25.5%比较,差异显著,具有统计学意义(P<0.05)(图 3)。
|
图 3 Kaplan-Meier法生存曲线分析 左图为WDR1高低表达组的无瘤生存曲线(P<0.05);右图为WDR1高低表达组的总体生存曲线(P<0.05) |
肝细胞癌是现今全球范围内最为常见的恶性肿瘤之一。据最新文献[5]报道,2012年全球新发病例数约为78万例,而死亡人数约为75万例,二者比例趋近于1:1,而中国HCC的发病率与死亡率均约占全球50%。据2015年统计数据,我国男性肿瘤发病情况中HCC发病例数约为29万例,位居第2,死亡率为20%,位居第2;女性中HCC发病例数为10万例,位居第5,死亡率13%居第3[6]。因其恶性程度高,复发概率高,预后差,HCC素有癌中之王的称号。随着HCC外科治疗和生物治疗的不断发展,目前临床上HCC的疗效较过去取得了一定提高,但由于大多数HCC患者确诊时已是中晚期,失去了最佳手术时机,常规放化疗又不敏感,且HCC术后常有复发转移,这些因素使得肝癌患者五年生存率仍处于30%这一水平难以提升。综合分析已有的研究表明,多肝癌的中心起源和肝内播散转移是肝癌术后复发转移的主要原因,这是造成肝癌根治性切除后转移复发和影响其长期生存最为关键的因素。其中,肿瘤细胞接受多种信号,脱离原发肿瘤,并获得增强的侵袭、迁移/运动能力是HCC侵袭转移的一个非常关键的起始因素之一。
WDR1是2002年由密歇根大学医学院Oh等人在听觉受损小鸡基低乳头毛细胞中发现,当时认为其与肌动蛋白解聚因子相互作用而有益于听觉受损小鸡内耳结构与功能的恢复[7]。Ren等[8]研究发现WDR1蛋白在果蝇中的编码基因flare发生突变后能够提升体内F-actin的水平并增加其稳定性,同时其还具有促进细胞增殖、生存发育以及维持表皮平面细胞极性(PCP)的能力。2015年,Luxenburg等[9]将小鼠胚胎中WDR1敲除后,发现角质细胞内丝切蛋白的含量上升1.3倍,F-actin上升两倍,过表达CflS3A-GFP补偿WDR1的敲除可使F-actin含量恢复正常。WDR1耗竭的表皮将导致包括Vangl2和Celsr1在内的大部分典型核心PCP蛋白异常:分子丢失、毛囊向下生长时表皮基底层细胞形态不对称及毛囊朝向随机化。经免疫荧光检验,证实了WDR1解聚蛋白/丝切蛋白活动的关键增强剂, 且与PCP的准确建立保持紧密的平衡关系。若无WDR1,上皮细胞无法成功建立PCP。最近几年对WDR1的研究主要集中在鸡、线虫、果蝇及心血管疾病方面中的作用,其对细胞骨架的作用、与F-actin和G-actin的作用及促进细胞迁移运动能力得到证实[10]。因其具有调节表皮PCP的建立,调节细胞形态与平面方向的改变,调节细胞黏附、促进细胞迁徙的功能,我们推测WDR1与HCC的侵袭转移关系密切,WDR1可能在HCC的发生发展中起着促进作用。
本次研究结果显示:HCC中WDR1的高低表达情况与AFP、肝硬化、微血管侵犯、Child-Pugh分级、TNM分期等临床病理特征存在显著的相关性(P<0.05),而和肿瘤大小、性别等其余临床病理特征的相关性不明显(P>0.05)。WDR1在HCC组织中表达水平显著高于癌旁非瘤肝组织,这在Oncomine中的Mas Liver数据库(P=0.004)及Roessler Liver 2数据库(P<0.001)中的统计分析得到验证。COX回归分析表明WDR1是HCC患者总体生存预后的独立影响因素, 也是HCC患者无瘤生存预后的独立影响因素。Kaplan-Meier生存分析结果显示WDR1高表达组的总体生存率(1、3、5年总体生存率:81.2%、45.8%、24.4% vs 91.9%、72.9%、43.6%,P<0.05)和无瘤生存率(1、3、5年无瘤生存率:76.8%、29.5%、9.3% vs 89.2%、59.5%、25.5%,P<0.05)均显著低于WDR1低表达组。这表明WDR1与HCC存在较为紧密的联系,通过对WDR1的深入研究将会加深对HCC的认识;而本次研究结果发现其可能的促癌作用,将对HCC的药物治疗机制以及药物的研制也有着一定的启发意义。同时,WDR1作为HCC总体生存和无瘤生存的独立预后危险因素,在判断HCC患者预后方面存在重要的临床价值,值得深入研究。因本次研究时间有限,仅做了免疫组织化学检测及临床相关性分析,对WDR1在HCC中的作用机制以及药物干预方面未做探讨,故而临床以及基础医学方面的证据较为单薄,还有待进一步的深入研究。
综上所述,WDR1是HCC患者的独立预后危险因素,WDR1高表达者预后差。
| [1] | Kuhns DB, Fink DL, Choi U, et al. Cytoskeletal abnormalities and neutrophil dysfunction in WDR1 deficiency[J]. Blood, 2016, 128(17): 2 135-2 143. DOI: 10.1182/blood-2016-03-706028. |
| [2] | Xiao S, Chang RM, Yang MY, et al. Actin-like 6A predicts poor prognosis of hepatocellular carcinoma and promotes metastasis and epithelial-mesenchymal transition[J]. Hepatology, 2016, 63(4): 1 256-1 271. DOI: 10.1002/hep.28417. |
| [3] | Luchini C, Chilosi M, Manfrin E. The importance of immunohistochemistry in the differential diagnosis of molar disease[J]. Pathologica, 2016, 108(4): 151-153. |
| [4] | Wang Y, Bu F, Royer C, et al. ASPP2 controls epithelial plasticity and inhibits metastasis through β-catenin-dependent regulation of ZEB1[J]. Nature Cell Biology, 2014, 16(11): 1 092-1 104. DOI: 10.1038/ncb3050. |
| [5] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI: 10.3322/caac.21262. |
| [6] | Chen W, Zheng R, Baade PD, et al. Cancer Statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI: 10.3322/caac.21338. |
| [7] | Oh SH, Adler HJ, Raphael Y, et al. WDR1 colocalizes with ADF and actin in the normal and noise-damaged chick cochlea[J]. J Comp Neurol, 2002, 448(4): 399-409. DOI: 10.1002/(ISSN)1096-9861. |
| [8] | Ren N, Charlton J, Adler PN. The flare gene, which encodes the AIP1 protein of Drosophila, functions to regulate F-actin disassembly in pupal epidermal cells[J]. Genetics, 2007, 176(4): 2 223-2 234. DOI: 10.1534/genetics.107.072959. |
| [9] | Luxenburg C, Heller E, Pasolli HA, et al. Wdr1-mediated cell shape dynamics and cortical tension are essential for epidermal planar cell polarity[J]. Nat Cell Biol, 2015, 17(5): 592-604. DOI: 10.1038/ncb3146. |
| [10] | Xu J, Wan P, Wang M, et al. AIP1-mediated actin disassembly is required for postnatal germ cell migration and spermatogonial stem cell niche establishment[J]. Cell Death Dis, 2015, 182(6): e1818. |
 2018, Vol. 39
2018, Vol. 39


