肠缺血再灌注损伤(intestinal ischemia reperfusion, IIR)是临床上遇到的常见问题,在新生儿坏死性肠炎[1]、急性肠系膜缺血[2]、肠扭转[3]、肠移植[4]、创伤[5]、休克[5, 6]、心肺功能不全[7]等疾患的病理演变过程中起重要作用。IIR除了会引起局部组织的损伤外,更会由于细菌和毒素的释放、移位到体循环而引起网状内皮系统发生系列反应,甚至发生多系统器官功能不全综合征(multiple organ dysfunction syndrome, MODS)[8],故对于小肠的缺血再灌注(ischemia reperfusion, IR)损伤研究目前倍受重视。Parkin的作用首先在心脏被证实,在离体和在体大鼠的心脏中缺血预处理通过Parkin诱导的线粒体易位产生心脏保护作用[9]。在对糖尿病心肌缺血再灌注的研究中还发现自噬水平降低可促使受损线粒体在心肌中聚集[10],加重心肌组织中线粒体的紊乱,恶化心肌功能和增加糖尿病小鼠的死亡率[10]。这些研究结果表明,Parkin可以通过调控线粒体自噬对糖尿病的心脏缺血再灌注后的心肌起到保护作用,但Parkin在糖尿病肠缺血再灌注中的作用亟待研究。本研究通过复制糖尿病模型,观察Parkin在肠缺血再灌注损伤中的动态变化,探讨Parkin在糖尿病鼠IIR所致的肠损伤的易损性增加中的作用。
1 材料与方法 1.1 试剂与仪器兔抗鼠Parkin单克隆抗体购于美国Cell Signal公司;I-FABP的ELISA试剂盒购于美国Market公司;Bio Vision公司的D-乳酸检测分析试剂盒;BCA蛋白测定试剂盒购自南京建成生物有限公司;链脲佐菌素(STZ)干粉购于美国Sigma公司;甲醛购自南京化学公司;血糖试剂购自美国强生公司;血糖仪(美国强生公司);正置显微镜(日本Olympus公司)。
1.2 动物健康野生型SPF级雄性C57BL/6J小鼠42只,6-8周,体重20-25 g, 购于北京维通利华实验动物技术有限公司。适应性喂养1周。
1.3 糖尿病小鼠模型的建立糖尿病组适应性喂养1周后禁食12 h后,一次性经腹腔注射STZ(220 mg/kg),72 h后断尾取尾尖血测血糖值,当血糖浓度≥16.7 mmol/L且出现多饮、多食、多尿症状提示糖尿病鼠模型诱导成功。实验期间每周采血监测血糖水平,连续3周,若血糖值持续≥16.7 mmol/L则表明小鼠糖尿病模型造模成功。非糖尿病组只注射等量生理盐水。
1.4 小鼠肠缺血再灌注模型的建立复制肠缺血再灌注模型[11]。经腹腔注射1.5%戊巴比妥钠溶液0.005 ml/g将小鼠进行麻醉,仰卧位固定小鼠。小鼠麻醉后腹部正中脱毛,消毒铺巾,正中切口进腹,分离肠系膜上动脉,微动脉夹夹闭肠系膜上动脉(SMA)根部,观察2 min,确定血管搏动消失,肠壁苍白,肠系膜上动脉血流被阻断后,缝合伤口。45 min后经原切口进腹,松开动脉夹恢复血供。S组同样开腹,除不钳夹血管外其余操作同IR所有小鼠在灌注2 h后处死,取小肠组织纵行切开冲洗后分别用10%多聚甲醛固定,液氮冰冻。
1.5 实验分组将C57BL/6J小鼠随机分成4组,分别为对照组(S)、正常肠缺血再灌注组(IR组)、糖尿病非缺血再灌注组(DS)和糖尿病缺血再灌注组(DIR)。分别为8只、10只、14只、20只,保证每组至少8只样本量。
1.6 指标检测及方法 1.6.1 肠黏膜病理学检测将新鲜缺血区小肠组织在冰磷酸盐缓冲液(pH 7.4)中反复洗涤后放在甲醛(pH 7.4)中暂时保存,用石蜡包埋后切片,厚度5 μm,HE染色,在奥林巴斯显微镜下观察并HPIAS-1000医学彩色图像分析系统采集图像,Image pro plus 6.0软件进行分析,每个标本取2个不同切片10个视野,观察小肠组织病理学变化并采用Chiu's病理学评分[12]。
1.6.2 小肠组织含水量的测定取各组小鼠的小肠组织,在天平上称量湿重后,放在110 ℃干燥箱中21 h,再次称重,记录为干重。以含水率=(湿重-干重)/湿重×100 %来表示小肠组织的含水量。
1.6.3 肠脂肪酸结合蛋白(I-FABP)和D-乳酸的检测经小鼠腹主动脉取血后,预冷离心机到4 ℃后,将血液离心取血清,分别使用美国Market公司的ELISA试剂盒和Bio Vision公司的D-乳酸检测分析试剂盒(比色法),按照说明书操作,检测出血清中I-FABP和D-乳酸的浓度。
1.6.4 Western Blot检测蛋白表达水平取各组小鼠的小肠组织,用4 ℃预冷PBS洗3次,按比加入RIPA裂解液裂解,冰上裂解30 min后用超声裂解,低温离心取上清后,按照BCA试剂盒的步骤测蛋白浓度,并对蛋白进行定量后加5×上样缓冲液并煮沸变性10 min,进行SDS-PAGE。转膜使蛋白转至PDVF膜,5%脱脂奶粉室温封闭1 h,然后用兔抗鼠Parkin单克隆抗体(稀释度1:1 000, Cell Signal公司,美国)4 ℃摇床孵育过夜,孵育一抗结束后,在室温下用TBST洗3次,每次10 min,用羊抗兔二抗(稀释度1:10 000,LI-COR公司,美国)室温孵育1 h后,室温下用TBST洗3次,每次10 min, 最后将膜放在ODYSSEY双色红外激光成像系统扫描。以目的蛋白条带灰度值与β-Actin条带灰度值的比值反映目的蛋白的表达。
1.6.5 统计学方法所有数据采用GraphPad Prism统计软件进行分析,以均数±标准差(x±s)表示,多组间两两比较采用单因素方差分析(One-way ANNOVA),用Tukey法进行均数间的多重比较,P<0.05为差异具有统计学意义。
2 结果 2.1 肠组织病理学观察S组肠黏膜连续完好,小肠绒毛排列整齐;DS组肠黏膜增厚,小肠绒毛上皮细胞轻度水肿,顶端上皮下出现囊状间隙;IR组肠黏膜失去正常结构,绒毛破损脱落,间质断裂,炎性细胞浸润,固有层细胞成分增多;DIR组相比于IR组肠黏膜破坏更严重,上皮细胞层坏死脱落,固有层破坏,可见散在的出血和溃疡灶。Chiu's病理学评分显示糖尿病组的肠黏膜损伤程度比对应的非糖尿病组的肠黏膜损伤重(DS组肠黏膜损伤程度比S组重,DIR组肠黏膜损伤程度比IR组重),肠缺血再灌注组(IR组和DIR组)的肠黏膜损伤程度比对应的对照组(S组和DS组)损伤程度重。差异均有统计学意义(P<0.05)(见图 1及表 1)。
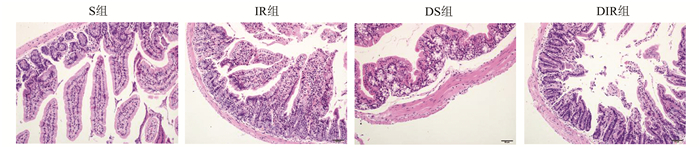
|
图 1 4组小鼠肠组织病理学变化(HE×200) |
| 表 1 4组小鼠肠组织Chiu's病理学评分和含水量比较(n=8, x±s) |
肠缺血再灌注组(IR组和DIR组)的含水量相比于未做缺血处理组(S组和DS组)显著增加(P<0.05);糖尿病组(DS组和DIR组)与对应的非糖尿病组(D组和IR组)相比含水量显著增加(P<0.05)(见表 1)。
2.3 小鼠血清D-乳酸、I-FABP水平肠缺血再灌注组(IR组与DIR组)与相对应的非肠缺血再灌注组(S组和DS组)相比,D-乳酸与I-FABP水平明显增加(P<0.05);与糖尿病组(DS组与DIR组)相比,相应的对照组(S组与IR组)的D-乳酸与I-FABP水平增加(P<0.05)(见表 2)。
| 表 2 小鼠血清D-乳酸、I-FABP水平的比较(n=8, x±s) |
Western Blot结果显示与非糖尿病组(S组和IR组)相比,相应的糖尿病组(DS组和DIR组)Parkin蛋白表达含量增加,肠缺血再灌注组(IR组和DIR组)比对应的非肠缺血再灌注组(S组和DS组)Parkin蛋白表达含量显著增加,差异均有统计学意义(P<0.05)(见图 2和表 3)。
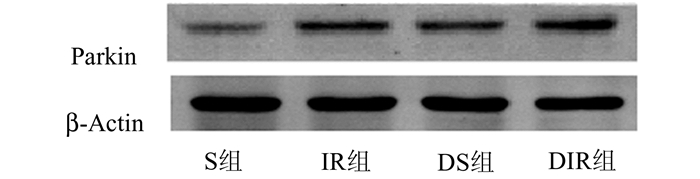
|
图 2 4组小鼠肠组织中Parkin蛋白印迹图 |
| 表 3 4组小鼠小肠组织蛋白Parkin表达的变化(n=8, x±s) |
缺血再灌注损伤是一个复杂的病理过程,涉及到钙超载、氧化应激、内质网应激、线粒体功能障碍、细胞凋亡、蛋白激酶激活和炎症变化等过程,这些过程在缺血再灌注损伤中都发挥重要作用并且相互关联。研究表明,糖尿病导致缺血再灌注损伤易感性增加有关[13],但这种易感性增加的机制尚不清楚, 可能与继发于高血糖症的氧化应激水平增加有关。糖尿病中氧化应激增加主要是由于内源性抗氧化防御系统的活性氧(ROS)产生与清除之间的不平衡[14]。这种不平衡的严重程度可能与糖尿病背景下缺血再灌注损伤的严重程度有关。氧化应激是糖尿病细胞损伤的关键因素,线粒体是ROS的主要细胞来源。大约4%的线粒体消耗的氧被转化为ROS[15]。有部分研究认为糖尿病是线粒体疾病,因为高血糖诱导的损伤机制,如增加多元醇途径通量,增加晚期糖基化终产物(AGE)形成,蛋白激酶C(PKC)的激活等均反映高血糖诱导过程中线粒体电子传递链过度生产超氧化物[16, 17]。
小鼠小肠含水量可以反映小肠的脱水和损伤后水肿情况。本研究结果显示,与肠缺血再灌注组(IR组和DIR组)相比,非肠缺血再灌注组(S组和DS组)小肠含水量减少,在缺血期间,由于正常的黏膜屏障受损和渗透性增加,小肠水肿明显,小肠含水量增加;糖尿病组(DS组和DIR组)与非糖尿病组(S组和IR组)相比,糖尿病小鼠由于血糖升高,多有渗透性脱水,同时小肠正常的黏膜屏障受损,渗透性增加,小肠的损伤增加,导致小肠水肿,含水量增加。
研究表明I-FABP的高度敏感性和D-乳酸的高度特异性可以为诊断肠缺血提供有力依据。I-FABP仅在肠中表达,并且在组织损伤后释放出细胞外,I-FABP可检测急性肠缺血、肠细胞损伤的败血症的早期阶段、肠损伤引起的灌注不足等,且与患者的损伤严重程度相关[18]。D-乳酸盐仅由结肠细菌产生,作为细菌发酵的正常副产物。在缺血期间,由于正常的黏膜屏障受损和渗透性增加,大量的D-乳酸通过损伤的肠黏膜释放到外周血中,由于肝脏不能代谢D-乳酸,导致血清中D-乳酸水平升高[19]。因此,I-FABP和D-乳酸水平可作为急性肠损伤早期诊断依据且可间接反映肠黏膜损伤程度。本研究结果显示,肠缺血再灌注组(IR组和DIR组)与对应的非肠缺血再灌注组(D组和DS组)相比,I-FABP和D-乳酸水平显著增高,Chiu's病理学评分增高,表明小鼠肠缺血再灌注模型建立成功。糖尿病组(DS组和DIR组)与对照组(S组和IR组)相比,I-FABP和D-乳酸水平增加,Chiu's病理学评分增高,反映糖尿病增加了肠缺血再灌注损伤的易损性。
Parkin是一种E3泛素连接酶,其催化泛素从E2泛素连接酶向蛋白质底物转移的过程称为泛素化[20]。在基础条件下,Parkin主要位于胞质溶胶中,其泛素连接酶活性被抑制。在细胞应激之后,Parkin以Pink1依赖的方式转位到损伤的线粒体中,以泛素化多种线粒体底物介导线粒体碎裂、降解和自噬[21]。Pink1/Parkin通路介导线粒体自噬最早发现于神经系统退行性病变中,它是帕金森氏病的病理机制之一[22]。研究进一步发现,Pink1/Parkin调控线粒体自噬不仅存在于神经系统,也同样存在于心血管系统。线粒体自噬水平下降会导致ROS生成、炎症反应、细胞凋亡[23]等,而ROS的生成导致氧化应激又会增加缺血再灌注的易损性。本研究发现与非肠缺血再灌注组(S组和DS组)相比,相应的肠缺血再灌注组(IR组和DIR组)Parkin的蛋白表达量增高;与IR组相比,DIR组的Parkin蛋白表达量进一步增高。由此可见,在糖尿病鼠的肠缺血再灌注损伤中,随着易损性的增加Parkin蛋白表达量增加。
综上所述,Parkin在糖尿病鼠的肠缺血再灌注损伤所致的易损性增加中有重要作用,但目前仍无可靠证据证实Parkin与肠缺血再灌注损伤的易损性间存在因果关系,需待后期进一步研究。
| [1] | Nankervis CA, Giannone PJ, Reber KM. The neonatal intestinal vasculature: contributing factors to necrotizing enterocolitis[J]. Semin Perinatol, 2008, 32(2): 83-91. DOI: 10.1053/j.semperi.2008.01.003. |
| [2] | Yasuhara H. Acute mesenteric ischemia: the challenge of gastroenterology[J]. Surg Today, 2005, 35(3): 185-195. DOI: 10.1007/s00595-004-2924-0. |
| [3] | Schwartz MZ. Novel therapies for the management of short bowel syndrome in children[J]. Pediatr Surg Int, 2013, 29(10): 967-974. DOI: 10.1007/s00383-013-3404-7. |
| [4] | Mallick IH, Yang W, Winslet MC, et al. Ischemia-reperfusion injury of the intestine and protective strategies against injury[J]. Dig Dis Sci, 2004, 49(9): 1359-1377. DOI: 10.1023/B:DDAS.0000042232.98927.91. |
| [5] | Corcos O, Nuzzo A. Gastro-intestinal vascular emergencies[J]. Best Pract Res Clin Gastroenterol, 2013, 27(2): 709-725. |
| [6] | Fishman JE, Sheth SU, Levy G, et al. Intraluminal nonbacterial intestinal components control gut and lung injury after trauma hemorrhagic shock[J]. Ann Surg, 2014, 260(6): 1112-1120. DOI: 10.1097/SLA.0000000000000631. |
| [7] | Sastry P, Hardman G, Page A, et al. Mesenteric ischaemia following cardiac surgery: the influence of intraoperative perfusion parameters[J]. Interact Cardiovasc Thorac Surg, 2014, 19(3): 419-424. DOI: 10.1093/icvts/ivu139. |
| [8] | Lenaerts K, Ceulemans LJ, Hundscheid IHR, et al. New insights in intestinal ischemia-reperfusion injury: implications for intestinal transplantation[J]. Curr Opin Organ Transplant, 2013, 18(3): 298-303. DOI: 10.1097/MOT.0b013e32835ef1eb. |
| [9] | Huang C, Andres AM, Ratliff EP, et al. Preconditioning involves selective mitophagy mediated by Parkin and p62/SQSTM1[J]. PLoS One, 2011, 6(6): e20975. DOI: 10.1371/journal.pone.0020975. |
| [10] | Xie Z, Lau K, Eby B, et al. Improvement of cardiac functions by chronic metformin treatment is associated with enhanced cardiac autophagy in diabetic OVE26 mice[J]. Diabetes, 2011, 60(6): 1770-1778. DOI: 10.2337/db10-0351. |
| [11] |
孟庆涛, 江莹, 孙倩, 等. 缺血后处理对小鼠肠缺血再灌注所致急性肺损伤保护作用中炎症介质的影响[J].
武汉大学学报:医学版, 2012, 33(4): 487-490.
Meng QT, Jiang Y, Sun Q, et al. Changes of inflammatory factors in protection effect of ischemic postconditioning on acute lung Injury induced by intestinal ischemia-reperfusion[J]. Medical Journal of Wuhan University, 2012, 33(4): 487-490. |
| [12] | Chiu CJ. Intestinalmucosal lesion in low-flow states. I.a morphological, hemodynamic, and metabolic reappraisal[J]. Arch Surg, 1970, 101(4): 478-483. DOI: 10.1001/archsurg.1970.01340280030009. |
| [13] | Miki T, Itoh T, Sunaga D, et al. Effects of diabetes on myocardial infarct size and cardioprotection by preconditioning and postconditioning[J]. Cardiovasc Diabetol, 2012, 11(1): 1-13. DOI: 10.1186/1475-2840-11-1. |
| [14] | Giacco F, Brownlee M. Oxidative Stress and Diabetic Complications[J]. Circ Res, 2010, 107(9): 1058-1070. DOI: 10.1161/CIRCRESAHA.110.223545. |
| [15] | Lenaz G, Bovina C, D'Aurelio M, et al. Role ofmitochondria in oxidative stress and aging[J]. Ann N Y Acad Sci, 2002, 959(1): 199-213. DOI: 10.1111/j.1749-6632.2002.tb02094.x. |
| [16] | Sack MN. Type 2 diabetes, mitochondrial biology and the heart[J]. J Mol Cell Cardiol, 2009, 46(6): 842-849. DOI: 10.1016/j.yjmcc.2009.02.001. |
| [17] | Brownlee M. Biochemistry and molecular cell biology of diabetic complications[J]. Nature, 2001, 414(6865): 813-820. DOI: 10.1038/414813a. |
| [18] | Voth M, Duchene M, Auner B, et al. I-FABP is anovel marker for the detection of intestinal injury in severely injured trauma patients[J]. World J Surg, 2017, 41(12): 3120-3127. DOI: 10.1007/s00268-017-4124-2. |
| [19] | Shi H, Wu B, Wan J, et al. The role of serum intestinal fatty acid binding protein levels and D-lactate levels in the diagnosis of acute intestinal ischemia[J]. Clin Res Hepatol Gastroenterol, 2015, 39(3): 373-378. DOI: 10.1016/j.clinre.2014.12.005. |
| [20] | Winklhofer KF. Parkin and mitochondrial quality control: toward assembling the puzzle[J]. Trends Cell Biol, 2014, 24(6): 332-341. DOI: 10.1016/j.tcb.2014.01.001. |
| [21] | Narendra D, Walker JE, Youle R. Mitochondrial quality control mediated by PINK1 and parkin: links to parkinsonism[J]. Cold Spring Harb Perspect Biol, 2012, 4(11): pii: a011338. |
| [22] | Nunnari J, Suomalainen A. Mitochondria: in sickness and in health[J]. Cell, 2012, 148: 1145-1159. DOI: 10.1016/j.cell.2012.02.035. |
| [23] | Lupfer C, Thomas PG, Anand PK, et al. Receptor interacting protein kinase2-mediated mitophagy regulates inflammasome activation during virus infection[J]. Nat Immunol, 2013, 14: 480-488. DOI: 10.1038/ni.2563. |
 2018, Vol. 39
2018, Vol. 39


