2. 长沙市口腔医院口腔颌面外科 湖南 长沙 410000;
3. 遵义医学院附属口腔医院 预防儿童牙科 贵州 遵义 563000
2. Dept. of Oral and Maxillofacial Surgery, Stomatological Hospital of Changsha, Changsha 410000, China;
3. Dept. of Pediatric Dentistry, Stomatological Hospital of Zunyi Medical University, Zunyi 563000, Guizhou, China
现有研究表明Sonic Hedgehog (Shh)信号通路在腭生长调控网络发挥关键作用,Shh为Hedgehog (Hh)通路的一种,该类通路信号传递与初级纤毛密切相关[1, 2]。虽然初级纤毛存在于大多数类型细胞中,但目前尚未有文献报道小鼠胚胎腭间充质细胞是否具有初级纤毛,在小鼠胚胎腭发育中起重要作用的Shh信号是否也通过初级纤毛传递尚不清楚,本实验通过体外细胞培养小鼠胚胎腭间充质细胞,观察该细胞上是否存在初级纤毛,并探索影响细胞上初级纤毛的因素,为后期对小鼠胚胎腭间充质细胞初级纤毛相关研究提供基础。
1 材料与方法 1.1 主要实验材料 1.1.1 实验动物C57BL/6J小鼠,重庆第三军医大学医学实验动物中心,许可证号(SCXK(渝)2012-0005)。遵义医学院医学与生物学研究中心动物房饲养,普通食物及饮水自取,室内温度16-28 ℃,通风环境,相对湿度30%-70%,定期更换垫料,补充饮水及饲料。
1.1.2 主要试剂中性蛋白酶(Dispase Ⅱ)、胰蛋白酶、DMEM/F-12培养基、胎牛血清(Fetal Bovine Serum, FBS)、PBS缓冲液、小鼠抗乙酰化α-tubulin单克隆抗体(32-2700;Thermo Fisher,美国)、山羊抗小鼠IgG二抗结合Alexa 555(A-21424;Thermo Fisher,美国)、兔抗γ-tubulin单克隆抗体(PA-5-34815;Thermo Fisher,美国)、山羊抗兔IgG二抗结合Alexa 488(A-11034;Thermo Fisher,美国)、DAPI荧光核染剂及SlowFadeTM抗荧光淬灭液(S36964;Thermo Fisher,美国)、兔抗Smo多克隆抗体(SAB4502822;Sigma-Aldrich,美国)。
1.1.3 主要仪器显微用镊子及剪、体式显微镜及摄像系统(Leica Microsystems,德国)、超净工作台、倒置相差显微镜(Olympus,日本)、倒置荧光显微镜(Leica Microsystems,德国)、激光共聚焦显微镜(Leica Microsystems,德国)。
1.2 方法 1.2.1 小鼠胚胎腭间充质细胞的获取本实验所有对实验动物的操作均通过遵义医学院动物实验伦理委员会伦理审查并同意后实施。分别获取孕期天数(ED)为13.5、14.5、15.5的C57BL/6J孕鼠胚胎。分离胚胎头部,PBS冲洗,移至体式显微镜下,眼科镊及弯刃显微剪在镜下剪去下颌及舌后暴露腭部,用显微剪分别将两侧的腭板取出。使用中性蛋白酶低温消化腭板,冰箱2-8 ℃过夜。PBS冲洗,于体式显微镜下,可见上皮与间充质基本相互分离,显微镊挑取间充质组织,移除粘连上皮。收集的间充质组织块0.25%胰蛋白酶消化,终止消化后使用含15%FBS的DMEM/F-12培养基将细胞制成悬液吸入6孔板培养,5% CO2、37 ℃二氧化碳培养箱孵育,次日换液,后隔2 d换液,待铺满70%时收集细胞。将一只雌鼠所有胚胎的腭间充质细胞在不传代情况下统一染色后进行观察。
1.2.2 免疫细胞化学染色通过广谱细胞角蛋白(Pan-Cytokeratin,P-CK)和波形蛋白(Vimentin,Vim)单克隆抗体对同一批次培养的细胞分别进行处理,加入相应二抗,DAB显色,苏木素核染后封片观察。
1.2.3 免疫荧光染色收集细胞后种入共聚焦培养皿过夜后,吸出培养基,4%多聚甲醛固定。血清封闭,室温1 h,甩干。滴加稀释至1:200一抗(小鼠抗乙酰化α-tubulin、兔抗γ-tubulin或兔抗Smo),室温1 h,甩干。PBS冲洗3次,甩干。滴加稀释至1:200二抗(山羊抗小鼠IgG、山羊抗兔IgG),室温,避光,1 h,甩干。PBS冲洗3次,甩干。于培养皿内加入DAPI荧光核染剂及SlowFadeTM抗淬灭液,室温10 min,甩干。冲洗3次,甩干。显微镜下观察。
1.2.4 血清饥饿将细胞种入共聚焦培养皿中过夜,原有培养基吸出后PBS冲洗,行血清饥饿的细胞单纯加入DMEM/F-12培养基,培养箱中培养24 h。第2日取出后固定后如上述方法行免疫荧光染色。
1.2.5 观察拍照倒置相差显微镜下对免疫细胞化学染色处理细胞进行观察,拍照记录。激光共聚焦显微镜及倒置荧光显微镜下寻找、观察细胞初级纤毛。
对血清饥饿处理的细胞在400倍镜下,每个共聚焦培养皿中选取6个连续不重叠的视野观察。计算有纤毛细胞数,阳性细胞百分比计算方法为6个视野中有纤毛细胞数的总和除以视野中总细胞数。
1.2.6 统计分析实验数据采用SPSS Statistics 17.0软件处理分析。
2 结果 2.1 免疫细胞化学染色结果对所培养的细胞免疫细胞化学结果中,P-CK标记后镜下未见染色细胞。Vim标记后阳性百分比为(96.83±1.34)%(结果未展示)。
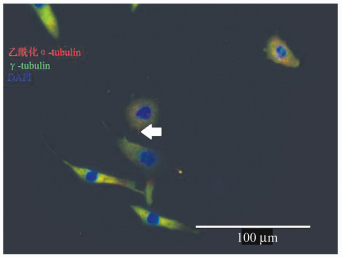
2.2 免疫荧光染色实验结果倒置荧光显微镜镜下γ-tubulin标记的是初级纤毛基底部,为绿色荧光;乙酰化α-tubulin标记的初级纤毛体部,为红色荧光;细胞核呈蓝色荧光。其中只有 < 1%的细胞显示出红色荧光及绿色荧光共同标记出的初级纤毛结果(图 1)。
|
图 1 小鼠胚胎腭间充质细胞纤毛观察 γ-tubulin染色为绿色荧光;乙酰化α-tubulin染色为红色荧光;细胞核呈蓝色荧光,箭头所指为观察到细胞纤毛 |
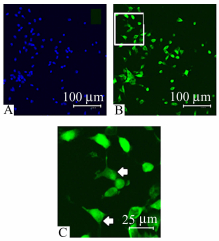
取ED13.5/14.5/15.5胚胎腭部细胞培养后,进行血清饥饿处理24 h,通过免疫荧光染色标记有纤毛细胞,计算有纤毛细胞占总细胞的数量比例(图 2),计算结果见表 1。
|
图 2 小鼠胚胎腭板间充质细胞纤毛细胞计算 A:细胞核染色,通过计算该视野下细胞数得出总细胞数; B: Smo染色,观察细胞纤毛影像计算有纤毛细胞数; C:为图B中白框放大后的图像,箭头所指为有纤毛细胞 |
| 表 1 不同ED小鼠胚胎腭板间充质细胞纤毛率(%) |
小鼠腭生长发生于ED11.5至ED17。腭中央部分是间充质细胞,包围一层较薄的上皮组织[3]。本实验中通过体式显微镜镜下取材可以确定所取组织为小鼠胚胎腭板。同时采用抗P-CK单克隆抗体和抗Vim单克隆抗体对所分离培养的原代细胞进行免疫细胞化学染色,结果显示细胞Vim呈阳性表达,P-CK呈阴性表达,最终说明通过本实验中所述方法分离培养的细胞为小鼠胚胎腭间充质细胞。
小鼠的腭在发育过程中,Shh蛋白在ED11.5- ED14.5广泛表达于腭上皮[4]。Smoothened (Smo)为Shh信号下游蛋白,已有研究表明敲除小鼠颅神经嵴细胞中的Smo可导致继发腭发育不全[5],在小鼠腭上皮中敲除Shh在或是在腭间充质中条件敲除Smo的研究均证明Shh信号对腭板发育有关键作用[6, 7]。而初级纤毛是哺乳动物中Hh信号传导密切相关的细胞器[8, 9]。目前研究已知的Shh信号常规传导方式为通过启动细胞的初级纤毛内传导通路[10]。但尚未有关于小鼠腭间充质细胞是否具有初级纤毛的相关文献报道,故本次研究中使用了免疫荧光标记的方法,在体外培养的C57BL/6J小鼠胚胎腭间充质细胞上观察到初级纤毛,有纤毛细胞数量极为稀少,有纤毛细胞占总细胞比例 < 1%。该结果说明,若不加处理,体外培养的腭间充质细胞中有纤毛细胞数量较低,不利于后期实验对细胞初级纤毛观测及纤毛内蛋白定位研究。
虽然目前研究发现与初级纤毛相关的信号分子较多,如Shh信号网络蛋白(Ptch、Smo)以及Wnt通路相关蛋白[11, 12],然而目前研究中公认的决定细胞是否组装初级纤毛的重要因素是细胞周期,初级纤毛的组装与拆解与细胞周期有关。进入分裂期时,初级纤毛将会解体,退出周期时则会重新组装[13, 14]。若使用血清饥饿后能使细胞退出细胞周期,可以提高细胞形成初级纤毛的几率。
当细胞处于G1期或静止期时由附着于质膜上的细胞内中心粒开始纤毛组装[15-18]。中心粒可转化为初级纤毛的基底小体,作为其“9+0”轴丝结构的基础,纤毛的伸长及信号转导由纤毛内转运蛋白(intraflagellar transport, IFT)完成,IFT系统包括了正向运输的kinesin蛋白和逆向运输的dynein蛋白[19-21]。纤毛组装为高尔基小体和核内体的胞质小泡,远端附件小泡(distal appendage vesicle, DAV)向上述中心粒聚集附着[22-24],在中心粒远端融合后产生一个帽状物[25]。在这个帽状物下,向远离胞核方向伸长,随着纤毛鞘与质膜融合代表纤毛完成附着。相比纤毛组装,纤毛拆解过程报道较少,已知重要调控子为骨架蛋白HEF1和Aurora A激酶[26]。以及驱动蛋白Kif2a促进纤毛微管解聚和Kif24抑制纤毛重新组装[27, 28]。
结合目前的研究结果,未处理的间充质细胞中有纤毛细胞较少的可能因素为:①未作血清饥饿的原代培养细胞周期不统一,细胞初级纤毛因为处于有丝分裂期已拆解;②由于所观察到的纤毛较少,不能排除已发现的纤毛图像为固定染色过程中产生的假象;③有初级纤毛细胞数量受胚胎天数影响;④细胞取材自完整腭板,而完整腭板的鼻腔侧间充质细胞无Shh下游原件,不接收Shh信号。此外,亦不能排除这种低比率为培养细胞自身属性使然,因ED13.5-ED15.5小鼠腭部处于快速发展阶段,若多数细胞皆为有纤毛细胞(即处于G1期或静止期),则会减慢其增值速度。
为明确该实验结果出现原因,后期使用了取不同胚胎天数胚胎及血清饥饿处理观察有初级纤毛细胞。处理后实验结果说明:血清饥饿可以提高体外培养的小鼠胚胎腭间充质细胞中有初级纤毛细胞数量;不同胚胎天数胚胎有初级纤毛细胞比例无明显差异。同时,已有文献报道,初级纤毛在Shh信号未激活时亦有一定基础水平的Smo蛋白存在于纤毛内,免疫荧光标记后纤毛呈突出胞体表面的指状突起,故血清饥饿后通过标记Smo来定位初级纤毛[29]。
血清饥饿处理后发现,有初级纤毛细胞比例较未处理多。目前考虑:文献表明鼻腔侧腭板间充质不表达Shh下游原件,故推测该部分间充质细胞不组装初级纤毛,已有取材手段无法区分口鼻腔侧腭板组织,故有初级纤毛细胞比例较低。通过血清饥饿,在400倍镜视野下的50-80个细胞中可观察到2-3个有纤毛细胞,可满足实验需要。同时后期实验中将尝试分离口鼻腔侧腭板来提高有初级纤毛细胞比例。
本实验表明,离体培养的ED13.5-ED15.5小鼠胚胎腭间充质细胞具有初级纤毛,且有纤毛细胞比例受血清饥饿处理影响。
| [1] | Mukhopadhyay S, Rohatgi R. G-protein-coupled receptors, Hedgehog signaling and primary cilia[J]. Seminars in Cell & Developmental Biology, 2014, 33: 63-72. |
| [2] | Xu J, Liu H, Lan Y, et al. A Shh-Foxf-Fgf18-Shh Molecular Circuit Regulating Palate Development[J]. PLoS Genetics, 2016, 12(1): e1005769. DOI: 10.1371/journal.pgen.1005769. |
| [3] | Lan Y, Xu J, Jiang R. Cellular and Molecular Mechanisms of Palatogenesis[J]. Current Topics in Developmental Biology, 2015, 115: 59-84. DOI: 10.1016/bs.ctdb.2015.07.002. |
| [4] | Rice R, Connor E, Rice DP. Expression patterns of Hedgehog signalling pathway members during mouse palate development[J]. Gene Expression Patterns: GEP, 2006, 6(2): 206-212. DOI: 10.1016/j.modgep.2005.06.005. |
| [5] | Jeong J, Mao J, Tenzen T, et al. Hedgehog signaling in the neural crest cells regulates the patterning and growth of facial primordia[J]. Genes & Development, 2004, 18(8): 937-951. |
| [6] | Rice R, Spencer-Dene B, Connor EC, et al. Disruption of Fgf10/Fgfr2b-coordinated epithelial-mesenchymal interactions causes cleft palate[J]. Journal of Clinical Investigation, 2004, 113(12): 1 692-1700. DOI: 10.1172/JCI20384. |
| [7] | Lan Y, Jiang R. Sonic hedgehog signaling regulates reciprocal epithelial-mesenchymal interactions controlling palatal outgrowth[J]. Development, 2009, 136(8): 1 387-1 396. DOI: 10.1242/dev.028167. |
| [8] | Huangfu D, Liu A, Rakeman AS, et al. Hedgehog signalling in the mouse requires intraflagellar transport proteins[J]. Nature, 2003, 426(6 962): 83-87. |
| [9] | Liu A, Wang B, Niswander LA. Mouse intraflagellar transport proteins regulate both the activator and repressor functions of Gli transcription factors[J]. Development, 2005, 132(13): 3 103-3111. DOI: 10.1242/dev.01894. |
| [10] | Drummond IA. Cilia functions in development[J]. Current Opinion in Cell Biology, 2012, 24(1): 24-30. DOI: 10.1016/j.ceb.2011.12.007. |
| [11] | Lienkamp S, Ganner A, Walz G. Inversin, Wnt signaling and primary cilia[J]. Differentiation, 2012, 83(2): S49-S55. DOI: 10.1016/j.diff.2011.11.012. |
| [12] | Moore ER, Jacobs CR. The primary cilium as a signaling nexus for growth plate function and subsequent skeletal development[J]. J Orthop Res, 2018, 36(2): 533-545. |
| [13] | Seeley ES, Nachury MV. The perennial organelle: assembly and disassembly of the primary cilium[J]. Journal of Cell Science, 2010, 123(Pt 4): 511-518. |
| [14] | Ishikawa H, Marshall WF. Ciliogenesis: building the cell's antenna[J]. Nat Rev Mol Cell Biol, 2011, 12(4): 222-234. DOI: 10.1038/nrm3085. |
| [15] | Kobayashi T, Dynlacht BD. Regulating the transition from centriole to basal body[J]. The Journal of Cell Biology, 2011, 193(3): 435-444. DOI: 10.1083/jcb.201101005. |
| [16] | Gonczy P. Towards a molecular architecture of centriole assembly[J]. Nat Rev Mol Cell Biol, 2012, 13(7): 425-435. DOI: 10.1038/nrm3373. |
| [17] | Nigg EA, Stearns T. The centrosome cycle: Centriole biogenesis, duplication and inherent asymmetries[J]. Nature Cell Biology, 2011, 13(10): 1 154-1160. DOI: 10.1038/ncb2345. |
| [18] | Avasthi P, Marshall WF. Stages of ciliogenesis and regulation of ciliary length[J]. Differentiation; Research in Biological Diversity, 2012, 83(2): S30-S42. DOI: 10.1016/j.diff.2011.11.015. |
| [19] | Rosenbaum JL, Witman GB. Intraflagellar transport[J]. Nat Rev Mol Cell Biol, 2002, 3(11): 813-825. DOI: 10.1038/nrm952. |
| [20] | Taschner M, Bhogaraju S, Lorentzen E. Architecture and function of IFT complex proteins in ciliogenesis[J]. Differentiation; Research in Biological Diversity, 2012, 83(2): S12-S22. DOI: 10.1016/j.diff.2011.11.001. |
| [21] | Silverman MA, Leroux MR. Intraflagellar transport and the generation of dynamic, structurally and functionally diverse cilia[J]. Trends in Cell Biology, 2009, 19(7): 306-316. DOI: 10.1016/j.tcb.2009.04.002. |
| [22] | Schmidt KN, Kuhns S, Neuner A, et al. Cep164 mediates vesicular docking to the mother centriole during early steps of ciliogenesis[J]. The Journal of Cell Biology, 2012, 199(7): 1 083-1 101. DOI: 10.1083/jcb.201202126. |
| [23] | Kobayashi T, Kim S, Lin YC, et al. The CP110-interacting proteins Talpid3 and Cep290 play overlapping and distinct roles in cilia assembly[J]. The Journal of Cell Biology, 2014, 204(2): 215-229. DOI: 10.1083/jcb.201304153. |
| [24] | Lu Q, Insinna C, Ott C, et al. Early steps in primary cilium assembly require EHD1/EHD3-dependent ciliary vesicle formation[J]. Nature Cell Biology, 2015, 17(3): 228-240. DOI: 10.1038/ncb3109. |
| [25] | Sorokin S. Centrioles and the formation of rudimentary cilia by fibroblasts and smooth muscle cells[J]. The Journal of Cell Biology, 1962, 15: 363-377. DOI: 10.1083/jcb.15.2.363. |
| [26] | Plotnikova OV, Seo S, Cottle DL, et al. INPP5E interacts with AURKA, linking phosphoinositide signaling to primary cilium stability[J]. Journal of Cell Science, 2015, 128(2): 364-372. DOI: 10.1242/jcs.161323. |
| [27] | Miyamoto T, Hosoba K, Ochiai H, et al. The microtubule-depolymerizing activity of a mitotic kinesin protein KIF2A drives primary cilia disassembly coupled with cell proliferation[J]. Cell Reports, 2015, pil:S2211-1247(15): 00004-2. |
| [28] | Kim S, Lee K, Choi JH, et al. Nek2 activation of Kif24 ensures cilium disassembly during the cell cycle[J]. Nature Communications, 2015, 6: 8 087. DOI: 10.1038/ncomms9087. |
| [29] | Milenkovic L, Weiss LE, Yoon J, et al. Single-molecule imaging of Hedgehog pathway protein Smoothened in primary cilia reveals binding events regulated by Patched1[J]. PNAS USA, 2015, 112(27): 8 320-8 325. DOI: 10.1073/pnas.1510094112. |
 2018, Vol. 39
2018, Vol. 39


